A principal manifestação de malformação sintomática da arterio-venosa (MVA) é a hemorragia intracraniana, tipicamente subaracnoídea ou intracerebral, como resultado de ruptura na remodelação localizada da parede destrutiva dos vasos. Outros sintomas típicos são ou irritação e frequentemente presentes como dor de cabeça e epilepsia, ou redução da circulação para áreas adjacentes do cérebro resultando em défices neurológicos focais não hemorrágicos. Para reduzir o risco de hemorragia, o objectivo terapêutico é excluir a MAV, o que pode ser feito endovascularmente, cirurgicamente, radiocirurgicamente ou por uma combinação de dois ou todos estes três métodos, dependendo das circunstâncias. Na presença de sintomas não hemorrágicos tais como dores de cabeça, epilepsia ou défices neurológicos focais, a oclusão parcial pode ser considerada para melhorar os sintomas. No caso de sintomas hemorrágicos, o encerramento de uma lesão (aneurisma) suspeita como fonte de hemorragia pode proteger parcialmente contra mais hemorragias da MAV no mesmo local, mas o encerramento completo da MAV é preferível, se possível, com risco aceitável.
As malformações arterio-venosas (MVA) são doenças vasculares circunscritas, frequentemente de origem à nascença, que se podem manifestar no decurso da vida com as consequências de múltiplas ligações de curto-circuito entre os sistemas arterial e venoso. Como com todas as doenças neurovasculares, existe a possibilidade de interferência com a circulação cerebral normal adjacente ou directamente com o cérebro.
As MVA do SNC são comparáveis em frequência e tipo às igualmente raras MVA de outros tecidos, que hoje em dia são normalmente tratadas apenas pelos seus sintomas. A diferença crucial reside no tipo de manifestação clínica, que na MAV do cérebro inclui hemorragia e sintomas neurológicos irritantes (epilepsia, dores de cabeça) ou disfunção neurológica – todas condições que limitam gravemente a qualidade de vida. Estes riscos, que acompanham tanto a abordagem observacional como a activa, tornam a decisão sobre o tratamento activo ou a adopção de uma atitude de espera no caso de uma descoberta acidental de uma MVA não fácil e frequentemente controversa.
Formação de um nidus
As AVM são provavelmente já criadas de forma fetal e tornam-se subsequentemente visíveis e proporcionalmente maiores à medida que crescem. Hoje em dia, a ressonância magnética está a ser cada vez mais realizada de forma fetal ou na primeira infância, e mesmo assim raramente mostra formas específicas de MVA por acaso. Por conseguinte, pode assumir-se que a maioria das MAV do cérebro, embora presumivelmente fetal, só se tornam visíveis no decurso da vida e, dependendo da sua localização, só se manifestam secundariamente.
As malformações arterio-venosas incluem múltiplos curtos-circuitos (fístulas AV) criados patologicamente entre artérias e veias, ou seja, sem uma pressão sanguínea interposta e velocidade do fluxo sanguíneo reduzindo a rede capilar. O gradiente de pressão AV resultante leva a uma circulação acelerada, uma chamada “derivação AV”. A sucção consecutiva leva à génese de numerosos novos vasos correspondentes à necessidade e puxa frequentemente para os territórios vizinhos de vasos arteriais e venosos colateralmente – forma-se uma rica rede de vasos arterio-venosos, um nidus. Dependendo da estrutura e localização do nidus da AVM e da sua relação com as artérias e veias das partes adjacentes do cérebro, pode ser muito compacto e circunscrito, mas também difusamente configurado, e neste caso mais difícil de distinguir do tecido cerebral normal.
Estenoses e ectasias
O aumento da circulação pode levar ao envelhecimento prematuro e ao desgaste da secção afectada do vaso, o que pode resultar na formação de estenoses e ectasias vasculares. Ambos os tipos de alterações de parede estão agora associados a um risco acrescido de hemorragia, ectasia arterial e venosa como local de enfraquecimento das paredes dos vasos e estenose obstrutiva como indicador de pressão pré-nótica potencialmente elevada – circunstâncias melhor avaliadas pelo exame angiográfico do cateter. Ainda hoje, os métodos de imagem transversais falham largamente esta informação, o que é crucial para uma decisão de tomar uma acção activa.
Apanhar processos destrutivos a tempo
Tal como noutras doenças neurovasculares, por exemplo também nos aneurismas, os processos aterotrombóticos que estão circunscritos à parede do vaso são agora considerados responsáveis por alterações inflamatórias adjacentes que enfraquecem a parede do vaso [1, 2]. A dificuldade é detectar a tempo e correctamente estes processos de remodelação destrutivos biológicos devido à sua subtileza, a fim de evitar potenciais hemorragias.
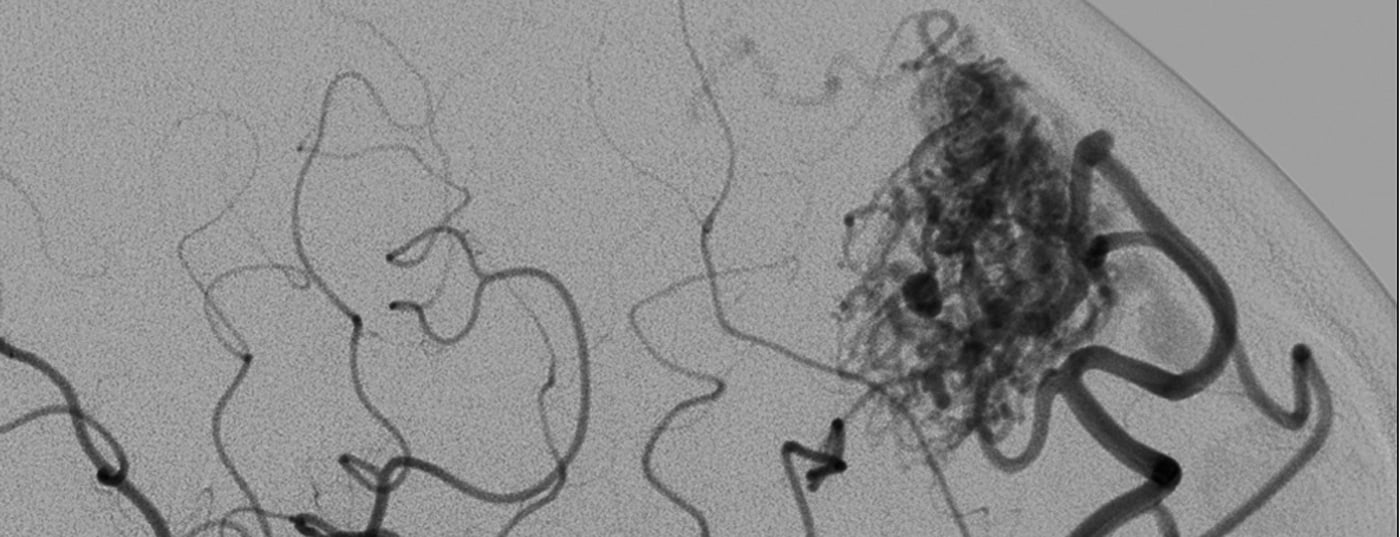
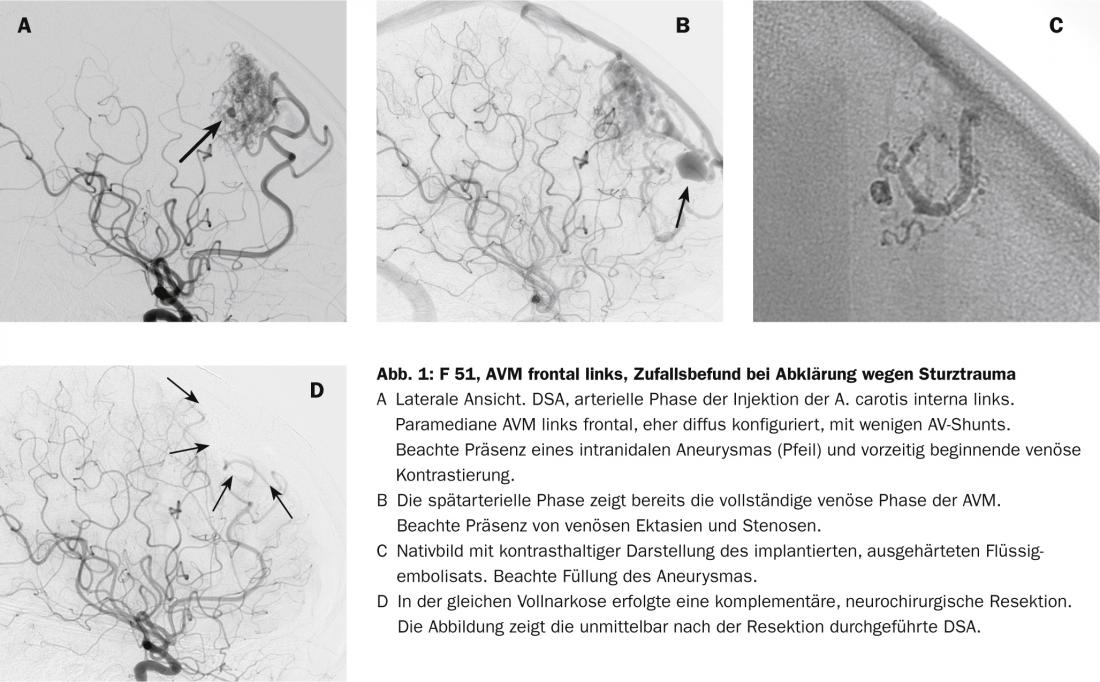
Como estatisticamente a MAV é rara, a patomorfologia é altamente variável e o comportamento biológico é adicionalmente variável individualmente, o prognóstico fiável de um risco de hemorragia continua a ser difícil [3–6]. Para além do tamanho e localização, os critérios morfológicos vasculares que influenciam o prognóstico incluem a formação de aneurisma arterial, ectasia venosa e, em particular, estenoses associadas à saída venosa (Fig. 1). Embora se suspeite que os processos biológicos sejam responsáveis pela tendência de sangramento, não existem outros marcadores biológicos fiáveis que possam ser utilizados para avaliar de forma fiável a condição e o curso potencial de uma malformação vascular [2].
O achado acidental
A qualidade actual da imagiologia médica utilizando ressonância magnética (RM) e tomografia computorizada (TC) permite frequentemente identificar uma MVA sem a procurar especificamente, criando a situação típica de uma MVA assintomática encontrada por acaso.
O ARUBA internacional multicêntrico RCT (“A Randomised Trial of Unruptured Brain AVMs”; http://avm.ucsf.edu/patient_info/aruba_trial), iniciado em 2007, compara a abordagem observacional com o tratamento activo e argumenta contra uma abordagem activa a descobertas acidentais de acordo com dados actualmente conhecidos. Espera-se para breve uma avaliação detalhada dos dados obtidos.
Embora as malformações arteriovenosas intracranianas sejam muito raras, deve assumir-se que a incidência real é um pouco subestimada com uma prevalência actualmente estimada em 15 por 100000. A incidência anual (apresentação sintomática) de malformações AV é de 1-2/100000 por ano. Para as MAV que não se manifestaram através de hemorragias, as diferenças nas várias séries publicadas são relativamente pequenas, de modo que se pode assumir um risco de hemorragia entre 2 e 4% por ano. Depois de uma MVA ter sangrado, o risco de mais hemorragias aumenta.
As associações familiares de malformações AV são vistas clinicamente quase exclusivamente em associação com a síndrome de Osler-Weber-Rendue (telangiectasia hemorrágica hereditária, HHT) e de outra forma ocorrem esporadicamente. Como regra, a ocorrência esporádica de uma MVA torna desnecessário um esclarecimento dos membros da família.
Em qualquer caso, uma malformação AV deve ser esclarecida em pormenor através de uma angiografia de cateter, a fim de poder registar e avaliar factores que representam um risco acrescido para o doente. Os parâmetros seguintes são indicadores reconhecidos de um risco acrescido de hemorragia pelas razões acima expostas e pelas publicações:
- Pequena malformação AV (tamanho do nidus <3 cm)
- Localização profunda (peri- ou intraventricular, ou nos gânglios basais)
- Drenagem venosa profunda e ectasia venosa associada à estenose e aneurismas associados à justaposição ou intranidial.
Se já ocorreu hemorragia, o risco de hemorragia é significativamente aumentado, especialmente nos primeiros seis meses [7].
Os sintomas iniciais não hemorrágicos são
Epilepsia: As crises epilépticas são o sintoma inicial em mais de um terço dos doentes. Na maioria dos pacientes, os ataques são focais ou complexos focais, com a MAV cortical mais comummente associada a ataques. Muitos pacientes podem ser controlados relativamente bem com medicação.
Dores de cabeça: As dores de cabeça crónicas estão presentes em cerca de 30% dos doentes com MVA. A obliteração endovascular de qualquer envolvimento de fornecimento arterial meníngeo resulta geralmente numa redução acentuada de tais dores de cabeça, o que é indicativo de irritação meníngea. São discutidos mecanismos como a irritação das artérias cerebrais que levam à dor de cabeça, o nervi vasorum dos segmentos da artéria cerebral proximal poderia possivelmente permitir que os sinais de dor fossem percebidos.
Défices neurológicos focais: Os défices neurológicos focais estão também presentes em quase um terço dos doentes com MAV. Estes podem ser progressivos, estáveis ou flutuantes. O mecanismo destes défices focais varia. Por vezes uma condição póstuma pode estar escondida por detrás desses défices focais, mas mais frequentemente pode haver uma perturbação circunscrita da circulação cerebral (fenómeno do “roubo”). Assim, por vezes uma hipertensão venosa regional está provavelmente por detrás dela ou também um efeito irritante e pulsátil de ocupação de espaço de uma ectasia vascular.
Opções terapêuticas
Em princípio, as malformações AV podem ser tratadas com neurocirurgia, neurointervenção ou radioterapia. O objectivo dos três tratamentos individualmente ou em combinação de duas ou três terapias deve ser o de fechar completamente a MVA. A hipótese por vezes existente de que uma redução do tamanho da MVA também leva a uma redução do risco de hemorragia não é correcta. Pelo contrário, uma mudança na hemodinâmica de uma MVA (consequência virtualmente inevitável de uma redução de tamanho sem oclusão completa) pode também conduzir a um aumento do risco de hemorragia e não deve, em circunstância alguma, acalmar uma pessoa numa falsa sensação de segurança.
Em princípio, a decisão a favor ou contra uma terapia específica para um angioma AV deve ser tomada numa base interdisciplinar. Na nossa opinião, a terapia neurocirúrgica e a terapia intervencionista sozinhas ou em combinação desempenham o papel mais importante (Fig. 1). No caso de MAV profundas ou de MAV de tronco cerebral, que são fornecidas através de múltiplas artérias perfurantes, a radiocirurgia é significativamente menos arriscada. Devido à latência entre a terapia e o encerramento da MAV após radioterapia, a extirpação cirúrgica e a terapia endovascular devem ser favorecidas isoladamente ou em combinação, a fim de se obter um efeito preventivo rápido.
Tratamento endovascular
O acesso de um cateter super-selectivo endovascular a uma MVA, normalmente realizado sob anestesia, é agora um procedimento de rotina e, desde que as dimensões do vaso o permitam, praticamente qualquer ramo do vaso pode ser abordado. A imagem de lúmen de vasos super-selectivos permite uma análise fina da morfologia do vaso e do nidus, ao mesmo tempo que abre a opção de fecho endovascular. Para este fim, são normalmente utilizados adesivos líquidos polimerizantes ou substâncias precipitantes, baixas ou não adesivas. Sob controlo visual fluoroscópico e biplano, estas substâncias são injectadas gradualmente, evitando a oclusão dos vasos adjacentes normais.
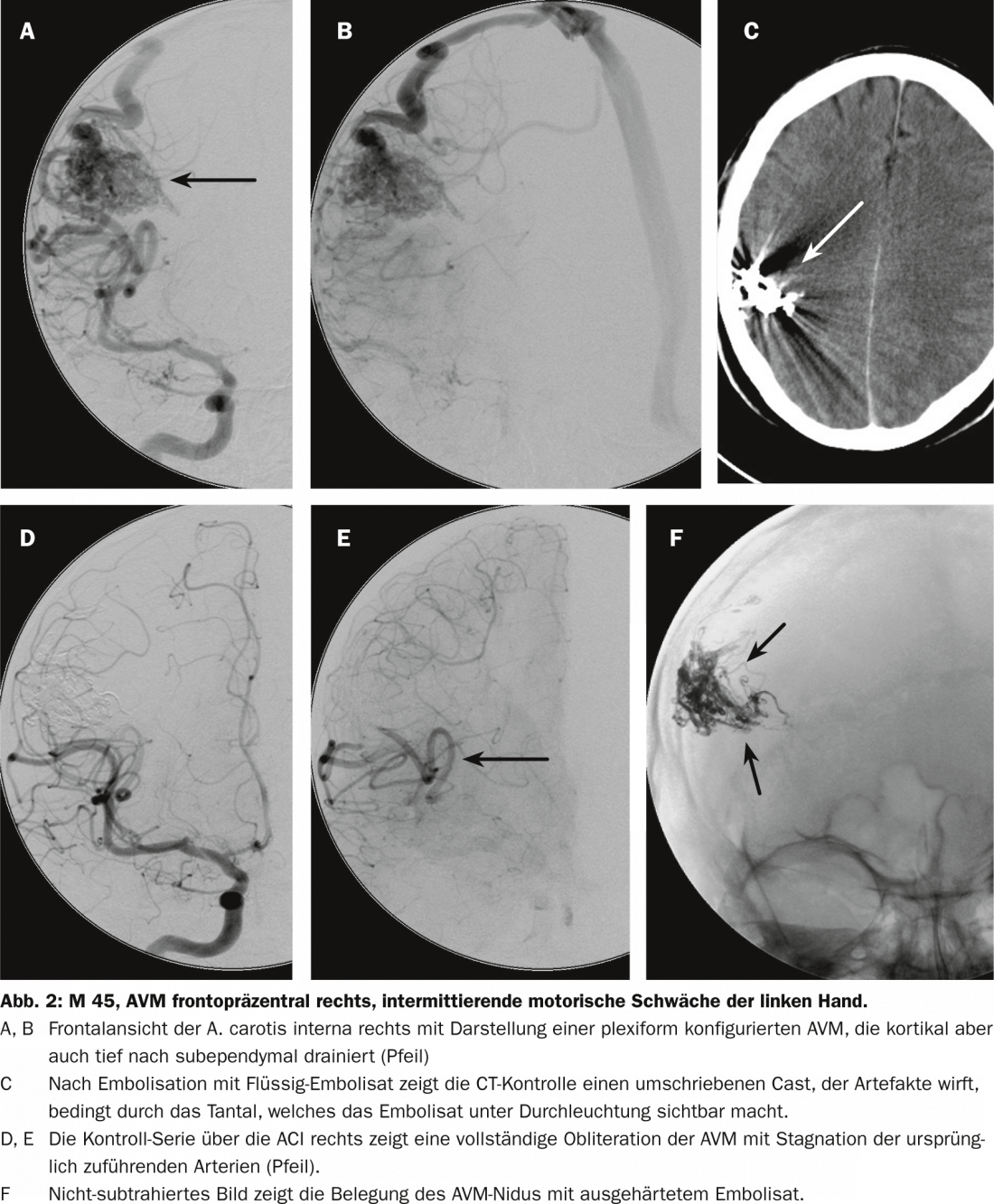
O risco reside na obliteração de vasos normais e na hemorragia causada pela injecção e manipulação endovascular. Estes são riscos que só são tomados se forem considerados proporcionais ao risco de hemorragia espontânea avaliado. Utilizamos sobretudo uma substância precipitante. Uma vez alcançada a posição do cateter intranidal, este é lentamente injectado no nidus. É muitas vezes possível fechar grandes partes da MVA ou mesmo toda a MVA com uma única posição de cateter. No entanto, dependendo da compartimentação, pode evidentemente ser necessário fechar tal AVM em duas ou três posições. A taxa de oclusões completas aumentou significativamente desde a utilização de tais substâncias (Fig. 2) [8].
Tratamento neurocirúrgico
As malformações superficiais e pequenas AV podem ser operadas e completamente removidas com mortalidade e morbilidade muito baixas, enquanto que as malformações AV profundas e grandes drenando através do parênquima cerebral podem ser associadas a uma morbilidade e mortalidade cirúrgicas dramaticamente mais elevadas, até mais de 50%. Uma grande meta-análise de 2000 com mais de 2400 pacientes mostrou que a mortalidade média após a extirpação neurocirúrgica é de 3,3% e a morbilidade média é de 8,6% (1,5-18,7%) [9].
O risco do tratamento neurocirúrgico deve ser avaliado individualmente utilizando a classificação de acordo com Spetzler e Martin. A graduação da Spetzler-Martin AVM baseia-se no tamanho, drenagem venosa e eloquência do tecido cerebral circundante, com base na angiografia do cateter, TC ou RM. A graduação da lesão é determinada através da soma dos pontos individuais. Quanto maior for a pontuação, maior será o risco operatório neurocirúrgico de morbidade ou mortalidade.
Esta classificação não fornece um prognóstico relativamente aos riscos de qualquer terapia endovascular associada.
Radiocirurgia estereotáxica
Na radioterapia estereotáxica, que é realizada numa única sessão como a chamada radiocirurgia, o início gradual do efeito da radiação, que dura até um máximo de 1 a 2 anos após a conclusão da terapia, é de particular importância. O sucesso obliterativo do tratamento, que pode ser observado cerca de cinco anos após a terapia, depende decisivamente do tamanho da MVA e do diâmetro dos vasos que a abastecem. Para a AVM com um nidus de tamanho inferior a 15 mm, a taxa de obliteração completa é de 77%; se o nidus estiver entre 15 e 25 mm, a taxa de obliteração é de 62%, reduzindo para 44% se o nidus for maior que 25 mm. Com influxos duros adicionais, a probabilidade de obliteração completa é apenas metade do que é elevado. As complicações de tratamento diferido da radioterapia, principalmente devido à necrose por radiação no tecido cerebral adjacente, são de 5-7%; além disso, existe um risco persistente de hemorragia de 3-4% por ano enquanto a MVA não tiver sido fechada.
Cooperação Multidisciplinar
O aconselhamento e tratamento da MVA cerebral é melhor feito de forma multidisciplinar por uma equipa médica constituída por neuroradiologistas intervencionistas, neurocirurgiões e radioterapeutas associados à avaliação crítica por neurologistas e, se apropriado, neuropsicólogos e psiquiatras. Os cuidados pós-terapêuticos são prestados em estreita cooperação com os neurointensivistas e, se necessário, com uma rede de reabilitação e reinserção social.
A exclusão preventiva da hemorragia por tratamento da MVA assintomática é agora questionada, uma vez que os riscos de terapia invasiva são actualmente considerados mais elevados do que os de um curso espontâneo. Assim, é necessário um cuidado a longo prazo dos pacientes e familiares, especialmente quando se decide por uma abordagem não activa, e uma relação médico-paciente contínua é vantajosa.
Literatura:
- Chen Y, et al.: Evidência do envolvimento de células inflamatórias em malformações arteriovenosas do cérebro. Neurocirurgia 2008; 62(6): 1340-1349 (discussão 1349-1350).
- Kim H, et al: Considerações genéticas relevantes para a hemorragia intracraniana e malformações arteriovenosas do cérebro. Acta Neurochir Suppl 2008; 105: 199-206.
- Laakso A, Hernesniemi J: Malformações arteriovenosas: Epidemiologia e apresentação clínica. Neurosurg Clin N Am 2012; 23(1): 1-6.
- Laakso A, et al: Risco de hemorragia em pacientes com malformações arteriovenosas de grau IV e V de spetzler-martin não tratadas: Um estudo de acompanhamento a longo prazo em 63 pacientes. Neurocirurgia 2011; 68(2): 372-377; (discussão 378).
- Hernesniemi JA, et al: Natural history of brain arteriovenous malformations: Um estudo de acompanhamento a longo prazo do risco de hemorragia em 238 pacientes. Neurocirurgia 2008; 63(5): 823-829 (discussão 829-831).
- Al-Shahi R, Warlow C: Uma revisão sistemática da frequência e prognóstico das malformações arteriovenosas do cérebro em adultos. Cérebro 2001; 124: 1900-1926.
- Stapf C, et al.: Preditores de hemorragia em pacientes com malformação arteriovenosa cerebral não tratada. Neurologia 2006; 66(9): 1350-1355.
- Panagiotopoulos V, et al: Embolização de malformações arteriovenosas intracranianas com copolímero de álcool etileno-vinílico (ônix). AJNR Am J Neuroradiol 2009; 30(1): 99-106.
- Castel JP, Kantor G: Morbilidade e mortalidade pós-operatória após exclusão microcirúrgica de malformações arteriovenosas cerebrais. Dados actuais e análise da literatura recente. Neurocirurgia 2001; 47(2-3): 369-383.