Estudos demonstraram que o transporte alterado de células imunitárias e as células imunitárias patogénicas são factores cruciais responsáveis pela inflamação da mucosa e pela destruição dos tecidos na DII. Uma barreira intestinal defeituosa e a disbiose microbiana conduzem a essa acumulação e à ativação local de células imunitárias, resultando num ciclo de citocinas pró-inflamatórias que se sobrepõe aos sinais anti-inflamatórios e causa inflamação intestinal crónica.
As doenças inflamatórias intestinais (DII), como a doença de Crohn (DC) e a colite ulcerosa (CU), caracterizam-se por uma ativação descontrolada das células imunitárias do intestino num indivíduo geneticamente suscetível. Até à data, a imunopatologia da DII não pode ser totalmente explicada. No entanto, os componentes individuais que contribuem para a progressão deste processo inflamatório crónico, incluindo factores ambientais, processos de migração alterados das células imunitárias, bem como factores genéticos, microbianos e imunológicos, têm sido continuamente investigados. Após o contacto do organismo com um antigénio, ocorre a ativação das células apresentadoras de antigénios (APC) (resposta inflamatória vs. tolerogénica). As APC podem produzir mediadores como a interleucina 12, levando à ativação, proliferação e impressão de células T com um fenótipo intestinal através da regulação positiva de moléculas de adesão específicas. Uma barreira intestinal defeituosa e a disbiose microbiana levam a uma acumulação e ativação local de células imunitárias, resultando num ciclo de citocinas pró-inflamatórias que se sobrepõe aos sinais anti-inflamatórios e causa inflamação intestinal crónica. Estudos de associação genética identificaram mais de 250 genes de suscetibilidade para a doença inflamatória intestinal, revelando aspectos fundamentais da biologia molecular da doença, incluindo o papel da autofagia e da sinalização e desenvolvimento das células Th17.
Para além das influências genéticas, incluindo polimorfismos genéticos do hospedeiro numa série de genes envolvidos no reconhecimento e processamento microbianos, verificou-se que factores ambientais como o estilo de vida, a dieta e os medicamentos também afectam o equilíbrio, frequentemente através da sua influência na composição do microbiota intestinal. É agora amplamente aceite que a DII é o resultado de uma “tempestade perfeita” de interacções entre uma microbiota disbiótica, um sistema imunitário anormal e influências ambientais num hospedeiro suscetível, explica o Prof. Dr. Michael Scharl, Diretor Adjunto da DII. Diretor Clínico da Clínica de Investigação e Ensino de Gastroenterologia e Hepatologia, Hospital Universitário de Zurique (Fig. 1) [1,2].
Visão geral da estrutura e função do sistema imunitário associado ao intestino
Esta rutura da barreira permite a translocação de antigénios bacterianos presentes nos alimentos e em certas regiões do lúmen intestinal para a parede intestinal, onde encontram o maior conjunto de células imunitárias do corpo humano – o sistema imunitário muscular, continuou Scharl. O contacto com o antigénio é seguido da ativação de células apresentadoras de antigénio (APC) (resposta inflamatória vs. tolerogénica). As APC podem produzir mediadores como a interleucina 12, que conduzem à ativação, proliferação e diferenciação de células T com um fenótipo intestinal através da regulação positiva de moléculas de adesão específicas. Após a recirculação, estes subconjuntos de células T podem subsequentemente migrar ao longo de gradientes quimiotácticos para o intestino como tecido-alvo, onde interagem com moléculas expressas por células endoteliais e iniciam o processo de extravasamento em várias etapas do homing intestinal. Uma vez no local de ação, as células T adaptam a composição das suas moléculas de superfície ao seu ambiente, o que resulta na sua retenção no tecido ou, se não forem activadas, na sua reciclagem para o sangue e a linfa. Se a ativação local das células T através da apresentação de antigénios tiver lugar no tecido intestinal, estas podem causar danos potenciais maciços no intestino inflamado [1,2].
Respostas imunitárias desreguladas causam a DII
Para além de um número aumentado de células T, que são particularmente prevalentes em doentes com DC, tanto os doentes com DC como os doentes com CU apresentam um número aumentado das chamadas células T helper tipo 17 (células Th17), que produzem a citocina caraterística (interleucina 17A). Além disso, os doentes com CU também têm um número aumentado de células imunitárias do tipo 2 (células Th2), que produzem interleucina 5, por exemplo. As citocinas típicas das células Th2 são a IL-4 e a IL-13, que são explosões de células imunitárias pró-inflamatórias activadas, e estas respostas imunitárias pró-inflamatórias são contra-reguladas por respostas imunitárias anti-inflamatórias mediadas, por exemplo, por células T reguladoras (IL-10 e TGF-beta) ou células Th1. Estas células também podem ser imunopatogénicas e exibem as seguintes citocinas típicas: IFN-gama, TNF-alfa.
Em particular, o desequilíbrio entre as citocinas pró-inflamatórias e anti-inflamatórias que ocorre na DII impede a resolução da inflamação e, em vez disso, leva à persistência da doença e à destruição dos tecidos. As citocinas desempenham um papel central na modulação do sistema imunitário intestinal. São produzidos por linfócitos (especialmente células T de fenótipo Th1 e Th2), monócitos, macrófagos intestinais, granulócitos, células epiteliais, células endoteliais e fibroblastos. Têm funções pró-inflamatórias [interleucina-1 (IL-1), fator de necrose tumoral (TNF-alfa), IL-12] ou anti-inflamatórias [antagonista do recetor da interleucina-1 (IL-1ra), IL-10, fator de crescimento transformador β (TGFβ)]. As concentrações mucosas e sistémicas de muitas citocinas pró e anti-inflamatórias estão aumentadas na DII. Estudos de associação do genoma identificaram vários loci de suscetibilidade para a DII que contêm genes que codificam citocinas e proteínas envolvidas na sinalização de citocinas. Em particular, foi demonstrado que as mutações de perda de função nos genes que codificam a interleucina-10 (IL-10) e o recetor da IL-10 estão associadas a DII de início muito precoce [3,4].
Alterações do microbiota intestinal devido à terapêutica
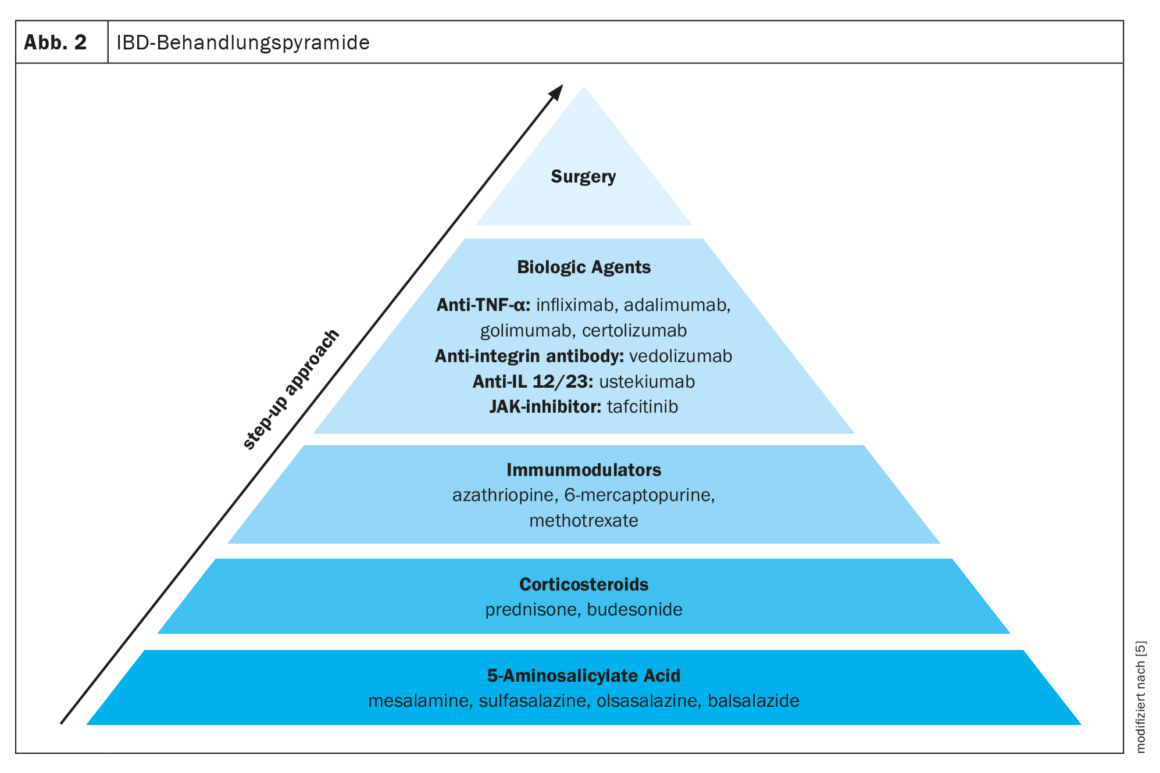
Existem vários medicamentos disponíveis para o tratamento da DII. É frequentemente utilizada uma abordagem faseada para o tratamento, passando de medicamentos menos específicos, como o ácido 5-aminossalicílico, para medicamentos mais potentes, como os corticosteróides, imunomoduladores e biológicos, dependendo da gravidade da DII. Para além da medicação, a única outra opção é a cirurgia (Fig. 2) [5].
Uma análise detalhada dos potenciais mecanismos de ação das terapias imunomoduladoras atualmente disponíveis mostra que estas visam vários alvos potenciais no sistema imunitário da mucosa, tais como células imunitárias como as células B, macrófagos e células T, bem como alvos na área do tráfico e migração das células T. O ustekinumab, por exemplo, bloqueia a diferenciação em células Th1 pró-inflamatórias; o ozanimod inibe a migração de células T pró-inflamatórias do gânglio linfático para os linfáticos de drenagem; O vedolizumab bloqueia especificamente a migração de células T efectoras pró-inflamatórias dos vasos sanguíneos para os tecidos intestinais; e os inibidores anti-TNF, anti-IL12/23 e JAK bloqueiam a função ou a transcrição das citocinas para quebrar o ciclo inflamatório [5].
Ustekinumab: Diferenciação em células pró-inflamatórias Th1 efectoras
Uma visão detalhada da diferenciação das células T-helper nos gânglios linfáticos regionais mostra a ativação de células apresentadoras de antigénios que produzem interleucina 12. Esta encontra-se com as células T naive, que sofrem uma diferenciação adicional nas chamadas células Th1. Estas células Th1 polarizadas têm receptores de homing, como o α4β7, que lhes permitem reinvadir o microbiota intestinal e expressar o recetor de interleucina-12. O ustekinumab, que tem como alvo a interleucina 12, pode suprimir esta via de sinalização, inibindo assim a polarização das células Th1. O anticorpo monoclonal humano liga-se especificamente à subunidade p40 da IL-12/23, impedindo a IL-12 e a IL-23 de se ligarem aos seus complexos receptores de superfície celular, bloqueando assim as vias inflamatórias T helper (Th) 1 (IL-12) e Th17 (IL-23). O ustekinumab está aprovado na Suíça tanto para a DC como para a CU e é administrado como uma perfusão intravenosa durante a indução numa dose de indução de 6 mg/kg. Após uma única perfusão, a terapêutica é alterada para terapêutica de manutenção com administração subcutânea, 90 mg, q12w/q8w (revisão 1) [3,4].
Ozanimod: migração de células T efectoras pró-inflamatórias do nódulo linfático para os vasos linfáticos de drenagem
Após a preparação das células T, surgem células efectoras polarizadas. Estas células saem do gânglio linfático regional para alcançar os vasos linfáticos eferentes e a corrente sanguínea. Trata-se de um processo ativo que cria um gradiente quimiotático que é mediado, pelo menos em parte, pela molécula S1P. O S1P liga-se ao recetor S1P nas células T, esta via permite que as células deixem o nódulo linfático. O ozanimod, um agonista do recetor S1P, interfere com este ponto final do gradiente e impede a saída das células T do gânglio linfático regional. Assim, as células T afectadas, altamente polarizadas, já não podem regressar à circulação. O agonista dos receptores S1P, que foi previamente estudado em doentes com esclerose múltipla, está aprovado na Suíça para a UC. O Ozanimod é administrado por via oral em três fases, 0,23 mg dia 1-4 qd; 0,46 mg dia 5-7 qd; e 0,92 mg qd depois disso (Visão Geral 2) [3,4].
O ozanimod é considerado uma nova opção para os doentes com CU. No entanto, como se trata de um agente biológico mais recente no tratamento da DII, são necessários mais dados do mundo real para além dos ensaios clínicos para avaliar onde o agonista do recetor S1P se integra na terapia da DII, explica o Prof. Dr. Markus Neurath, Diretor Clínico do Hospital Universitário de Erlangen. Em particular, os efeitos secundários cardiovasculares reais e a necessidade de um ECG sublinham a falta de experiência na prática clínica de rotina para que este medicamento possa eventualmente ser posicionado em doentes com UC, acrescentou Neurath.
Vedolizumab: migração de células T efectoras pró-inflamatórias dos vasos sanguíneos para o tecido intestinal
O vedolizumab é um anticorpo monoclonal humanizado da imunoglobulina G1 (IgG1). O seu mecanismo de ação seletivo para o intestino distingue o vedolizumab dos medicamentos biológicos existentes para o tratamento da DII, que se baseiam na imunossupressão sistémica. O anticorpo de imunoglobulina G1 (IgG1) bloqueia especificamente a integrina α4β7 na superfície da subpopulação de linfócitos activados que circulam na corrente sanguínea e que estão predispostos a dirigir-se para o trato gastrointestinal. Este bloqueio interrompe um mecanismo fisiopatológico essencial da DII que normalmente permite que os linfócitos adiram ao endotélio do trato gastrointestinal. Sem esta adesão, os linfócitos deixam de poder migrar da corrente sanguínea para o trato gastrointestinal inflamado, provocando a diminuição da inflamação localizada e preparando o terreno para o controlo a longo prazo da doença. O vedolizumab não interrompe o mecanismo de retorno das populações de linfócitos para outros tecidos, por exemplo, para o sistema nervoso central (SNC), mas actua como um medicamento dirigido seletivamente para a parede intestinal através de imunossupressão não sistémica. O anticorpo imunoglobulina G1 (IgG1) está aprovado para a DC e CU e é administrado por via intravenosa (300 mg semana 0,2,6; depois 300 mg q8w) ou por via subcutânea (300 mg semana 0,2; depois 108 mg q2w) (Visão geral 3) [3,4,6].
Efeitos pro-inflamatórios pleiotrópicos do TNF
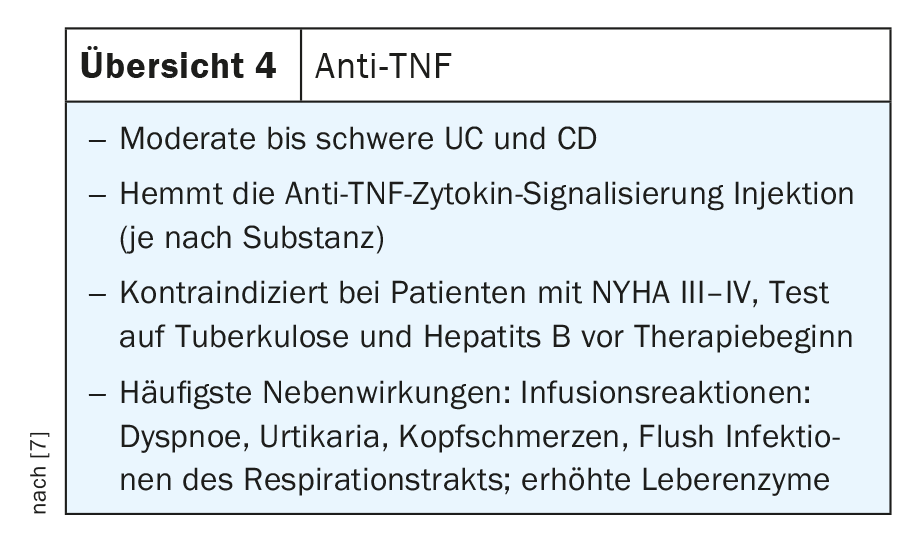
O TNF é um mediador crucial no controlo dos processos inflamatórios no intestino e tem sido utilizado na prática clínica de rotina há mais de 20 anos. O TNF e os seus receptores estão crucialmente envolvidos na patogénese da DII. Por exemplo, foram encontrados níveis aumentados da forma solúvel de TNFR1 e TNFR2 em doentes com DC e CU, e a sua expressão correlacionou-se com a atividade da doença.
Os anticorpos anti-TNF bloqueiam tanto a forma precursora transmembranar (mTNF) como a forma solúvel (sTNF), reduzindo assim o meio pró-inflamatório no intestino ao bloquear a interação entre o TNF e o recetor do TNF, bloqueando assim vários tipos de células imunitárias pró-inflamatórias. Além disso, o TNF provoca a morte das células epiteliais. Assim, os anticorpos anti-TNF têm vários mecanismos de ação que podem ser utilizados na prática clínica em doentes com DII, tanto com DC como com CU. Os anticorpos anti-TNF comprovados para utilização clínica de rotina incluem o infliximab, o adalimumab, o golimumab e o certoliizumab pegol, cada um com diferentes aplicações. Alguns deles estão disponíveis para terapia intravenosa, alguns estão disponíveis tanto para terapia subcutânea como intravenosa e outros estão disponíveis apenas para administração subcutânea (revisão 4) [7].
De acordo com Neurath, os vários anticorpos anti-TNF provaram a sua eficácia na prática clínica e ainda hoje são utilizados de forma selectiva. A escolha da via intravenosa ou subcutânea depende um pouco do contexto clínico. Se a atividade clínica for elevada ou se o doente estiver hospitalizado, a administração intravenosa é certamente uma boa forma de administrar anticorpos anti-TNF, especialmente em doentes com uma atividade muito elevada que perdem muitos anticorpos nas fezes. Neurath acrescenta que não é absolutamente necessário determinar medições do nível de vales ou verificar o estado dos anticorpos. Normalmente, isto só é feito em doentes com ausência de resposta ou perda secundária de eficácia, ou em doentes que não conseguem obter a resposta clínica primária desejada. Neste caso, existem várias opções, acrescenta Neurath: mudar para outro agente ou adicionar um imunossupressor, como a azatioprina, para suprimir as respostas das células B e os anticorpos anti-droga. O ensaio SONIC já demonstrou que a terapêutica combinada, como a azatioprina e o infliximab, é superior à monoterapia com apenas um dos dois. No entanto, a terapêutica combinada deve depender da atividade clínica. Em alternativa, o doente pode ser monitorizado clinicamente, por exemplo, com exames de ultra-sons para proteger os níveis de PCR e actividades clínicas para determinar se o doente está em remissão clínica. Se ocorrerem problemas, a terapia pode então ser intensificada, por exemplo, encurtando o intervalo de infusão e aumentando a dose do agente ativo, ou mudada para outra classe de agentes biológicos.
Atividade das células pró-inflamatórias Th17 efectoras
O ustekinumab é um anticorpo que bloqueia não só a IL 12, mas também a interleucina 23. A IL-23 leva à ativação e manutenção das funções efectoras das células Th17 pró-inflamatórias no tecido intestinal. O ustekinumab reduz a atividade das células Th17 pró-inflamatórias no tecido intestinal ao bloquear a interação Il-23/Il-23R. Com base nestas descobertas, estão atualmente a ser feitas tentativas para desenvolver antagonistas selectivos contra a interleucina 23. Estes não se destinam a ter como alvo a subunidade P40, como é o caso do ustekinumab, mas a subunidade P19, que é exclusiva da interleucina 23 e não se encontra na interleucina 12. Alguns agentes para este efeito já se encontram em ensaios clínicos e, mais cedo ou mais tarde, serão utilizados na prática clínica, por exemplo, o risankizumab, o mirikizumab, o guselkumab e o brazikumab. Além disso, alguns dados preliminares sugerem que os bloqueadores P19 também podem ser eficazes quando os bloqueadores P40 não funcionaram anteriormente (revisão 5) [3,4].
Sinalização de citocinas através das vias de sinalização JAK/STAT
A via de sinalização da quinase Janus e do ativador da transcrição (JAK-STAT) desempenha um papel importante na transmissão de sinais dos receptores da membrana celular para o núcleo. Muitas citocinas pró-inflamatórias induzem a transcrição de genes efectores na célula alvo através da ativação de vias de sinalização JAK/STAT específicas. A família JAK humana é constituída por quatro JAKs: JAK1, JAK2, JAK3 e TYK2. O tofacitinib, um inibidor que tem como alvo principal a JAK 1 e a JAK 3 e, em menor grau, a JAK 2, reduz a transcrição de genes de sinalização pró-inflamatória e de genes efectores através do bloqueio da atividade da quinase JAK. O tofacitinib é uma pequena molécula que actua em várias citocinas simultaneamente e está disponível por via oral. No entanto, até à data, o inibidor só foi aprovado para a CU, mas não para a DC (Visão Geral 6) [8–10].
Devido à sua atividade imunomoduladora e ao risco de eventos cardiovasculares e tromboembólicos, foram impostas restrições à sua utilização desde que o tofacitinib foi aprovado, o que faz com que não seja o medicamento de primeira escolha, afirmou Neurath. Em particular, os doentes idosos com doença cardiovascular e um risco potencialmente aumentado de acontecimentos tromboembólicos devem ser cuidadosamente testados antes de iniciar a terapêutica.
Na Suíça, apenas o tofacitinib está atualmente disponível para a inibição da JAK. No entanto, devido à diversidade de estudos, os inibidores da JAK estão cada vez mais a ser aprovados ou a ser objeto de ensaios clínicos, pelo que, mais cedo ou mais tarde, toda uma gama de inibidores da JAK estará disponível para a prática clínica. Aqui, as mais pequenas alterações na afinidade das moléculas farão uma grande diferença clínica. De acordo com Neurath, pode haver diferenças relevantes entre os vários inibidores de JAK-1, por exemplo, mas isso ainda precisa de ser investigado. A patogénese torna claro que estes agentes interferem com a ativação das células imunitárias. Será interessante comparar a eficácia, mas sobretudo o perfil de segurança, acrescenta Neurath. Isto porque a segurança, em particular, desempenha um papel decisivo para a rotina clínica, mas também para os doentes.
Opções futuras e terapias combinadas para a DII
De acordo com Neurath, estão disponíveis os primeiros dados de um estudo de combinação com bloqueadores P19 e anticorpos anti-TNF e estão em curso outros estudos [11]. Essencialmente, foi utilizada aqui uma terapêutica combinada para induzir a remissão, pelo que não se trata de uma terapêutica combinada para toda a vida. No entanto, esta pode ser uma opção para os doentes difíceis de tratar. O vedolizimab, em particular, parece ser um parceiro atrativo para as terapias combinadas, uma vez que tem um mecanismo de ação molecular muito diferente do de outros agentes, pelo que é fácil, pelo menos, postular que poderá haver sinergias, acrescentou Neurath. Além disso, é um agente muito mais seguro que tem um bom perfil de segurança, o que o torna uma linha de base ideal para qualquer abordagem combinada. No entanto, Neurath não vê grande potencial para a combinação de inibidores de JAK com agentes biológicos.
Mensagens para levar para casa
- As terapêuticas imunomoduladoras visam diferentes alvos potenciais no sistema imunitário da mucosa.
- O ustekinumab bloqueia a diferenciação em células Th1 (através da IL-12), bem como a citocina IL-23.
- O ozanimod inibe a migração de células T pró-inflamatórias do nódulo linfático para os vasos linfáticos de drenagem.
- O vedolizumab bloqueia especificamente a migração de células T efectoras pró-inflamatórias dos vasos sanguíneos para o tecido intestinal.
- Os inibidores anti-TNF, anti-IL12/23 e JAK bloqueiam a função das citocinas para parar a inflamação.
Literatura:
- Neurath MF: Targeting immune cell circuits and trafficking in inflammatory bowel disease. Nat Immunol 2019; doi: 10.1038/s41590-019-0415-0.
- de Lange KM, et al: Estudo de associação de todo o genoma implica a ativação imune de múltiplos genes de integrina na doença inflamatória intestinal. Nat Genet 2017; doi: 10.1038/ng.3760.
- Neurath MF: Citocinas na doença inflamatória intestinal. Nat Rev Immunol 2014; doi: 10.1038/nri3661.
- Neurath MF: Alvos terapêuticos actuais e emergentes para a DII. Nat Rev Gastroenterol Hepatol 2017; doi: 10.1038/nrgastro.2016.208.
- Wu N, et al: Doença inflamatória intestinal e a microbiota intestinal. Proc Nutr Soc 2021; doi: 10.1017/S002966512100197X.
- Denucci CC, et al.: Integrin function in T-cell homing to lymphoid and nonlymphoid sites: getting there and staying there. Crit Rev Immunol 2009; doi: 10.1615/critrevimmunol.v29.i2.10.
- Billmeier U, et al.: Mecanismo molecular de ação dos anticorpos anti-fator de necrose tumoral nas doenças inflamatórias intestinais. World J Gastroenterol 2016; doi: 10.3748/wjg.v22.i42.9300.
- Vetter M, Neurath M: Emerging oral targeted therapies in inflammatory bowel diseases: opportunities and challenges. Therap Adv Gastroenterol 2017; doi: 10.1177/1756283X17727388.
- Seif F, et al.: O papel da via de sinalização JAK-STAT e seus reguladores no destino das células T auxiliares. Cell Commun Signal 2017; doi: 10.1186/s12964-017-0177-y.
- Danese S, et al: Seletividade JAK para o tratamento da doença inflamatória intestinal: tem importância clínica? Gut 2019; doi: 10.1136/gutjnl-2019-318448.
- Feagan BG, et al: Guselkumab plus golimumab combination therapy versus guselkumab or golimumab monotherapy in patients with ulcerative colitis (VEGA): a randomised, double-blind, controlled, phase 2, proof-of-concept trial. Publicado em: 01 de fevereiro de 2023 DOI: https://doi.org/10.1016/S2468-1253(22)00427-7
HAUSARZT PRAXIS 2023: 18(6): 6–11