O tema do Congresso ASCO deste ano foi “Sabedoria Colectiva: O Futuro dos Cuidados e Investigação Centrados no Paciente”. De acordo com a ASCO, a fim de fazer mais progressos nos cuidados e tratamento dos doentes oncológicos, é necessário que as várias disciplinas médicas e a investigação do cancro trabalhem ainda mais em conjunto e troquem informações e dados. Relatamos importantes resultados de estudos sobre glioma, cancro pancreático, cancro do cólon metastásico e cancro do pulmão.
Pode a administração adjuvante de temozolomida (TMZ) à radioterapia melhorar a sobrevivência dos doentes com gliomas? Esta questão está a ser investigada no estudo CATNON. Martin van den Bent, Erasmus MC Cancer Center em Roterdão, apresentou resultados provisórios surpreendentes no congresso ASCO [1].
Gliomas: a terapia adjuvante com temozolomida melhora o prognóstico
O ensaio tratou 745 pacientes com glioma anaplásico sem eliminação de 1p19q, o que está associado a um melhor prognóstico e quimiossensibilidade. Todos os pacientes receberam radioterapia (RT) com 59,4 Gy em 33 fracções. A aleatorização teve lugar em quatro grupos:
- RT só,
- RT e administração concomitante de 75 mg/m2/d TMZ,
- RT seguido de 12 ciclos de 150-200 mg/m2 TMZ (nos dias 1-5 por 4 semanas),
- RT com administração simultânea de TMZ seguida de 12 ciclos de TMZ.
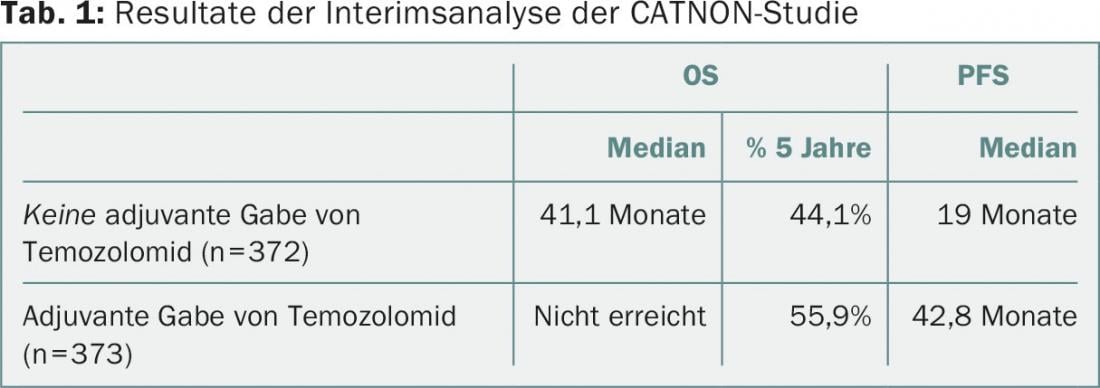
Os pacientes foram recrutados entre Dezembro de 2007 e Agosto de 2015. Em Outubro de 2015, após um acompanhamento mediano de 27 meses, realizou-se a análise intercalar. Os grupos 3 e 4 mostraram uma redução na taxa de perigo (HR) em termos de sobrevivência global (OS) de 0,645, e a sobrevivência sem progressão (PFS) também foi significativamente prolongada (Tab. 1). “A terapia adjuvante com temozolomida melhora claramente a sobrevivência”, foi a conclusão do Dr. van den Bent. Estudos anteriores não tinham mostrado qualquer vantagem para a TMZ em OS após cinco anos.
Cancro do pâncreas: progresso através da quimioterapia combinada
Que quimioterapia após a ressecção oferece aos doentes com cancro do pâncreas as melhores hipóteses de sobrevivência? Os resultados do ensaio ESPAC-4 (European Study Group for Pancreatic Cancer) fase III são claros e espera-se que conduzam a uma mudança nas directrizes de tratamento para este cancro geralmente fatal. No ESPAC-4, os pacientes foram primeiro operados e depois aleatorizados em dois grupos de quimioterapia: Grupo 1 (n=366) recebeu terapia padrão apenas com gemcitabina (seis ciclos de 4 semanas de gemcitabina i.v., GEM), Grupo 2 (n=364) recebeu terapia de combinação com gemcitabina mais capecitabina oral (GEM/CAP). Os pacientes foram recrutados entre Novembro de 2008 e Setembro de 2014. A sobrevida média dos pacientes com GEM/CAP foi de 28 meses (95% CI, 23,5-31,5), e a dos pacientes com GEM foi de 25,5 meses (22,7-27,9). A sobrevivência de 5 anos no grupo 2 foi de 28,8%, no grupo 1 apenas 16,3%.
Estes resultados representam um pequeno passo em frente para o tratamento de um grupo de pacientes que necessitam urgentemente de melhores opções de tratamento. “A quimioterapia combinada deve agora ser o novo tratamento padrão”, disse o primeiro autor do estudo, John P. Neoptolemos, da Universidade de Liverpool, Reino Unido.
Carcinoma do cólon: a localização do tumor primário influencia a taxa de sobrevivência
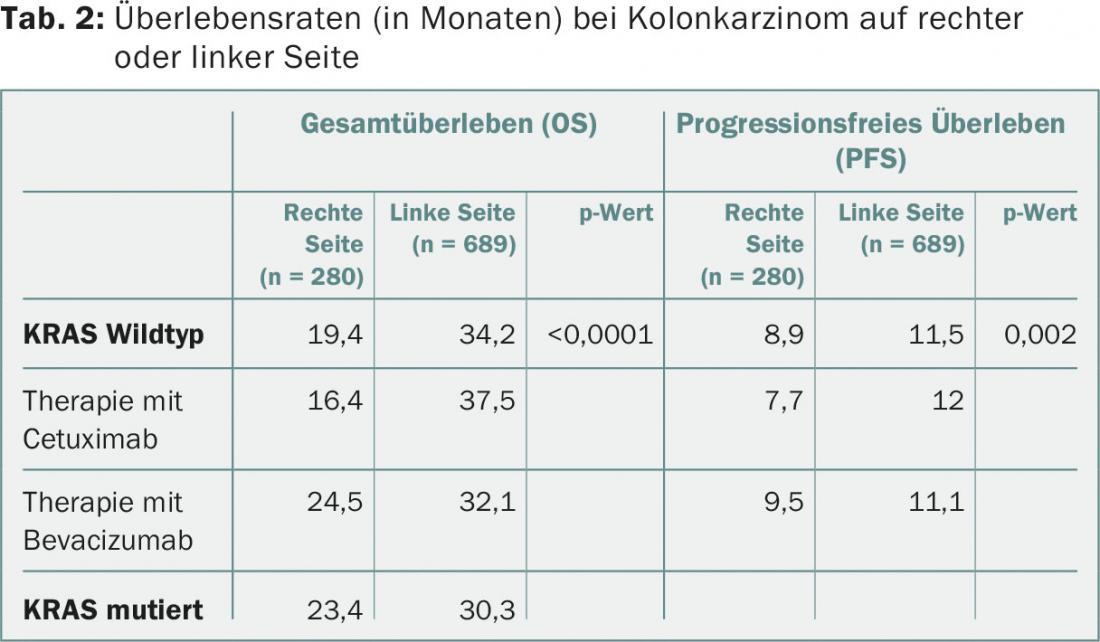
Se um carcinoma do cólon afecta o lado direito ou esquerdo do cólon tem uma grande influência no prognóstico do paciente – isto é demonstrado pela análise de um grupo de estudo dos EUA [3]. Os dados dos 1137 doentes do ensaio CALGB/SWOG 80405 (FOLFIRI ou mFOLFOX6 com bevacizumab ou cetuximab em doentes com cancro colorrectal metastático [mCRC] e KRAS tipo selvagem) foram examinados [4]. Em 25% dos doentes, o tumor primário localizava-se no lado direito do intestino (ceco, cólon ascendente), em 5% no cólon transversal e em 61% no lado esquerdo (cólon descendente, sigmóide, recto); em 9% dos doentes, a localização do tumor primário não era clara.
Se o tumor primário estava no lado esquerdo do intestino, o SO mediano era de 34,2 meses, para tumores primários no lado direito apenas 19,4 meses – estes resultados eram independentes da idade ou sexo dos pacientes ou do tratamento anterior (Tab.2). OS e PFS foram significativamente melhores em tumores do lado esquerdo tratados com cetuximab e em tumores do lado direito tratados com bevacizumab (não significativos).
“A diferença é muito maior do que esperávamos”, disse o autor principal Alan Venook, MD, Universidade da Califórnia, São Francisco, EUA. “Os resultados sugerem uma diferença na biologia do tumor”. Estas diferenças estão agora a ser investigadas. Os autores do estudo recomendam que os futuros estudos sobre o tratamento do mCRC tenham em conta as diferentes localizações do tumor primário. No entanto, os resultados até ao momento não conduzem a quaisquer consequências que possam mudar a prática. É de notar que hoje em dia as avaliações de estudo devem ter em conta todo o estado de mutação RAS, o que não era o caso neste estudo.
Cancro do pulmão: o acompanhamento com o apoio de uma aplicação pode prolongar a vida
Uma aplicação baseada na web pode ajudar os pacientes com cancro do pulmão a detectar sintomas de recorrência de tumores ou complicações o mais cedo possível, tendo assim um efeito significativo de prolongamento da vida. Este é o resultado espantoso de um estudo de fase III de França. Foram incluídos 121 doentes com cancro do pulmão em alto risco de progressão (90% com doença de fase III/IV) e com um estado de desempenho de 0-2. Os pacientes do grupo experimental (n=60) preencheram um questionário de sintomas uma vez por semana utilizando a aplicação no seu smartphone, tablet ou computador. Os resultados foram enviados semanalmente – entre as marcações de controlo programadas – ao oncologista de tratamento. Assim que os critérios clínicos definidos foram cumpridos, o oncologista recebeu uma mensagem por correio electrónico para que pudesse organizar imagens ou outra medida. No grupo de controlo sem aplicação, os pacientes (n=61) eram acompanhados com um TAC a cada 3-6 meses, de acordo com a norma. O tempo médio de seguimento foi de nove meses.
O SO mediano foi de 19 meses no grupo experimental e 11,8 meses no grupo de controlo. Na altura da primeira recaída, 81,5% dos pacientes no braço do estudo experimental tinham um estado de desempenho de 0-1, em comparação com apenas 35,3% no braço padrão. Os autores do estudo sublinham as vantagens do seguimento baseado na web: melhor taxa de sobrevivência, melhor estado de desempenho no momento da recorrência, início mais cedo dos cuidados de apoio e redução das imagens de rotina.
Fonte: Reunião Anual da Sociedade Americana de Oncologia Clínica (ASCO), 3-7 de Junho de 2016, Chicago, EUA
Literatura:
- Van den Bent M, et al: Resultados da análise interina do ensaio CATNON fase III randomizado EORTC em temozolomida simultânea e adjuvante em glioma anaplásico sem co-deleção 1p/19q: Um ensaio intergrupo. J Clin Oncol 2016; 34(suppl): Abs LBA2000.
- Neoptolemos JP, et al: ESPAC-4: Um ensaio multicêntrico, internacional, de fase III aleatorizado e controlado de fase aberta de quimioterapia adjuvante combinada de gemcitabina (GEM) e capecitabina (CAP) versus gemcitabina monoterapia em doentes com adenocarcinoma ductal pancreático ressecado. J Clin Oncol 2016; 34(suppl): Abs LBA4006.
- Venook A, et al: Impacto da localização do tumor primário (1º) na sobrevivência global (OS) e na sobrevivência sem progressão (PFS) em doentes (pts) com cancro colorrectal metastático (mCRC): Análise de CALGB/SWOG 80405 (Aliança). J Clin Oncol 2016; 34(suppl): Abs 3504.
- Venook A, et al: CALGB/SWOG 80405: ensaio Fase III de irinotecan/5-FU/leucovorin (FOLFIRI) ou oxaliplatina/5-FU/leucovorin (mFOLFOX6) com bevacizumab (BV) ou cetuximab (CET) para doentes (pts) com adenocarcinoma metastático do cólon ou recto não tratado (MCRC) do tipo KRAS (wt). J Clin Oncol 2014; 32(suppl): Abs LBA3.
- Denis F, et al: Sobrevivência global em pacientes com cancro do pulmão utilizando um seguimento guiado pela web em comparação com as modalidades padrão: Resultados da fase III de ensaio aleatório. J Clin Oncol 2016; 34(suppl): Abs LBA9006.
InFo ONCOLOGy & HEMATOLOGy 2016; 4(5): 31-32