A polineuropatia diabética (dPNP) é a neuropatia mais comum nos países ocidentais. Mas quem os recebe e como é que os reconhece? Esta questão é particularmente importante porque ainda 40% dos pacientes cujo dPNP é doloroso permanecem sem tratamento. Possibilidades de diagnóstico e terapia foram o tema do Congresso Alemão da Dor.
O Somatosensory dPNP desenvolve-se quase sempre em paralelo com a retinopatia ou nefropatia. Por conseguinte, deve-se estar sempre de olho nos olhos e nos rins durante o diagnóstico, explicou o Prof. Dr. Frank Birklein da Clínica e Policlínica de Neurologia do Hospital Universitário de Mainz (D) em jeito de introdução. A única excepção é a neuropatia das pequenas fibras (SFN), que pode preceder a diabetes. 50% dos diabéticos desenvolvem o PNP electrofisiologicamente, e em 16% destes pacientes o PNP é doloroso. Um quarto de todos os diabéticos tem PNP clinicamente. 40% dos dPNP dolorosos não são tratados.
Patofisiologicamente, há alterações no metabolismo do dPNP, especialmente no metabolismo da diabetes. Importante aqui é a via do poliol e os produtos finais avançados de glicação (AGE), que se acumulam e danificam os neurónios e especialmente os axónios. Além disso, há alterações nos canais iónicos, especialmente nos canais de potássio e sódio, e aparecem defeitos mitocondriais, que acabam por levar a que os neurónios recebam muito pouca energia. Não se deve esquecer que também ocorrem mudanças estruturais, especialmente nos navios. Vascularmente, isto caracteriza-se pelo facto de as veias e artérias serem morfologicamente inconspícuas nas neuropatias de controlo, enquanto que nos diabéticos a artéria é reduzida em tamanho e “enrolada”, ou seja, existe uma arteriolopatia, as veias estão parcialmente congestionadas. Um nervo diabético acaba por ter muito pouco oxigénio e é hipóxico.
Diagnósticos
O primeiro passo no diagnóstico deve ser a medição das velocidades de condução nervosa (NLG) – quer realizada por si próprio, quer por um colega neurológico de confiança, como disse o Prof. Birklein: “Acredito sempre que os valores normais de uma prática, os patológicos, por outro lado, nem sempre são correctos, porque o doente não foi devidamente aquecido, por exemplo. As extremidades frias levam a uma desaceleração da velocidade de condução nervosa”. O programa de medição do NLG inclui dois nervos, motor e sensível, na extremidade superior. A Prof. Birklein recomenda pelo menos a ulnar, uma vez que a mediana tem frequentemente síndrome do túnel do carpo (CTS) e podem ocorrer diagnósticos errados se não se tiver conhecimento da mesma. “E os doentes diabéticos têm muito frequentemente CTS”. Nas extremidades inferiores, dois nervos motores (tibialis, peroneus) e o suralis devem ser abordados de forma sensível. O perito lembrou à audiência que a velocidade de condução nervosa de um paciente diabético dificilmente muda durante um período de até cinco anos e normalmente permanece a um nível reduzido constante. A situação é diferente para as amplitudes do potencial de acção da soma motora, que pode ser estimulada, por exemplo, ao medir o peroneu. aqui, torna-se cada vez menos ao longo de 2 anos. Isto significa que os axônios se avariam durante o dPNP. “Isto não é uma neuronopatia, é uma axonopatia moribunda de costas”, explicou o neurologista. As fibras nervosas mais longas são afectadas primeiro e os axónios morrem de volta. Como resultado, a amplitude torna-se cada vez menor.
Se o NLG for normal, o paciente não tem PNP. Como regra, os resultados neurológicos são então também normais, mas a pessoa afectada ainda tem dores ardentes (sfPNP na fase inicial). Neste caso, é bastante suficiente determinar os limiares de frio e calor de acordo com o protocolo QST* para diagnosticar sfPNP. O médico irá explorar a perda da sensação de frio e calor. O frio corresponde a uma função delta, pelo que os nociceptores de condução rápida são da mesma classe de fibra, e o calor é da classe C, pelo que os nociceptores de condução lenta são da classe C. O limiar frio das pessoas saudáveis no pé começa a 32°C – uma redução de 4°C é sentida por um sujeito saudável, nos pacientes este é apenas o caso a partir dos 12°C. No limiar quente, ou seja, medido a partir de 32°C após temperaturas mais quentes, as pessoas saudáveis precisam de cerca de 6°C de diferença no pé para sentir qualquer coisa, os pacientes com PNP ou diabetes em conformidade mais. Isto também se mantém constante durante dois anos, com um ligeiro aumento.
(* Teste Sensorial Quantitativo)
Se a medição de limiares quentes e frios não ajudar, o padrão no diagnóstico da sfPNP é uma biópsia da pele, que é oferecida por muitos laboratórios de neuropatologia.
Prevenção
Como se pode evitar a ocorrência ou progressão do dPNP? Em primeiro lugar, claro, o controlo da glucose no sangue (BG) é óbvio para isto. O Prof. Birklein referiu-se a um papel em que as velocidades de condução nervosa foram medidas durante mais de 20 anos (Fig. 1). Pode-se ver que o NLG de controlos saudáveis diminui ligeiramente durante um período de duas décadas, mas isto é bastante normal. Os pacientes com um HbA1c ≥7, ou seja, um cenário de BG convencional, foram comparados com pacientes com um cenário de BG intensificado. O que se vê é que os pacientes com um controlo intensificado do BG na diabetes tipo 1 têm um curso que também é esperado em pessoas saudáveis. “Se a diabetes for bem controlada, então não terá PNP durante muitos anos” foi a conclusão do perito. Por outro lado, se for pior ajustado, o PNP desenvolve-se. Conclusão: O controlo BG é essencial, especialmente para os jovens que desenvolvem diabetes. Recomenda-se também um recrutamento mais intenso, sobretudo por este motivo.
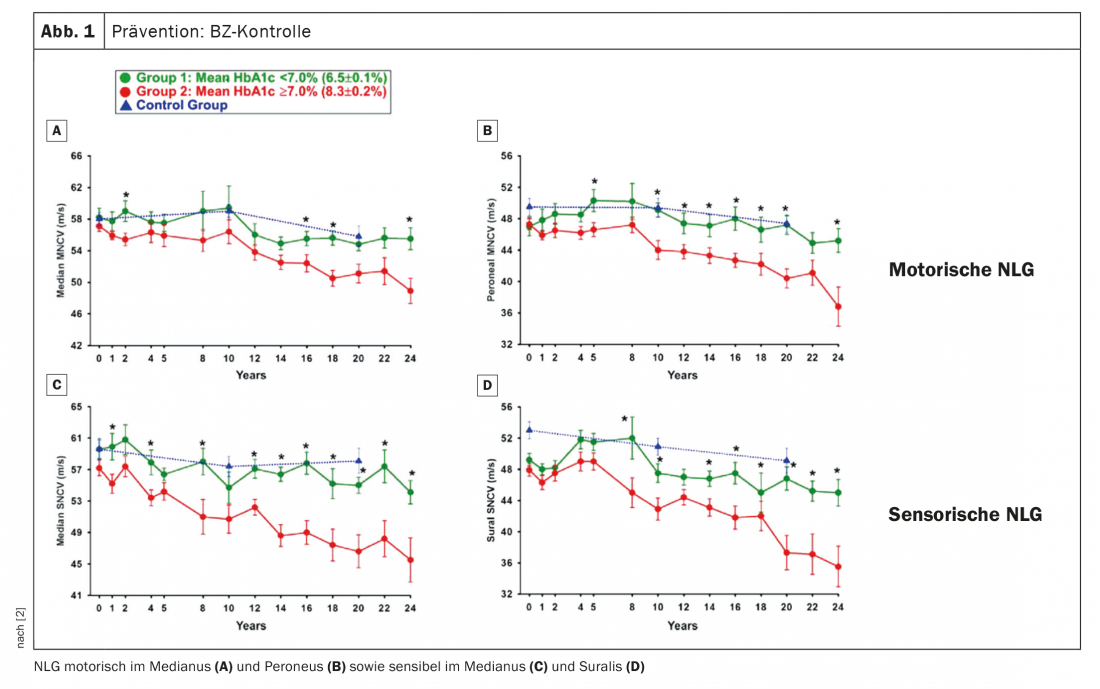
Com a diabetes tipo 2, a situação é um pouco diferente. Aqui, são principalmente os factores de risco cardiovascular que precisam de ser tidos em conta: Hipertensão, tabagismo, IMC, triglicéridos, e, claro, HbA1c. “As pessoas não pensam nos factores cardiovasculares no PNP, mas pensam nas alterações vasculares no nervo periférico”, advertiu o Prof. Birklein.
15% dos doentes com dPNP têm dores
Mas porque é que 15% dos doentes com dPNP têm dores? Antes de mais, não se deve esquecer uma coisa, diz o perito: Nem todos os pacientes que têm diabetes e um dPNP devem também ter dores neuropáticas. Os pacientes com diabetes e neuropatia avançada também podem desenvolver gonartrose ou sinovite, por exemplo, que são responsáveis pela dor. Estas possibilidades devem ser sempre tidas em conta.
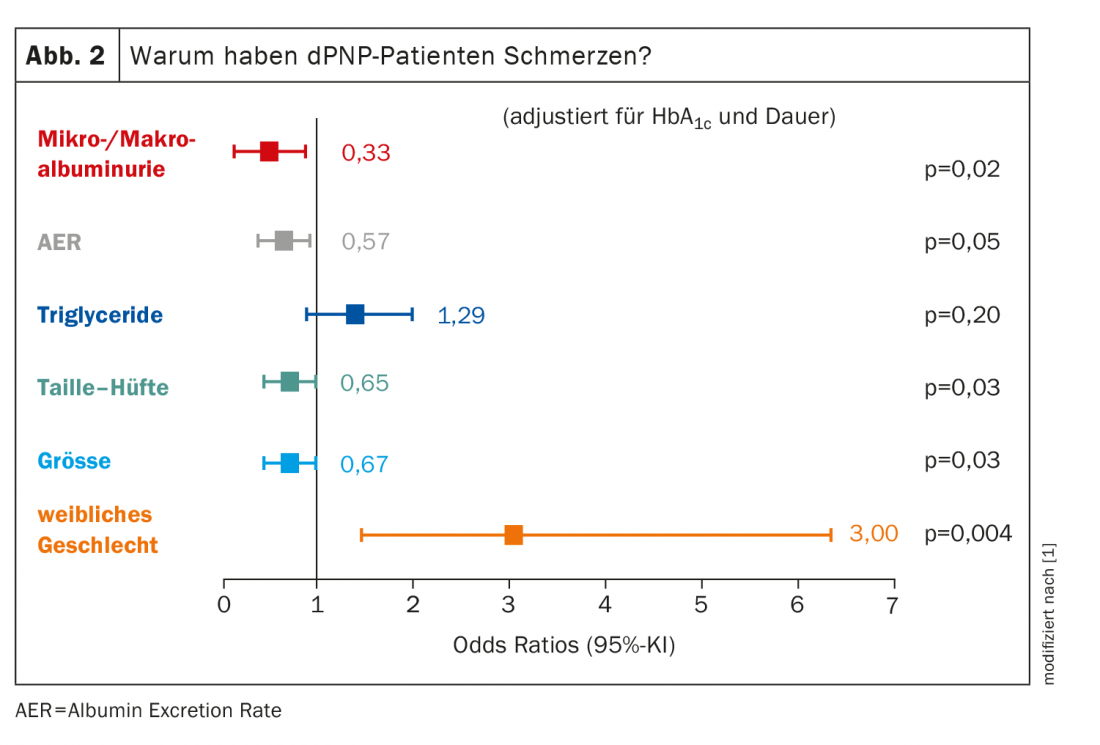
No que diz respeito ao grupo de pacientes dolorosos do dPNP cuja causa é realmente a polineuropatia, são sobretudo as mulheres que são afectadas: O sexo feminino tem uma odds ratio de 3,00 para um PNP doloroso. Todos os outros factores representam significativamente menos (Fig. 2) . O tamanho do corpo desempenha um papel, o que pode parecer surpreendente no início. Mas: Quanto mais longos forem os axônios, maior será a probabilidade de ocorrência de danos. “Temos sempre de nos lembrar: o metabolismo de todo o axónio é realizado no neurónio – mais especificamente no gânglio raiz posterior, no que diz respeito às fibras da dor – e tem de ser transportado até às extremidades nervosas. E quanto maiores forem, maior é a probabilidade de algo correr mal pelo caminho”. Quanto mais axônios forem danificados, mais doloroso será o dPNP.
Então de onde vem a dor neuropática? Quando ocorrem danos axonais, o neurónio torna-se electricamente instável e espontaneamente activo, explicou o médico da dor. Isto acontece através dos canais de sódio (Na+). Se os canais de sódio estiverem bloqueados, um neurónio danificado que tenha sido axotomizado é também novamente completamente silencioso. A activação dos canais de sódio funciona provavelmente via metilglioxal. A glicose é convertida em metilglioxal no plasma. A glioxalase – uma enzima que é o passo limitador da taxa aqui – então faz com que o metilglioxal seja convertido em lactato. Se a glioxalase não estiver a funcionar bem, a metilglioxal acaba por se acumular. As medições de metilglioxal no plasma mostraram que os pacientes com diabetes sem dor têm uma quantidade aumentada de metilglioxal – porque naturalmente também têm mais glicose do que pessoas saudáveis. Contudo, os pacientes com dor têm uma quantidade significativamente maior de metilglioxal no seu sangue em comparação com os pacientes não dolorosos.
Terapia de dPNP
Em relação ao tratamento de pacientes com polineuropatia diabética, o Prof. Birklein listou uma série de opções farmacológicas que são consideradas agentes de primeira escolha:
- Anticonvulsivantes (bloqueadores de canal – gabapentina, pré-gabalina)
- Antidepressivos tricíclicos
- Serotonina-norepinefrina inibidores da recaptação (SSNRI) (duloxetina)
- adesivo de capsaicina
- Adesivo de lidocaína
De acordo com a actual directriz S2, carbamazepina, oxcarbazepina, lamotrigina, venlafaxina e canabinóides também podem ser considerados em casos individuais. A Prof. Birklein não está muito convencida das opções de gesso, “teria de gessar mais de metade da perna de alguns pacientes, e isso não é muito agradável”. Como alternativa, lembrou as pessoas das opções sem drogas – sabendo muito bem que muitos que sofrem acabam por preferir tomar comprimidos em vez de fazer exercício. Se nem a medicação nem o exercício trazem o sucesso desejado, há também a electroestimulação da medula espinal (SCS), que tem funcionado bem em estudos com doentes com PNP doloroso.
– Congresso Alemão da Dor 2020, Mannheim (D) e online
Fontes:
- Polineuropatia Diabética: Da Bancada à Cabeceira. Novos dados sobre fisiopatologia, diagnóstico e terapia. Congresso Alemão da Dor Mannheim, 22.10.2020
- Ziegler D, et al: BMJ Open 2015; 5: e006559; doi: 10.1136/bmjopen-2014-006559
InFo PAIN & GERIATURA 2020; 2(2): 24-25 (publicado 9.12.20, antes da impressão).