A utilização de oncologistas e imunoterapêuticos específicos tem revolucionado o tratamento do cancro da pele negra nos últimos anos. No entanto, a sequência terapêutica óptima permanece ainda hoje pouco clara. Uma análise de estudo investigou agora a questão de saber se o estatuto de mutação BRAF V600E/K tem um impacto no sucesso da imunoterapia no melanoma maligno avançado.
Cerca de 40% de todos os melanomas metastáticos têm uma mutação BRAF, sendo a mutação BRAF V600E/K activada de longe a mais comum [1]. Esta alteração genética pode ser de benefício terapêutico e serve como alvo de vários tratamentos direccionados. Por exemplo, vemurafenibe e encorafenibe são inibidores de BRAF específicos de mutação que são altamente valorizados na terapia do melanoma. A combinação com inibidores MEK como o trametinibe pode aumentar ainda mais a eficácia destas substâncias e levar a uma menor resistência secundária. Tal como BRAF, MEK é um componente da via de sinalização MAPK, que é importante na patogénese e cuja activação descontrolada leva a um crescimento excessivo de células no melanoma mutado por BRAF [2]. Para além de agentes específicos para a inibição de BRAF e MEK, são também utilizados imunoterapêuticos no tratamento do cancro de pele negra metastásico [3]. Com a multiplicidade de opções, levanta-se também a questão da sequência terapêutica óptima para maximizar a eficácia e a tolerabilidade. Os dados até à data sugerem que a resposta à terapia de primeira linha é melhor do que a todos os tratamentos subsequentes, independentemente de serem utilizados principalmente inibidores de BRAF/MEK [4].
Avaliação da imunoterapia após terapia orientada
Outras provas sobre a potencial interacção de terapias específicas e inibidores de pontos de controlo no tratamento do melanoma maligno são agora fornecidas por um estudo recentemente publicado na JAMA Oncology. Os autores investigaram a influência do estado de mutação do BRAF e do tratamento prévio de inibição do BRAF/MEK em imunoterapia com o inibidor PD-1 pembrolizumab. Para o efeito, analisaram dados dos três ensaios clínicos aleatórios KEYNOTE-001, KEYNOTE-002 e KEYNOTE-006. A análise incluiu 1558 pacientes adultos com melanoma avançado cujo estado de mutação BRAFV600E/K era conhecido e que receberam pembrolizumab. 1124 pacientes tinham um tipo selvagem BRAF (WT) e 434 pacientes tinham uma mutação BRAF, que tinha sido visada em 271 casos. Os principais pontos finais da análise retrospectiva foram a taxa de resposta objectiva (ORR) ao pembrolizumabe, bem como as taxas PFS e OS após quatro anos de imunoterapia. (Tab.1). Por um lado, foram comparados os resultados em pacientes com BRAF WT e estado BRAF mutado, e por outro lado, os autores também avaliaram os efeitos da terapia com inibidor de BRAF com ou sem inibição adicional de MEK dentro do subgrupo de pacientes cujo tumor teve uma mutação de BRAF.
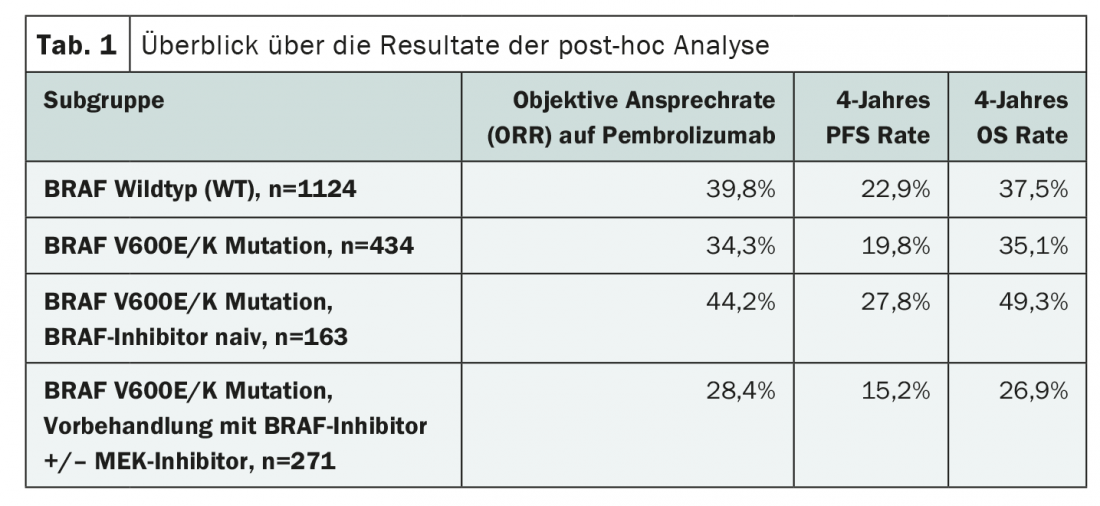
Ao comparar os tumores BRAF WT e BRAF-mutados, foram vistos resultados ligeiramente melhores naqueles sem a mutação (Tab. 1). No entanto, a maioria dos pacientes com mutação de BRAF tinham recebido terapia prévia com inibidores de BRAF/MEK. Além disso, eram em média mais velhos e já tinham sido submetidos com mais frequência ao tratamento com ipilimumab.
A comparação dos subgrupos com e sem tratamento inibidor de BRAF sugeriu que um pré-tratamento correspondente era um mau pré-requisito para a imunoterapia (Tab. 1). Contudo, na investigação mais detalhada, verificou-se que os pacientes que tinham sido pré-tratados com uma terapia específica tinham geralmente piores condições. Por exemplo, havia um número mais elevado de tumores PD-L1 negativos e metástases cerebrais entre eles. No entanto, um certo efeito permaneceu em várias análises de subgrupos, o que, segundo os autores, poderia dever-se a fraquezas na selecção dos pacientes do estudo.
No que diz respeito à segurança, nem o estado de mutação nem o pré-tratamento com inibidores de BRAF pareciam desempenhar um papel. As reacções adversas aos medicamentos foram distribuídas uniformemente por todos os pacientes. Os autores concluem que a utilização de pembrolizumab pode proporcionar benefícios clínicos em todos os subgrupos estudados e que a segurança é garantida mesmo com pré-tratamento. A fim de confirmar estas afirmações, para possivelmente provar um efeito significativo da terapia inibidora do BRAF nas linhas de tratamento subsequentes, ou mesmo para poder recomendar uma sequência terapêutica, é provavelmente ainda necessária muita investigação, também no âmbito de estudos prospectivos. Embora muito já tenha sido feito com o desenvolvimento de várias substâncias novas que já melhoraram de forma sustentável o prognóstico do melanoma maligno, outros marcos na gestão do cancro da pele negra poderiam ser alcançados com a sua utilização óptima e tratamento específico para subgrupos.
Fonte: Puzanov, et al: Association of BRAF V600E/K Mutation Status and Prior BRAF/MEK Inhibition With Pembrolizumab Outcomes in Advanced Melanoma: Pooled Analysis of 3 Clinical Trials. JAMA Oncol 2020; 6(8): 1256-1264.
Literatura:
- Long GV, et al: Associações prognósticas e clinicopatológicas de BRAF oncogénico em melanoma metastático. J Clin Oncol 2011; 29(10): 1239-1246.
- Knispel S, et al: Melanoma maligno: opções para pacientes em estado avançado. Dtsch Arztebl International 2018; 115(20-21): 4-9.
- Rede Nacional Abrangente contra o Cancro: NCCN clinical practice guidelines: cutaneous melanoma (versão 4.2020). www.nccn.org/professionals/physician_gls/pdf/cutaneous_melanoma.pdf.
- Johnson DB, et al: Sequencing Treatment in BRAFV600 Mutant Melanoma: Anti-PD-1 Antes e Depois da Inibição do BRAF. J Immunother 2017; 40(1): 31-35.
InFo ONCOLOGY & HEMATOLOGY 2020; 8(6): 30