As doenças cardiovasculares, em particular a doença arterial coronária (DAC) e a insuficiência cardíaca (IC), estão generalizadas na população idosa e contam-se entre as principais causas de morte a nível mundial. Com a idade, a capacidade do coração para recuperar do stress do enfarte do miocárdio (MI) diminui, levando a alterações significativas no metabolismo energético e, em última análise, contribuindo para a insuficiência cardíaca. A compreensão dos mecanismos subjacentes a estes processos é crucial para o desenvolvimento de novas terapias direcionadas.
Alterações metabólicas após um enfarte do miocárdio
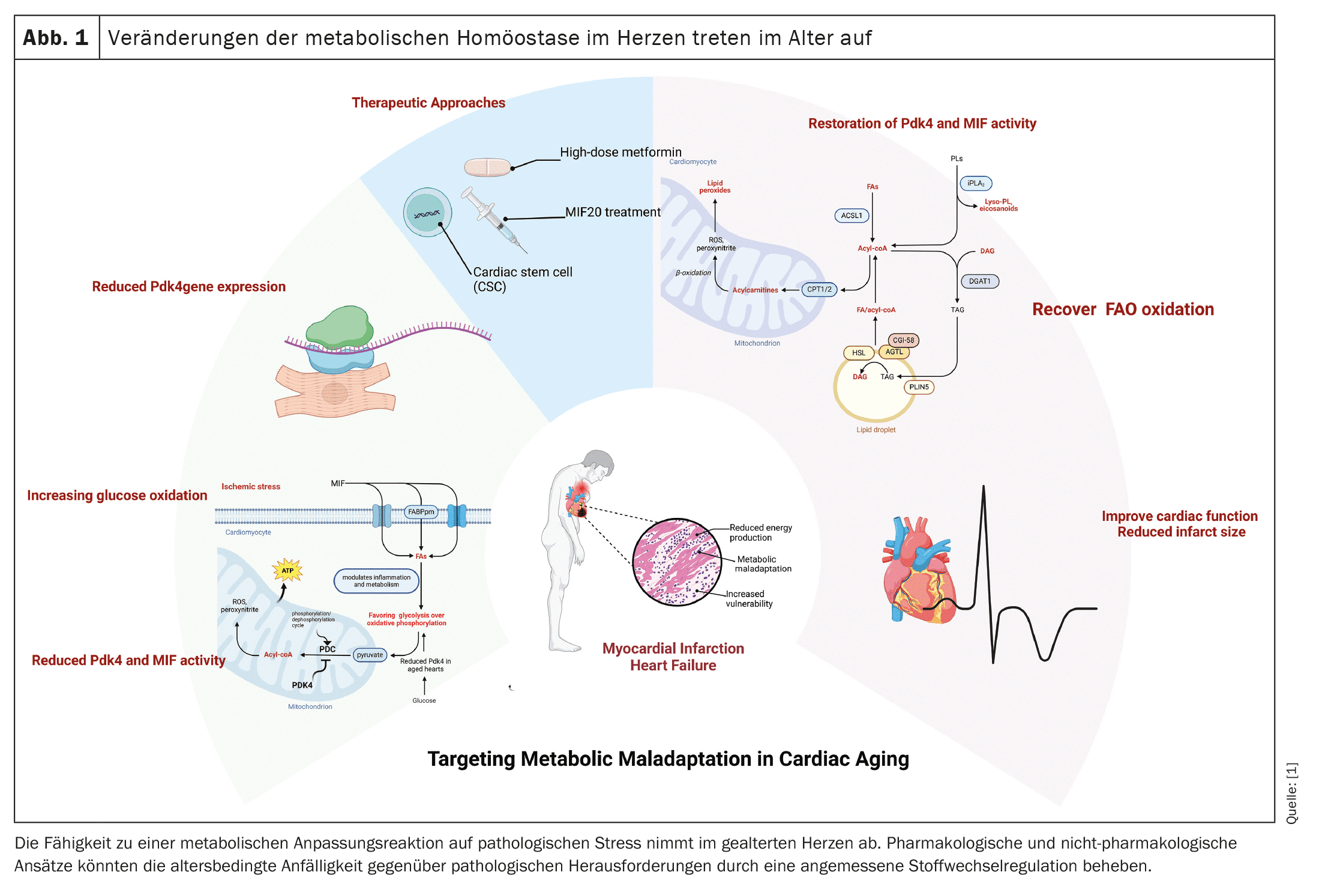
(vermelho) Após o enfarte do miocárdio, o coração envelhecido sofre alterações metabólicas significativas que prejudicam a sua capacidade de contrair e fornecer um débito cardíaco adequado. Durante as condições anaeróbicas do enfarte do miocárdio, o coração passa da oxidação de ácidos gordos (FAO) para uma oxidação menos eficiente da glicose. Os nossos estudos em modelos de ratinhos mostraram que o tecido ventricular esquerdo de animais mais velhos continua a depender da oxidação da glicose após o enfarte do miocárdio, que é regulada pela piruvato desidrogenase quinase 4 (Pdk4). Este desajuste nos cardiomiócitos do ventrículo esquerdo após o enfarte do miocárdio assinala uma capacidade reduzida do coração envelhecido para restaurar o débito cardíaco, conduzindo, em última análise, à insuficiência cardíaca.
A Pdk4 desempenha um papel fundamental no metabolismo energético celular, regulando o complexo piruvato desidrogenase (PDC), que converte o piruvato em acetil-CoA, ligando a glicólise ao ciclo do ácido tricarboxílico (TCA) e à fosforilação oxidativa. Num coração envelhecido, a diminuição da expressão de Pdk4 leva a uma mudança da oxidação dos ácidos gordos para a oxidação crónica da glicose, que é menos eficiente na produção de ATP. Esta mudança metabólica é particularmente prejudicial após um enfarte do miocárdio, uma vez que as necessidades energéticas do coração não são satisfeitas, prejudicando ainda mais a função cardíaca e contribuindo para a insuficiência cardíaca.
O papel do fator inibitório da migração de macrófagos (MIF)
Para além da Pdk4, o fator inibitório da migração de macrófagos (MIF), que modula a inflamação e o metabolismo, também está diminuído no coração envelhecido e atenua a resposta adaptativa ao stress isquémico. Estudos demonstraram que a regulação positiva da Pdk4 aumenta a oxidação dos ácidos gordos e melhora o desempenho cardíaco no miocárdio envelhecido, o que faz da Pdk4 um potencial alvo terapêutico na disfunção cardíaca pós-IAM. Uma terapia promissora é a utilização de agonistas do MIF, como o MIF20, que restauram a sinalização do MIF após isquémia, minimizam o enfarte e revitalizam o metabolismo dos cardiomiócitos através da modulação da Pdk4. O MIF20 pode ajudar a corrigir a resposta desadaptativa da Pdk4, permitindo que os cardiomiócitos envelhecidos regressem à oxidação dos ácidos gordos e melhorem o desempenho cardíaco.
O tamanho do enfarte e o seu significado para o estado cardiometabólico
Para além da reorganização metabólica após um enfarte do miocárdio, o tamanho do enfarte é um fator importante na recuperação da função cardíaca. Estudos demonstraram que existe uma forte correlação entre a função deficiente dos cardiomiócitos e o tamanho do enfarte. A administração de uma dose elevada de metformina durante a fase de reperfusão demonstrou reduzir o tamanho do enfarte, melhorar a contratilidade e influenciar positivamente o metabolismo dos cardiomiócitos, tanto em ratos como em seres humanos. As abordagens de tratamento não invasivas, como a terapia com células estaminais cardíacas (CSC), também demonstraram resultados promissores na redução do tamanho do enfarte e na melhoria do desempenho cardíaco.
Avanços na reparação cardíaca: das terapias proteicas ao CRISPR e aos exossomas
O desenvolvimento de abordagens terapêuticas inovadoras para o tratamento da insuficiência cardíaca pós-IAM está a progredir de forma constante. Para além das terapias com proteínas como o MIF20, estão também a ser ativamente investigadas novas abordagens como a edição genética CRISPR para corrigir os genes causadores de insuficiência cardíaca e as terapias com exossomas para promover a reparação dos tecidos. Além disso, estão atualmente a ser realizados ensaios clínicos sobre a terapia com células estaminais com o objetivo de regenerar o tecido cardíaco danificado.
Limitar as consequências do enfarte do miocárdio é fundamental para melhorar os resultados de saúde em doentes com doença coronária. A disfunção sistólica do ventrículo esquerdo (DSVE) e a insuficiência cardíaca são consequências comuns do enfarte do miocárdio. Embora os tratamentos invasivos, como a cirurgia de bypass coronário, possam melhorar a disfunção do ventrículo esquerdo, a função do ventrículo direito deteriora-se ainda mais, contribuindo para o agravamento da insuficiência cardíaca. Por conseguinte, as abordagens não invasivas que reduzem o tamanho do enfarte e melhoram o metabolismo cardíaco são de particular importância.
Perspectivas futuras e relevância clínica
Dado o aumento da incidência da doença coronária em todo o mundo, a prevenção da progressão para insuficiência cardíaca continua a ser fundamental. A compreensão das desadaptações metabólicas que se seguem ao enfarte do miocárdio e o desenvolvimento de novas terapias para restaurar a regulação da energia cardíaca poderiam melhorar significativamente a qualidade de vida dos doentes. Neste contexto, as terapias proteicas e as intervenções farmacológicas que optimizam o metabolismo energético do coração são abordagens promissoras.
Globalmente, os conhecimentos mecanicistas detalhados sobre o papel da Pdk4 e do MIF no metabolismo cardíaco nos idosos oferecem abordagens terapêuticas promissoras para melhorar a função cardíaca em doentes idosos após enfarte do miocárdio. Estudos futuros devem centrar-se no aperfeiçoamento destas terapias e na avaliação da sua eficácia em aplicações clínicas.
Fonte:
- Fatmi MK, Rouhi N, Lozonschi L, Li J: Cardiac metabolism in the elderly: effects and consequences. Aging (Albany NY). 2024 Ago 19; 16(16): 11773-11775. doi: 10.18632/aging.206071. Epub 2024 Aug 19. PMID: 39167437; PMCID: PMC11386932.
CARDIOVASC 2024; 23(3): 38-39