O tratamento da artrite reumatoide (AR) registou progressos significativos nos últimos anos, mas a terapia continua a ser um desafio para muitos doentes: até 60% das pessoas afectadas não respondem ao tratamento inicial ou perdem a resposta à terapia ao longo do tempo [2]. Os inibidores do TNF (TNFi) são ainda frequentemente utilizados por rotina como terapêutica de primeira linha após os DMARD sintéticos convencionais e, no caso de uma resposta insuficiente, os DMARD sintéticos podem ser utilizados como terapêutica de segunda linha. A maioria dos doentes passa para um segundo TNFi, o que é conhecido como ciclo de TNFi [3]. Os dados actuais sugerem agora que esta prática deve ser reconsiderada: em vez de outro ciclo de TNFi, a mudança para substâncias com um mecanismo de ação diferente, como os inibidores da Janus quinase (JAKi), poderia ser benéfica para os doentes [1].
Nas actuais recomendações de tratamento até ao alvo (T2T) para a AR, a remissão clínica é o principal objetivo do tratamento [4]. [5-7] A remissão é de importância central para os doentes, uma vez que não só retarda a progressão da lesão articular, como também melhora significativamente o bem-estar psicológico e o funcionamento físico das pessoas afectadas. [8-10] A remissão precoce, em particular, é crucial para os efeitos da doença a longo prazo. Os dados de estudos eos resultados comunicados pelos doentes (PRO) mostram que a remissão precoce está associada à remissão a longo prazo [8, 9]. No entanto, cerca de 30 a 40 % dos doentes com AR que iniciam a terapêutica de primeira linha com TNFi interrompem o tratamento devido a falha primária, falta de resposta secundária ou intolerância [1]. Nestes casos, é particularmente importante mudar rapidamente para uma terapêutica alternativa em conjunto, a fim de manter a possibilidade de uma remissão duradoura e não perder o controlo da doença.
Ciclismo vs. comutação
O Colégio Americano de Reumatologia (ACR) recomenda a mudança para um bDMARD ou tsDMARD de outra classe de fármacos na AR após a falha de um agente terapêutico biológico ou alvo-específico inicial (bDMARD ou tsDMARD), enquanto a Aliança Europeia de Associações de Reumatologia (EULAR) recomenda a mudança para outro mecanismo de ação e a alternância [4, 11]. [12] Tanto o ciclo de TNFi como a mudança para um mecanismo de ação alternativo são frequentemente utilizados quando a terapêutica com TNFi falha. [13] No entanto, os dados do estudo mostram que os doentes que são submetidos a vários ciclos de TNFi têm maior probabilidade de falhar a terapêutica e de mudar novamente. [14,15] No entanto, a mudança para um mecanismo de ação diferente estaria associada a uma maior probabilidade de melhoria clínica e a uma menor taxa de abandono do tratamento.
Upadacitinib favorável para a mudança
Um estudo multinacional que analisou dados de registo de 503 doentes com AR após falha da terapêutica de primeira linha com TNFi investigou o sucesso de diferentes terapêuticas de seguimento [1]. Os doentes foram comparados com uma mudança para o JAKi upadacitinib (RINVOQ®, UPA, n=261), um segundo TNFi (n=128) ou um DMARD com um mecanismo de ação diferente (n=114) [1, 16]. Os doentes que mudaram de um TNFi para UPA obtiveram resultados clínicos significativamente melhores do que aqueles que receberam um segundo TNFi. Por exemplo, 67,7% dos pacientes com UPA obtiveram remissão, em comparação com 40,3% dos que receberam um segundo TNFi (p=0,002). A ausência de dor foi maior com a UPA (55,7% vs. 25,4%, p=0,001) e a adesão foi de 60% em comparação com 34,2% entre os pacientes com TNFi (p=0,005) (Fig. 1) [1]. A UPA também foi superior a um DMARD com um mecanismo de ação diferente em todos os três aspectos. [17] Além disso, os dados de 5 anos recentemente publicados do estudo SELECT-COMPARE sublinham que uma mudança de mecanismo de ação parece ser benéfica para os doentes com AR que não atingiram o seu objetivo de tratamento e que esta vantagem pode ser mantida a longo prazo. [17] O estudo mostrou diferenças numéricas principalmente a favor dos doentes que mudaram de ADA para UPA. No entanto, não só na AR, mas também na artrite psoriática (APS) e na espondiloartrite axial (EAX), os dados dos estudos indicam que os doentes respondem menos bem a um segundo ou terceiro TNFi do que ao primeiro [12, 18, 19].
O upadacitinib também é benéfico como terapêutica de primeira linha após csDMARDs
A eficácia da UPA versus TNFi como terapêutica de primeira linha foi comparada nos estudos diretos do programa SELECT-COMPARE [20, 21]. A UPA + metotrexato (MTX) mostrou uma eficácia significativamente mais elevada do que o adalimumab (ADA) + MTX em vários parâmetros, como DAS28≤2,6, ACR50, alterações no HAQ-DI e alívio da dor logo a partir das 12 semanas [20, 21]. [21] Também foi possível demonstrar uma maior remissão sustentada com UPA + MTX em comparação com ADA + MTX ao longo de 5 anos. Vários estudos do mundo real demonstraram agora também a boa eficácia e a longa duração do tratamento com upadacitinib na prática quotidiana [22, 23]. [24] Além disso, os dados de até 7,5 anos publicados no EULAR 2024 confirmam o perfil de segurança conhecido do UPA em mais de 4.700 pacientes.
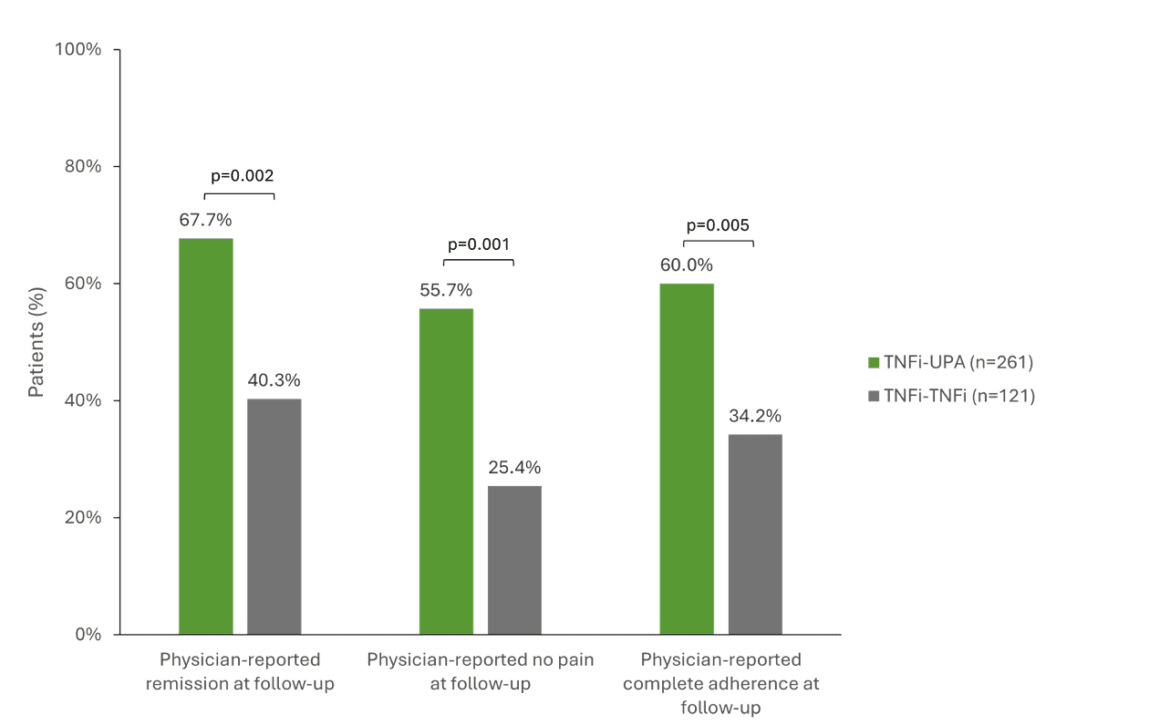
Fig. 1: Resultados clínicos significativamente melhores quando se muda para UPA (TNFi-UPA) em comparação com um segundo TNFi (TNFi-TNFi). TNFi = inibidor do TNF, UPA = upadacitinib. Adaptado de [1].
Conclusão
Os dados disponíveis sugerem que a mudança de TNFi para UPA pode ser uma opção de tratamento favorável para pacientes com AR que não responderam adequadamente ou são intolerantes à terapia inicial com TNFi [1]. Em comparação com o ciclo de TNFi, a mudança para UPA com um mecanismo de ação alternativo oferece melhores hipóteses de remissão, ausência de dor e adesão ao tratamento [1]. Estes resultados apoiam a recomendação de mudar para um mecanismo de ação alternativo numa fase inicial, a fim de melhorar os resultados do tratamento a longo prazo para os doentes com AR e aumentar a probabilidade de uma remissão duradoura.
Abreviaturas: ACR = Colégio Americano de Reumatologia; ACR50 = resposta ACR com ≥50% de melhoria; ADA = adalimumab; axSpA = espondiloartrite axial; csDMARD = DMARD sintético convencional; DAS28 = Disease Activity Score 28; DMARD = medicamentos anti-reumáticos modificadores da doença; EULAR = Aliança Europeia de Associações de Reumatologia; HAQ-DI = Health Assessment Questionnaire Disability Index; JAK = Janus kinase; JAKi = inibidor de JAK; MTX = metotrexato; PRO = patient-reported outcome; PsA = artrite psoriática; RA = artrite reumatoide; T2T = treat-to-target; TNF = fator de necrose tumoral; TNFi = inibidor de TNF; UPA = upadacitinib.
Breve informação técnica RINVOQ®.

Este artigo foi produzido com o apoio financeiro da AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Este artigo foi publicado em alemão. Texto: Dr. sc. nat.
Stefanie Jovanovic CH-RNQ-240019 11/2024
Literatura
1 Caporali, R., et al, A Real-World Comparison of Clinical Effectiveness in Patients with Rheumatoid Arthritis Treated with Upadacitinib, Tumour Necrosis Fator Inhibitors, and Other Advanced Therapies After Switching from an Initial Tumour Necrosis Fator Inhibitor. Adv Ther, 2024. 41(9): p. 3706-3721.
2 Vallejo-Yague, E., et al, Comparative effectiveness of biologics in patients with rheumatoid arthritis stratified by body mass index: a cohort study in a Swiss registry. BMJ Open, 2024. 14(2): p. e074864.
3 Edgerton, C., et al, Real-World Treatment and Care Patterns in Patients With Rheumatoid Arthritis Initiating First-Line Tumour Necrosis Fator Inhibitor Therapy in the United States. ACR Open Rheumatol, 2024. 6(4): p. 179-188.
4 Smolen, J.S., et al, Recomendações da EULAR para a gestão da artrite reumatoide com medicamentos anti-reumáticos modificadores da doença sintéticos e biológicos: atualização de 2022. Ann Rheum Dis, 2023. 82(1): p. 3-18.
5 Lillegraven, S., et al, Remissão e resultados radiográficos na artrite reumatoide: aplicação dos critérios de remissão ACR/EULAR 2011 numa coorte observacional. Ann Rheum Dis, 2012. 71(5): p. 681-6.
6 McInnes, I.B. e G. Schett, The pathogenesis of rheumatoid arthritis (A patogénese da artrite reumatoide ). N Engl J Med, 2011. 365(23): p. 2205-19.
7 Einarsson, J.T., et al, Sustained Remission Improves Physical Function in Patients with Established Rheumatoid Arthritis, and Should Be a Treatment Goal: A Prospective Observational Cohort Study from Southern Sweden. J Rheumatol, 2016. 43(6): p. 1017-23.
8 Ten Klooster, P.M., et al, Long-term clinical, functional, and cost outcomes for early rheumatoid arthritis patients who did or did not achieve early remission in a real-world treat-to-target strategy. Clin Rheumatol, 2019. 38(10): p. 2727-2736.
9 Xie, W., J. Li, e Z. Zhang, O impacto de diferentes conjuntos de critérios na remissão precoce e a identificação dos seus preditores na artrite reumatoide: resultados de uma coorte observacional (2009-2018). Clin Rheumatol, 2020. 39(2): p. 381-389.
10 Snoeck Henkemans, S.V.J., et al, Patient-reported outcomes and radiographic progression in patients with rheumatoid arthritis in sustained remission versus low disease activity. RMD Open, 2024. 10(1).
11 Fraenkel, L., et al, 2021 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken), 2021. 73(7): p. 924-939.
12 Bogas, P., et al, Comparação da eficácia a longo prazo entre agentes biológicos após falha do inibidor do fator de necrose tumoral em doentes com artrite reumatoide: um estudo de coorte prospetivo. Ther Adv Musculoskelet Dis, 2021. 13: p. 1759720×211060910.
13 Wei, W., et al, Treatment Persistence and Clinical Outcomes of Tumour Necrosis Fator Inhibitor Cycling or Switching to a New Mechanism of Action Therapy: Real-world Observational Study of Rheumatoid Arthritis Patients in the United States with Prior Tumour Necrosis Fator Inhibitor Therapy. Adv Ther, 2017. 34(8): p. 1936-1952.
14 Migliore, A., et al, Cycling of tumour necrosis fator inhibitors versus switching to different mechanism of action therapy in rheumatoid arthritis patients with inadequate response to tumour necrosis fator inhibitors: a Bayesian network meta-analysis. Ther Adv Musculoskelet Dis, 2021. 13: p. 1759720×211002682.
15 Mann, H., et al, Switching to a Targeted Drug with a Different Mode of Action After Discontinuation of the First TNF Inhibitor Is Associated with Better Drug Survival Compared to a Second TNF Inhibitor in Rheumatoid Arthritis: A Propensity Score-matched Analysis from the Czech ATTRA Registry. Resumo 2277, apresentado na Convergência ACR, 14-19 de novembro de 2024, Washington DC, EUA.
16 Resumo atual das caraterísticas do medicamento RINVOQ® (upadacitinib) em www.swissmedicinfo.ch.
17 Fleischmann, R., et al, Long-term Efficacy and Safety Following Switch Between Upadacitinib and Adalimumab in Patients with Rheumatoid Arthritis: 5-Year Data from SELECT-COMPARE. Rheumatol Ther, 2024. 11(3): p. 599-615.
18 Linde, L., et al, Second and third TNF inhibitors in European patients with axial spondyloarthritis: effectiveness and impact of the reason for switching. Rheumatology (Oxford), 2024. 63(7): p. 1882-1892.
19 Ørnbjerg, L.M., et al, Drug effectiveness of 2nd and 3rd TNF inhibitors in psoriatic arthritis – relationship with the reason for withdrawal from the previous treatment. Joint Bone Spine, 2024. 91(4): p. 105729.
20 Fleischmann, R., et al, Upadacitinib Versus Placebo or Adalimumab in Patients With Rheumatoid Arthritis and an Inadequate Response to Methotrexate: Results of a Phase III, Double-Blind, Randomised Controlled Trial. Arthritis Rheumatol, 2019. 71(11): p. 1788-1800.
21 Fleischmann, R., et al, Long-term safety and efficacy of upadacitinib versus adalimumab in patients with rheumatoid arthritis: 5-year data from the phase 3, randomised SELECT-COMPARE study. RMD Open, 2024. 10(2).
22 Witte, T., et al, The impact of C-reactive protein levels on the effectiveness of upadacitinib in patients with rheumatoid arthritis: a 12-month prospective, non-interventional German study. Clin Exp Rheumatol, 2024. 42(3): p. 726-735.
23 Bessette, L., et al, Real-World Effectiveness of Upadacitinib for Treatment of Rheumatoid Arthritis in Canadian Patients: Interim Results from the Prospective Observational CLOSE-UP Study (Resultados provisórios do estudo observacional prospetivo CLOSE-UP). Rheumatol Ther, 2024. 11(3): p. 563-582.
24 Burmester GR, et al, Safety of Upadacitinib Across Rheumatoid Arthritis, Psoriatic Arthritis, and Axial Spondyloarthritis Encompassing 15,000 Patient-Years of Clinical Trial Data. Apresentado no Congresso Europeu de Reumatologia (EULAR), 12 a 15 de junho de 2024, Viena, Áustria. POS0894.
As referências podem ser solicitadas por profissionais em medinfo.ch@abbvie.com.











