Há necessidade de melhorar a informação e educação do público sobre esta doença. Nos países industrializados, a taxa de casos não diagnosticados é estimada em cerca de 50%. Em relação à terapia, é importante uma boa cooperação entre o oftalmologista e o médico de clínica geral.
O glaucoma é uma doença crónica dos olhos que pode potencialmente levar à cegueira e é conhecida há muito tempo. Interessante e desconhecido de todos é o fundo histórico da nomenclatura: Já os antigos gregos notaram que certos pacientes cegos mostravam uma cor marcante do reflexo pupilar. A tradução da palavra grega “glaukos” é “cinzento-azul-esverdeado”. A anatomia exacta do olho e a fisiopatologia ainda não eram conhecidas. No século VIII d.C., o termo “catarata” foi cunhado para as opacidades das lentes, mas ainda assim o mecanismo exacto da cegueira não era claro. Só com a invenção do oftalmoscópio e a consequente possibilidade de avaliar o fundo do olho e o nervo óptico é que as entidades catarata e glaucoma puderam ser separadas.
O termo “glaucoma” utilizado na língua alemã, por outro lado, só foi cunhado no século XVIII. Pensava-se na altura que os “sumos” no olho podiam mudar de cor e que assumiriam uma cor esverdeada no glaucoma. No entanto, a origem exacta do termo não é conhecida. A doença pode manifestar-se em qualquer idade, mas a sua incidência aumenta significativamente com a idade. Assume-se que 2,5% de todas as pessoas com mais de 40 anos de idade na Suíça sofrem de glaucoma, sendo notável que mais de metade dos doentes afectados desconhecem a sua doença [1].
Em 2004, o glaucoma foi a causa mais comum de cegueira irreversível [2] e a catarata foi a causa mais comum de cegueira reversível. A degeneração macular senil também conduz à cegueira irreversível. Nos últimos anos, o número de pacientes que ficaram cegos devido à degeneração macular aumentou acentuadamente devido ao aumento da esperança de vida e assumiu a posição de liderança das causas da cegueira em certos países.
Fisiopatologia
Em termos simples, o globo ocular é uma estrutura esférica rodeada por uma concha sólida. Consequentemente, existe uma pressão interna variável para cada olho, o que é importante para a homeostase. Esta pressão interna é controlada pela relação entre a produção de humor aquoso e a saída de humor aquoso. No glaucoma, existe um desajuste entre estes dois componentes, e muito frequentemente o fluxo de saída no ângulo da câmara é prejudicado. Se a pressão intra-ocular subir acima da pressão tolerável para o olho em questão, ocorrem danos progressivos na parte mais fraca, o nervo óptico. O aumento dos danos nos nervos ópticos leva a uma deterioração progressiva do campo visual. É importante salientar que a pressão interna tolerável ideal é diferente para cada olho; o glaucoma progressivo pode desenvolver-se mesmo com uma pressão interna normal-baixa. As definições actuais de glaucoma omitem, portanto, a pressão interna como principal factor de lesão do nervo óptico e colocam-no em pé de igualdade com os outros factores de risco [3]. Estes factores de risco são descritos em mais pormenor na secção sobre diagnósticos.
Divisão
Os glaucomas podem ser classificados de acordo com a sua estrutura ou com a sua etiologia. Estruturalmente, distinguimos entre as seguintes formas:
- Os glaucomas de ângulo aberto (aproximadamente 90%) mostram um ângulo de câmara aberta em todo o seu percurso. A obstrução de saída do humor aquoso situa-se principalmente ao nível da malha trabecular e na transição para as veias episclerais e leva a um aumento mais ou menos pronunciado da pressão intra-ocular. Um subgrupo são pacientes com o chamado glaucoma de pressão normal, em que a pressão intra-ocular está sempre dentro do intervalo normal, mas o nervo óptico mostra sinais de danos crescentes.
- Os glaucomas de fecho angular (cerca de 5%) mostram um ângulo de câmara mais ou menos fechado. Os pacientes com uma situação dita de ângulo estreito devem ser informados dos resultados, uma vez que um rápido aumento da pressão ocular pode ocorrer sob certas condições. Este rápido aumento da pressão ocular é uma situação de emergência oftalmológica: o ataque de glaucoma agudo é muito doloroso e, para além dos sintomas oculares, leva também a um comprometimento pronunciado do estado geral.
Numa classificação de acordo com a etiologia, distinguimos entre duas formas:
- No glaucoma primário (cerca de 95%), o glaucoma é a principal doença do olho.
- No glaucoma secundário (cerca de 5%), outra doença ocular está presente e o glaucoma é uma doença secundária.
Os glaucomas congénitos são um subgrupo e a maioria são glaucomas primários.
Diagnósticos
O oftalmologista leva um historial médico para determinar o perfil de risco. Distinguimos os seguintes grupos como factores de risco [4]:
- Factores de risco familiares, especialmente glaucoma nos familiares mais próximos (pais, irmãos e avós)
- Factores de risco pessoal: A idade, a etnia e o sexo são factores dados. Os factores de risco vascular podem ser parcialmente influenciados, pelo que (especialmente a hipotensão sistémica nocturna) deve ser registada. São dignas de nota as fortes flutuações da pressão arterial, que podem ser registadas no decurso de uma medição da pressão arterial de 24 horas. Os doentes com o chamado glaucoma de tensão normal apresentam frequentemente sinais de desregulação vascular com acra fria, sintomas de Raynaud, enxaqueca e, por vezes, hipotensão sistémica. A influência da hipertensão sistémica e da diabetes mellitus ainda é controversa. O histórico da medicação é importante: os anticolinérgicos podem levar a um ataque agudo de glaucoma em pacientes com uma situação de ângulo estreito. As preparações contendo cortisona (também em pomadas ou em forma de injecção) levam a um aumento da pressão intra-ocular num terço dos pacientes. O mecanismo baseia-se num aumento da resistência de escoamento no ângulo da câmara, em que se discutem várias teorias para o efeito e se presume a presença de um defeito genético (“steroid respondedor”) [5].
- Factores de risco oculares: O factor de risco mais importante é o aumento da pressão intra-ocular, embora, como mencionado acima, cada olho tenha a sua pressão intra-ocular máxima tolerável. Outros factores de risco incluem anomalias de refracção mais elevadas (hipermetropia e miopia), uma córnea fina (norma: 500-600 microns), hemorragias intra-oculares (especialmente em torno do disco óptico) e depósitos no olho tais como dispersão de pigmentos e pseudoexfoliação, que podem bloquear o fluxo de saída no ângulo da câmara.
Durante o exame, a refracção e a acuidade visual dos olhos são determinadas a fim de obter indicações sobre o desempenho visual. A morfologia dos olhos é avaliada utilizando uma lâmpada cortada com uma ampliação de aproximadamente 10-16 vezes para identificar quaisquer factores de risco. A pressão dos olhos é geralmente medida pela tonometria de aplicação Goldmann (GAT), que ainda é o padrão de ouro [6].
Gamas óptimas de pressão intra-ocular de 8-21 mm Hg. Este é um valor estatístico, baseado num valor médio de 15 mm Hg e o desvio padrão habitual.
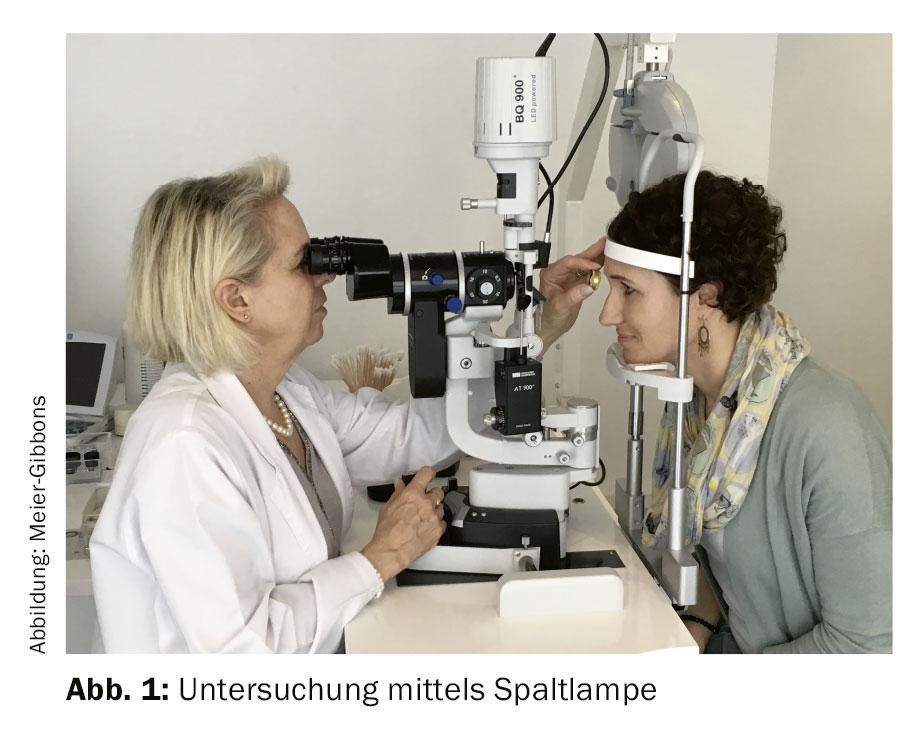
Em caso de suspeita de glaucoma, são ordenados exames adicionais (Fig. 1):
- A determinação do campo visual
- A representação morfológica do nervo óptico
- A representação do ângulo da câmara por meio de um vidro de contacto
- Medições da pressão ocular utilizando vários dispositivos de medição e determinação da espessura da córnea.
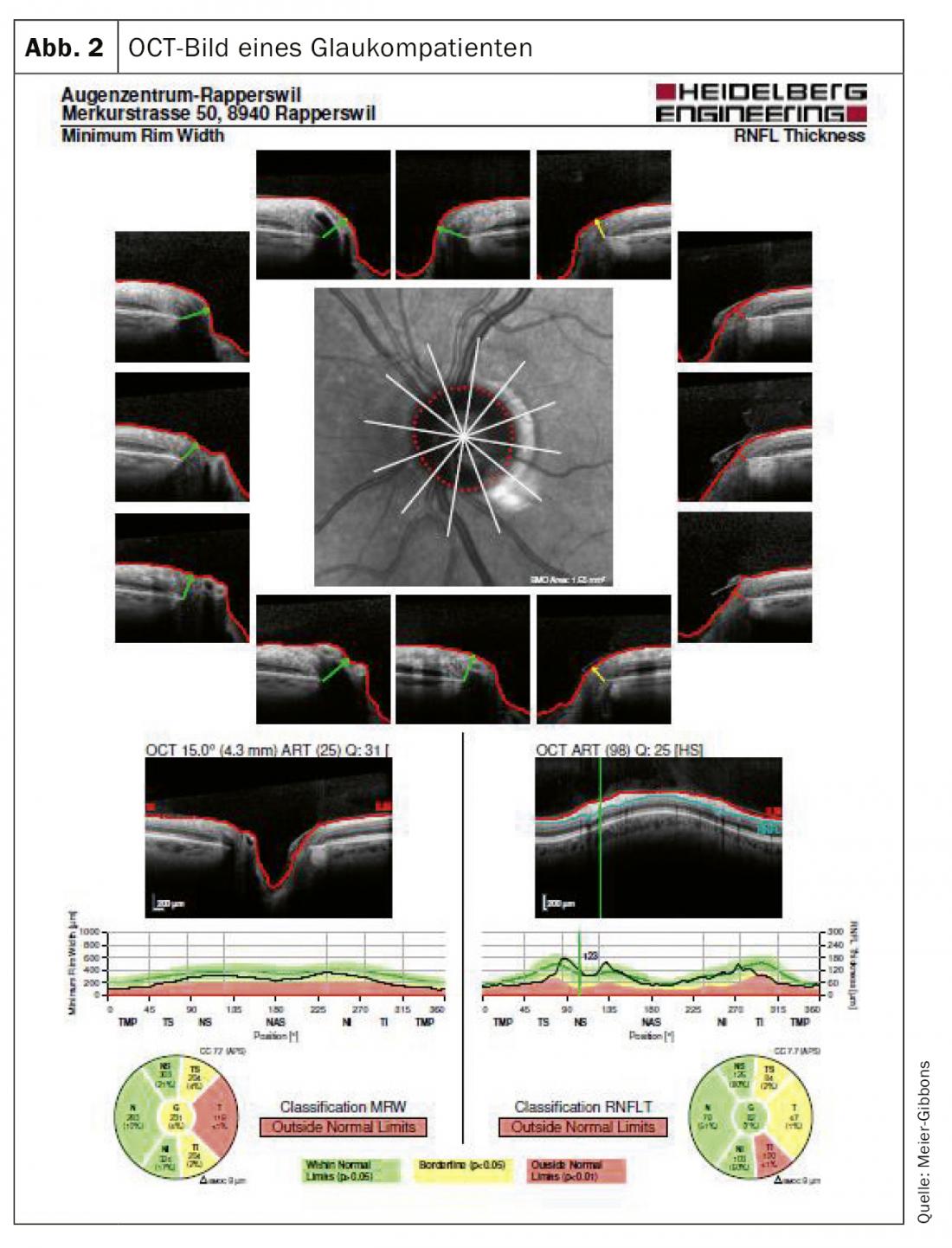
O campo visual é determinado por meio de perimetria automática. Neste exame, o paciente é apresentado com estímulos de luz monocular de vários tamanhos e intensidades dentro do campo de visão normal. O nervo óptico deve ser medido tridimensionalmente, para o qual a tomografia de coerência ocular guiada por laser (OCT) é hoje em dia mais utilizada (Fig. 2). Com este exame, as camadas de tecido nervoso podem ser retratadas com precisão e comparadas com uma base de dados normalizada. Muitas vezes ainda são tiradas fotografias a cores, uma vez que estas podem ser utilizadas para comparação mesmo após muitos anos, o que infelizmente muitas vezes não é possível com os dispositivos OCT que mudam frequentemente (Fig. 3).

É importante examinar o ângulo da câmara utilizando um vidro de contacto. A morfologia do ângulo da câmara fornece informações sobre o tipo de glaucoma presente e é importante para determinar a terapia. O exame utilizando vidro de contacto é não invasivo e indolor para o paciente.
Nos últimos anos, foram desenvolvidos vários dispositivos de medição da pressão ocular mais recentes, uma vez que estudos tinham demonstrado que a medição de acordo com o GAT não revelou a verdadeira pressão interna em certos pacientes (especialmente com córneas muito finas, na presença de alterações patológicas da córnea ou após tratamento correctivo com lasers). Tanto estes dispositivos de medição como a determinação da espessura da córnea são utilizados como um suplemento à medição de acordo com o GAT.
Todos os exames acima mencionados são indispensáveis para se fazer um diagnóstico. Distinguimos entre descobertas normais, descobertas que são suspeitas de glaucoma e claramente patológicas.
É importante informar o paciente com precisão: Se os resultados oculares forem normais, recomenda-se um controlo e o paciente é informado de que o olho pode mudar ao longo da vida e que certas doenças só podem aparecer numa idade mais avançada. É imperativo fornecer ao doente certas directrizes para a distância de controlo. Isto depende da idade, história médica, resultados locais e factores de risco.
No caso de um achado suspeito de glaucoma, é imperativo informar o doente: um achado que está no limite neste momento pode revelar-se glaucoma num curto espaço de tempo. Um doente suspeito de ter glaucoma tem, por definição (Academia Americana de Oftalmologia e Sociedade Europeia de Glaucoma), uma ou mais das seguintes descobertas:
- O disco óptico é suspeito de glaucoma
- O campo visual é suspeito para o glaucoma
- A pressão ocular é superior a 21 mm Hg (pelo que é importante medir a pressão ocular em diferentes momentos do dia para poder determinar os valores mais elevados)
Observação geral: Qualquer exame anormal deve ser primeiro repetido por razões de segurança. Se a recorrência mostrar realmente patologia, pode haver uma transição para a doença do glaucoma.
Terapia
Temos de estar conscientes de que o doente mal se apercebe da doença do glaucoma, pelo menos no início, e que cada terapia tem tanto um efeito como, frequentemente, efeitos secundários.
As directrizes da Sociedade Europeia de Glaucoma declaram que qualquer terapia deve cumprir os três pontos principais seguintes: deve ser simultaneamente eficaz e barata, e deve causar o menor número possível de efeitos secundários [3].
Neste momento, a redução da pressão intra-ocular é a única terapia que pode reduzir a progressão da doença. Evidentemente, os outros factores de risco acima mencionados devem ser verificados e reduzidos, se possível. A influência e protecção do próprio nervo óptico, a chamada neuroprotecção, seria interessante. Infelizmente, os ensaios de medicamentos anteriores não têm sido muito promissores.
Que opções temos para baixar a pressão intra-ocular? Existem realmente apenas duas opções:
- Redução da produção de humor aquoso
- Melhoria da saída de humor aquoso
Redução da produção de humor aquoso: O humor aquoso é produzido no corpo ciliar, circula nas câmaras posteriores e anteriores do olho e deixa o olho através do ângulo da câmara para a circulação vascular. A produção de humor aquoso pode ser reduzida por bloqueadores beta (BB), alfa agonistas (AA) e inibidores de anidrase carbónica (CAI). O timolol beta bloqueador tem sido utilizado na terapia do glaucoma desde 1978 e reduz a pressão intra-ocular em 20-25%. Localmente, os BB são bem tolerados, mas conduzem frequentemente a efeitos secundários sistémicos tais como a diminuição da pressão arterial e do pulso. Na nossa opinião, os pacientes com uma terapia BB planeada devem procurar discutir com o seu médico de clínica geral para evitar interferências com outros medicamentos.
Os alfa agonistas têm sido utilizados durante muitos anos, embora os AA anteriormente disponíveis tenham frequentemente conduzido a efeitos secundários locais e sistémicos muito pronunciados, pelo que já não são utilizados. Hoje em dia, a droga mais utilizada é a brimonidina, que reduz a pressão intra-ocular em 20-25%, mas também pode levar a efeitos secundários locais (hiperaemia) e sistémicos (vasculares e cerebrais).
Os inibidores de carboanidrase têm sido utilizados de forma sistémica na terapia do glaucoma desde o início dos anos 50 e também têm sido utilizados localmente desde 1994. Por vezes levam a graves efeitos secundários sistémicos, especialmente na presença de hipersensibilidade à sulfonamida. Tanto os agonistas alfa como os inibidores de anidrase carbónica são por vezes utilizados em combinação com bloqueadores beta para conseguir uma melhor redução da pressão ocular.
Melhorar a saída de humor aquoso: O humor aquoso deixa o olho de duas maneiras: A saída convencional ou trabecular e muito menos frequentemente a saída não convencional ou uveoscleral. Esta última corresponde a uma percentagem de 25-55% entre as crianças e diminui progressivamente com a idade. Uma diminuição do fluxo de humor aquoso leva a um refluxo no olho e, subsequentemente, a um aumento crescente da pressão intra-ocular. Estudos recentes mostraram que a maioria do aumento decisivo da resistência ao escoamento é na área da malha trabecular iuxtacanalicular e na área da parede interior do canal de Schlemm.
As drogas mais importantes utilizadas para melhorar a saída de humor aquoso são os agonistas locais da prostaglandina. Foram utilizados pela primeira vez na terapia de glaucoma em meados da década de 1990 e rapidamente assumiram a posição de liderança dos medicamentos antiglaucomatosos. O primeiro produto foi latanoprost, seguido de vários medicamentos semelhantes. O efeito (uma redução aproximada de 25% na pressão ocular) dura 24 horas, pelo que a aderência do paciente é melhor. Os agonistas da prostaglandina não mostram praticamente nenhum efeito secundário sistémico, mas os efeitos secundários locais podem ser consideráveis: Crescimento dos cílios, aumento da pigmentação da íris, hiperaemia da conjuntiva, mas também descoloração periorbital mais escura da pele e atrofia do tecido adiposo orbital.
Em alguns países (ainda não na Europa), dois novos grupos de substâncias foram aprovados para a terapia do glaucoma: Inibidores da raquinase e do bunod latanoprost. Ambos os medicamentos melhoram a saída de humor aquoso e também só precisam de ser usados uma vez por dia.
É importante para nós abordar brevemente a questão do uso cada vez mais comum de medicamentos genéricos. Por definição, o conteúdo dos genéricos deve ser idêntico ao dos originais. No entanto, as gotas oftálmicas diferem dos medicamentos aplicados sistemicamente de formas importantes:
- Podemos determinar a concentração da substância activa na gota ocular, mas a biodisponibilidade da substância no próprio olho não pode ser medida.
- Apenas a substância activa dos genéricos deve ser idêntica à preparação original, todos os produtos auxiliares podem variar. Uma vez que a substância activa em latanoprost, por exemplo, é apenas 0,005%, a maior parte da queda pode ser alterada num medicamento genérico.
- Muitos estudos mostraram diferenças entre medicamentos originais e genéricos em termos do tamanho e viscosidade da gota, a natureza do frasco da gota, a abertura do frasco da gota e o conservante [7].
Por conseguinte, na nossa opinião, mudar para um medicamento genérico equivale a utilizar um novo medicamento e requer verificações mais frequentes no início.
A mudança frequente para medicamentos genéricos cada vez mais baratos pelas farmácias é problemática, o que pode levar a que nem o paciente nem o médico saibam qual o medicamento que estão a utilizar no momento. Vale a pena uma discussão com o doente para apontar as diferenças entre as preparações originais e os genéricos.
Não é fácil encontrar uma terapia anti-glaucomatosa que reduza a progressão da doença, tenha poucos efeitos secundários e seja utilizada regularmente. A aderência e persistência não são muito boas no glaucoma, como em outras doenças crónicas. Muitos estudos demonstraram que a adesão à terapia prescrita é de 30-70% e que após um ano apenas 10% dos doentes reordenam os colírios prescritos [8].
As razões da má adesão são muitas, mas devemos estar conscientes de que estamos a prescrever uma terapia que precisa de ser utilizada de forma extremamente fiável e regular, mas que também tem efeitos secundários frequentes. Isto é especialmente problemático para os doentes nas fases iniciais do glaucoma, uma vez que quase não notam nada sobre a doença em si. Num estudo, Newman Casey resumiu as razões mais comuns para a não aderência: Dificuldade com a aplicação de gotas, dificuldade em integrar a aplicação de gotas na rotina diária e efeitos secundários das gotas [9]. Os efeitos secundários não devem ser subestimados. Estudos demonstraram que dois terços dos doentes com glaucoma sofrem de efeitos secundários da sua terapia [10]. São tanto os efeitos secundários locais do medicamento como os efeitos tardios sobre o olho e especialmente sobre a superfície do olho que incomodam o paciente. Se um paciente mostrar efeitos secundários da sua terapia, vale a pena mudar de terapia, possivelmente também de um derivado da prostaglandina para outro derivado. Para pacientes mais jovens, pacientes com múltiplos medicamentos e pacientes com doenças oculares de superfície pré-existentes (“síndrome de sicca”), vale a pena experimentar gotas oftálmicas sem conservantes. Os conservantes, especialmente o cloreto de benzalkonium, podem levar a um aumento dos problemas de superfície ocular. No entanto, como os colírios sem conservantes são frequentemente embalados em doses únicas, os pacientes com fraca acuidade visual ou alterações reumáticas nas mãos podem ter dificuldade em aplicá-los [11].
Para além de medicamentos anti-glaucomatosos, a pressão ocular pode ser reduzida através de medidas cirúrgicas. O primeiro procedimento cirúrgico para glaucoma foi realizado em 1856 (iridectomia por Von Graefe), e recentemente o espectro cirúrgico expandiu-se significativamente com a introdução da cirurgia de glaucoma microinvasivo (MIGS). Menos invasivas são várias técnicas laser que podem tanto reduzir a produção de humor aquoso como melhorar o fluxo de humor aquoso.
A cirurgia é considerada especialmente em pacientes jovens com glaucoma avançado ou pacientes com intolerância à terapia local (principalmente problemas de superfície ocular).
Perspectivas para o futuro
O facto de muitos doentes ainda ficarem cegos devido ao glaucoma é assustador porque a doença, se apanhada suficientemente cedo e tratada adequadamente, pode ser claramente influenciada na sua progressão. Em que é que temos de trabalhar?
Há ainda pelo menos 50% dos doentes que não sabem que têm esta doença. Por conseguinte, é imperativo educar a população a fim de identificar aqueles com glaucoma em rápido desenvolvimento, avaliando os doentes e os seus factores de risco.
Se um paciente com glaucoma inicia uma terapia, o aspecto da aderência deve ser discutido com o paciente: Uma droga administrada em forma de gota só funciona se a gota for aplicada!
A verificação regular do nervo óptico e da sua função é obrigatória; a pressão ocular deve ser verificada e a terapia ajustada em conformidade. Um paciente diagnosticado com glaucoma é normalmente verificado por um oftalmologista 2-3× por ano. Medicamentos mais recentes com menos efeitos secundários e possivelmente um modo de aplicação diferente (por exemplo, tampas punctum com uma forma de libertação lenta ou por injecção no próprio olho) podem levar a uma melhor aderência e, portanto, a uma melhor gestão do glaucoma.
As alternativas à terapia medicamentosa são importantes: a terapia laser pode ser utilizada para melhorar a saída de humor aquoso; além disso, a terapia cirúrgica está a mostrar muitas novas abordagens, e as chamadas intervenções “microinvasivas” estão cada vez mais a ser realizadas, nas quais são por vezes inseridos stents.
O próprio paciente é e continuará a ser importante: deve ser informado com precisão sobre a doença e envolvido na terapia da sua doença.
Mensagens Take-Home
- Apesar da melhoria das medidas diagnósticas e terapêuticas, o glaucoma ainda leva à redução da qualidade de vida e por vezes à cegueira em muitos pacientes. O número de doentes que desconhecem a sua doença é de 50%, mesmo nos países industrializados, e há uma necessidade de aumentar a informação pública sobre a doença.
- O médico deve tirar uma história detalhada de todos os adultos para avaliar os factores de risco para o desenvolvimento de glaucoma (familiar, sistémico e ocular). A partir dos 40 anos de idade, é necessário um exame preventivo por um oftalmologista; os chamados “exames preventivos” por vezes realizados por ópticos não são de modo algum suficientes.
- A única terapia para o glaucoma até agora é o tratamento do factor de risco mais importante, o aumento da pressão ocular. Esta terapia é realizada principalmente com medicamentos locais que reduzem a pressão ocular; com o aumento das opções cirúrgicas, a terapia cirúrgica directa será provavelmente utilizada com maior frequência no futuro.
- A boa cooperação entre o oftalmologista e o clínico geral é importante para todas as medidas terapêuticas.
Literatura:
- Quigley HA, West SK, Rodriguez J, et al: The prevalence of glaucoma in a population-based study of hispanic subjects: Proyecto VER. Arco Ophthalmol 2001; 119: 1819-1826.
- Boletim da Organização Mundial da Saúde, Novembro de 2004; 82 (11).
- EGS Guidelines Edition 2014.
- Leske CM et al. Para o Grupo de Julgamento do Glaucoma do Manifesto Antecipado. Arco Ophthalmol. 2003;121(1): 48-56.
- Kersey JP, Broadway DC: glaucoma induzido por corticosteróides: uma revisão da literatura. Eye 2006; 20: 407-416.
- Goldmann H, Schmidt T: Em tonometria de apliação. Ophthalmologica 1957; 134: 221-242.
- Genazzani AA, Pattarino F: Dificuldades na produção de medicamentos idênticos, do ponto de vista da tecnologia farmacêutica. Drogas RD 2008; 9(2): 65-72.
- Friedman DS, Quigley HA et al. Utilização de dados de alegações farmacêuticas para estudar a aderência a medicamentos para o glaucoma: metodologia e conclusões do Estudo de Adesão e Persistência do Glaucoma (GAPS). Invest Ophthalmol Vis Sci. 2007 Nov; 48(11): 5052-5057.
- Newman-Casey PA, Killeen OJ, Renner M, et al: Acesso e experiências com a tecnologia e-saúde entre doentes com glaucoma e a sua relação com a aderência a medicamentos. Telemed J E Health 2018; DOI: 10.1089/tmj.2017.0324
- Zimmerman JB, Hahn SR, Gelb L, et al: The impact of ocular adverse effects in patients treated with topical prostaglandin analogues: changes in prescription patterns and patient persistence. J Ocul Pharmacol Ther: 1308-1316.
- Dietlein TS, Jordan JF, Lüke C, et al: Auto-aplicação de recipientes de gota única numa população idosa: comparações com frascos de gota única padrão e com pacientes mais jovens. Acta Ophthalmol. 2008; 86: 856-859.
PRÁTICA DO GP 2019; 14(11): 6-10