Os tumores neuroendócrinos (NET) não são assim tão raros. A prevalência destes tumores no tracto gastrointestinal só é ultrapassada pelo carcinoma do cólon. Muitas vezes a NET só é descoberta nas fases tardias devido aos sintomas subtis e já se encontra muitas vezes numa fase paliativa e inoperacional. É por isso importante pensar sobre estes tumores. Muitas novas opções de terapia cirúrgica, local-intervencional e sistémica foram introduzidas nos últimos anos. Devido ao elevado grau de complexidade no diagnóstico e tratamento destes tumores, é desejável a cooperação numa equipa especializada de gastroenterologistas, cirurgiões, patologistas, radiologistas, especialistas em medicina nuclear, endocrinologistas e oncologistas.
Os tumores neuroendócrinos (NET) têm uma incidência relativamente baixa mas crescente de 4-5 novos casos / 100 000 habitantes por ano [1]. Contudo, a prevalência, ou seja, o número de pacientes que sofrem de tumores neuroendócrinos gastrointestinais (GEP-NET), é muito maior e só é ultrapassada no tracto gastrointestinal pelo carcinoma do cólon. Além disso, a incidência de todos os GEP-NET excepto os apêndices de carcinoides está a aumentar [2]. Na prática, a GEP-NET é mais comum do que se esperava. Esta breve panorâmica resume os factos mais importantes no diagnóstico, as diferentes formas de diagnóstico de propagação, as medidas terapêuticas mais importantes, bem como nos cuidados posteriores. O resumo baseia-se nas actuais directrizes da Sociedade Europeia de Tumores Neuroendócrinos(www.enets.org).
Classificação da GEP-NET
Os tumores neuroendócrinos são classificados principalmente de acordo com a localização do tumor primário e o número de mitoses (Ki67). A taxa mitótica é um dos factores prognósticos mais importantes e divide estes tumores em G1 (Ki67 ≤ 2%), G2 (Ki67 3-20%) e G3 (Ki67 >20%), correspondendo a fase G3 a um carcinoma neuroendócrino menos diferenciado e frequentemente agressivo em comparação com os tumores neuroendócrinos mais diferenciados [3,4].
Os tumores neuroendócrinos gastrintestinais podem ocorrer em qualquer parte do tracto digestivo. Dependendo da localização do tumor primário, as características e a forma da metástase são diferentes e requerem uma clarificação correspondentemente diferente. A incidência da rede gástrica (g-NET) tem aumentado constantemente nos últimos anos e ascende a aproximadamente 8% da GEP-NET [5]. As razões para isto são certamente a introdução generalizada da gastroscopia e possivelmente o uso frequente de inibidores da bomba de prótons [6].
As g-NETs estão divididas em três subgrupos. O tipo mais comum pode ser acompanhado por gastrite atrófica, é normalmente bem diferenciado, raramente metástase e tem um bom prognóstico. Os subtipos II e III são mais raros, metástase mais frequentemente e têm um prognóstico mais pobre (especialmente o subtipo III) [5]. O trabalho e prognóstico destes tumores gástricos devem ser adaptados de acordo com o tipo e tamanho. As redes duodenais (d-NETs) são raras (1- 2% das GEP-NETs), ocorrem principalmente nos primeiros dois terços do duodeno, são geralmente relativamente pequenas, bastante bem diferenciadas e, no entanto, metástase localmente nos gânglios linfáticos em 40-60% [7]. A incidência da GEP-NET pancreática (p-NET) situa-se entre 2 – 3/100 000 pessoas por ano [8]. Na p-NET, os primeiros sinais de doenças malignas estão frequentemente ausentes. Estes doentes apresentam ao médico compressão local ou sinais de metástases avançadas (especialmente ao fígado). Por esta razão, mais de 50% dos doentes com p-NET já têm metástase distante.
Uma doença global rara mas típica subjacente da p-NET (também da d-NET) é a Neoplasia Endócrina Múltipla Tipo I (MEN I).
Aproximadamente 20% dos doentes com MEN1 sofrem de p-NET, com uma incidência crescente com a idade [8]. Do mesmo modo, os pacientes com doença de Von Hippel-Lindau, entre outras doenças malignas, têm mais probabilidades de desenvolver a p-NET.
As redes Jejunal e ileal são as redes GEP mais comuns, representando até 30% de todos os casos [9]. As redes de intestino delgado, semelhantes às p-NETs, têm tendência a ser já metastasisadas no momento do diagnóstico. Geralmente, os gânglios linfáticos locais e mais tarde também o fígado são frequentemente afectados. NET do cólon ocorrem em aproximadamente 7% de toda a GEP-NET e têm geralmente o pior prognóstico [10]. À semelhança dos tumores já descritos, as redes de cólon já são normalmente muito avançadas no diagnóstico e metástase localmente, peritonealmente e para o fígado. A Rectal NET, por outro lado, é frequentemente encontrada relativamente cedo. Isto deve-se a sintomas precoces, tais como dor ou sangue ab ano. Por esta razão, entre outras, as metástases em NET rectal são bastante raras [10]. Globalmente, a biologia da GEP-NET difere em função da localização e diferenciação. Por conseguinte, o diagnóstico, a terapia e o acompanhamento devem ser adaptados à localização primária.
Clarificação diagnóstica e imagiologia
Dependendo da localização, a clarificação da GEP-NET é diferente. O diagnóstico é feito pela confirmação histológica [11]. Uma aspiração fina da agulha para o trabalho citológico é frequentemente insuficiente. Os marcadores obrigatórios para o diagnóstico são sinaptofisina e cromogranina A. O grau de diferenciação (G1-G3) também deve ser determinado. Outros marcadores, por exemplo, receptores individuais de somatostatina, não são obrigatórios, mas são de interesse, por exemplo, para outras etapas terapêuticas.
Após o diagnóstico ter sido feito, a encenação é feita [12]. A encenação, juntamente com a classificação, é o marcador de prognóstico mais importante para o doente. Os métodos utilizados incluem ultra-sons (incluindo ultra-sons endoscópicos), frequentemente TC com contraste, RM e métodos funcionais tais como cintilografia octreotídica e gálio-68 DOTATATE/DOTATOC PET/CT e deoxiglicose fluorina-18 (FDG) PET/CT. O domínio do ultra-som é principalmente a visualização de metástases hepáticas com uma sensibilidade e especificidade de cerca de 90%. O ultra-som endoscópico (EUS) é utilizado em particular para tumores neuroendócrinos pancreáticos (por exemplo, insulinomas pancreáticos ou tumores pancreáticos não funcionais). A especificidade/sensibilidade é superior a 90%. Os tumores duodenais são mais difíceis de visualizar utilizando EUS. A taxa de detecção destes tumores por EUS é de apenas cerca de 60%. O CT com contraste é o método mais utilizado para a encenação da GEP-NET. É importante levar a cabo uma fase arterial, especialmente no caso de metástases hepáticas. Isto aumenta a taxa de detecção de metástases hepáticas para cerca de 80%. No entanto, a sensibilidade é um pouco menor (cerca de 70%), especialmente para a p-NET e para as metástases de tecidos moles. Estes tumores são o domínio típico do exame de ressonância magnética. A ressonância magnética tem uma sensibilidade de mais de 90% para a p-NET no pâncreas. Além disso, a ressonância magnética do fígado com meio de contraste específico do fígado é o exame de escolha para encontrar metástases hepáticas. Com uma taxa de detecção de até 95%, a RM do fígado é o método mais sensível para as metástases hepáticas. Os métodos funcionais são normalmente utilizados para o diagnóstico da propagação e para medir a expressão dos receptores de somatostatina (especialmente SSTR2) [13].
A cintilografia de octreotídeos utilizada até recentemente, que tem uma exposição relativamente elevada à radiação e protocolos de registo durante vários dias, está agora a ser substituída por gálio-68 DOTATATE/DOTATOC PET/CT. O exame PET mostra uma radiação significativamente menor (aprox. 30%) e uma resolução significativamente melhorada em comparação com o método cintilográfico. Em muitos centros NET, a cintilografia foi completamente substituída por gálio-68 DOTATATE/DOTATOC PET/CT (Fig. 1) .
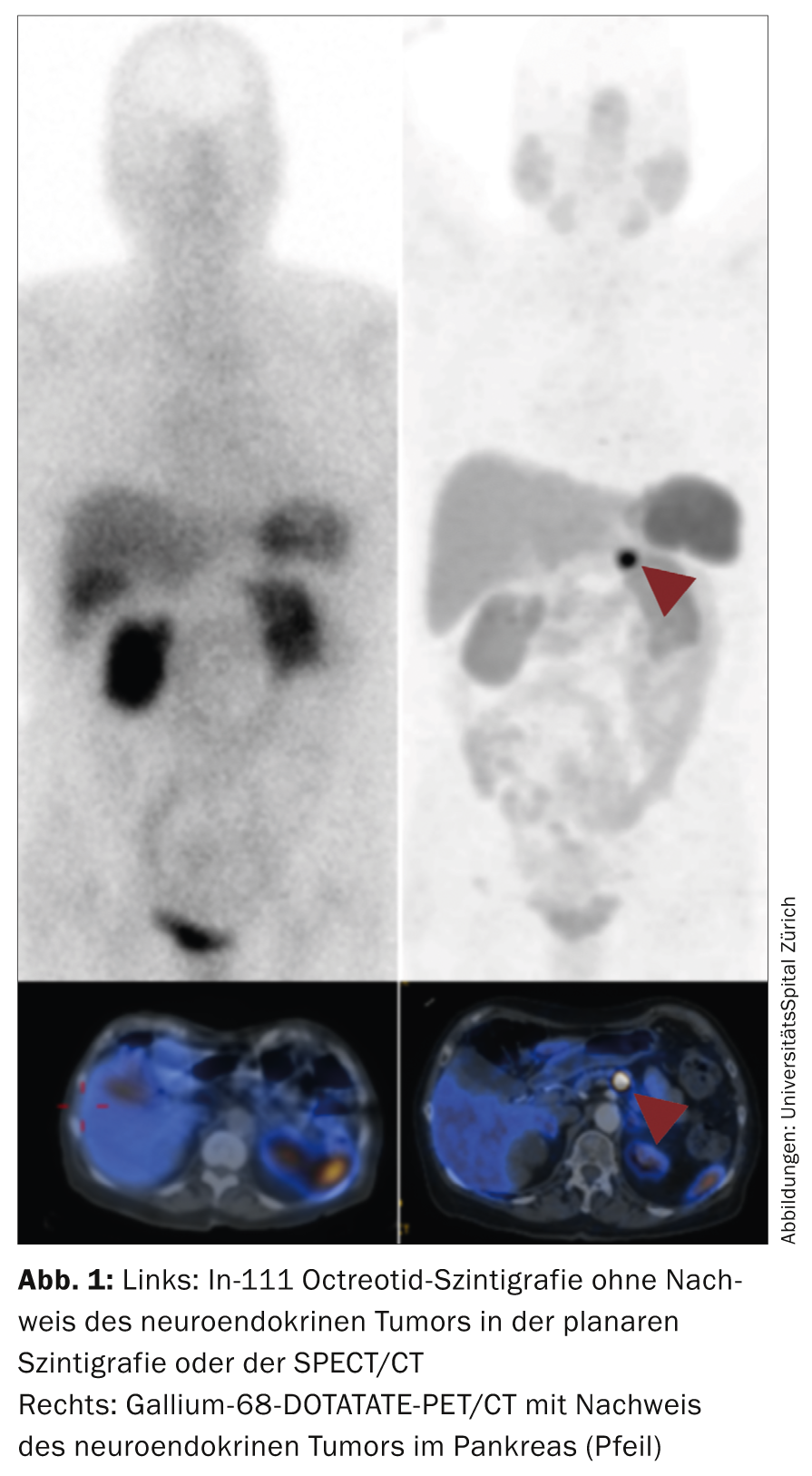
O FDG-PET/CT é utilizado para carcinomas desdiferenciados (G3), embora mesmo tumores G2 de grau superior possam aparecer melhor no FDG-PET. Os pacientes com tumores funcionais com sintomas carcinoides devem receber ecocardiografia pelo menos uma vez para excluir o envolvimento cardíaco [14].
Marcadores bioquímicos
A GEP-NET, especialmente tumores “midgut”, pode produzir e secretar peptídeos funcionalmente activos. No entanto, a taxa de tumores clinicamente funcionais versus não funcionais é apenas de cerca de 1:10. Os chamados tumores “Foregut” e “Hindgut” são um pouco menos frequentemente funcionais. A medição destes peptídeos na urina ou no sangue pode ser usada como um aparelho de progressão se os sintomas estiverem presentes [15].
O teste padrão é a medição 24h de ácido 5-indoleacético (5-HIAA) na urina. Na presença de sintomas funcionais NET, as taxas de sensibilidade e especificidade resp. a 70 e 90%. O 5-HIAA também pode ser elevado por doenças inflamatórias crónicas do intestino e assim influenciar falsamente positivamente o resultado da medição. Os medicamentos, por exemplo, medicamentos quimioterápicos ou substâncias centralmente activas como os antidepressivos tricíclicos, também podem influenciar as leituras da recolha de urina 24h e devem ser questionados.
Outros testes, tais como o teste de jejum para o insulinoma ou o teste de secretino para o gastrinoma, pertencem às mãos de um especialista experiente (por exemplo, num departamento especializado em endocrinologia). A cromogranina A (CgA) é outro importante marcador bioquímico plasmático da NET. O CgA é produzido nos grânulos neurosecretos de células tumorais e pode ser secretado igualmente em rede funcional e não funcional. Deve notar-se que o CgA pode ser falsamente elevado, especialmente se os inibidores da bomba de protões forem tomados ao mesmo tempo. Outros factores que podem aumentar a CgA são: Insuficiência renal, doença de Parkinson, hipertensão não tratada, gravidez, glicocorticóides, gastrite crónica do tipo A e doença inflamatória intestinal. No entanto, o CgA demonstrou ser mais preciso do que a medição urinária 5-HIAA ou o Neuron Specific Enolase (NSE) comummente realizado [15].
Terapia de GEP-NET
A terapia dos tumores neuroendócrinos é complexa e deve ser discutida e decidida numa base multidisciplinar. Uma placa tumoral com a presença de diferentes disciplinas diagnósticas, cirúrgicas e médicas deve decidir pelo menos uma vez sobre o diagnóstico, terapia e acompanhamento de um paciente com NET.
A primeira prioridade de qualquer terapia é apontar para a cirurgia (desde que pareça razoável). O objectivo da operação deve, sempre que possível, ser a remoção completa do tumor. Além disso, os tumores sintomáticos locais devem ser tratados cirurgicamente, por exemplo, no caso de íleo iminente ou sangue ab ano. A terapia citoreducativa pode ser discutida em certos casos num ambiente paliativo com elevada carga tumoral. No entanto, isto deve ser discutido em pormenor com o doente tendo em conta o fundo paliativo, a morbilidade por vezes elevada da intervenção e a doença que muitas vezes progride lentamente.
Os pacientes com sintomas funcionais pronunciados devem ser rastreados perioperatoriamente com Sandostatin, possivelmente bloqueadores de H1/H2 e cortisona [16]. Deve-se também notar que a catecolamina pode levar a uma maior libertação de hormonas.
Em doentes com uma elevada carga tumoral, os procedimentos intervencionais (por exemplo, embolização) podem levar a alterações rápidas na pressão arterial. Isto é particularmente importante em doentes com envolvimento cardíaco de síndrome carcinoide. Se nenhuma intervenção cirúrgica for possível, são utilizadas, em princípio, terapias de intervenção local ou sistémicas.
Os métodos intervencionais locais incluem a embolização de partículas, quimioembolização e radioembolização. A embolização clássica, no entanto, só é hoje realizada em pequenos números para a NET. Isto deve-se principalmente à elevada taxa de efeitos secundários (devido ao efeito directo de severa hipoxia e necrose local). Do mesmo modo, a quimioembolização em NET leva frequentemente a sintomas graves (principalmente síndrome pós-embolização), especialmente em tumores hepáticos avançados e grandes. A radioembolização é uma terapia elegante com geralmente poucos efeitos secundários nas mãos de especialistas experientes. Infusão local de microesferas radioactivas, tipicamente carregadas com ítrio-90, um puro emissor β, deposita radiação local até mais de 500 cinzas nas metástases hepáticas numa só sessão. Isto deve-se às propriedades de radiação do ítrio-90 e à tipicamente elevada perfusão arterial selectiva das metástases líquidas no fígado (Fig. 2).
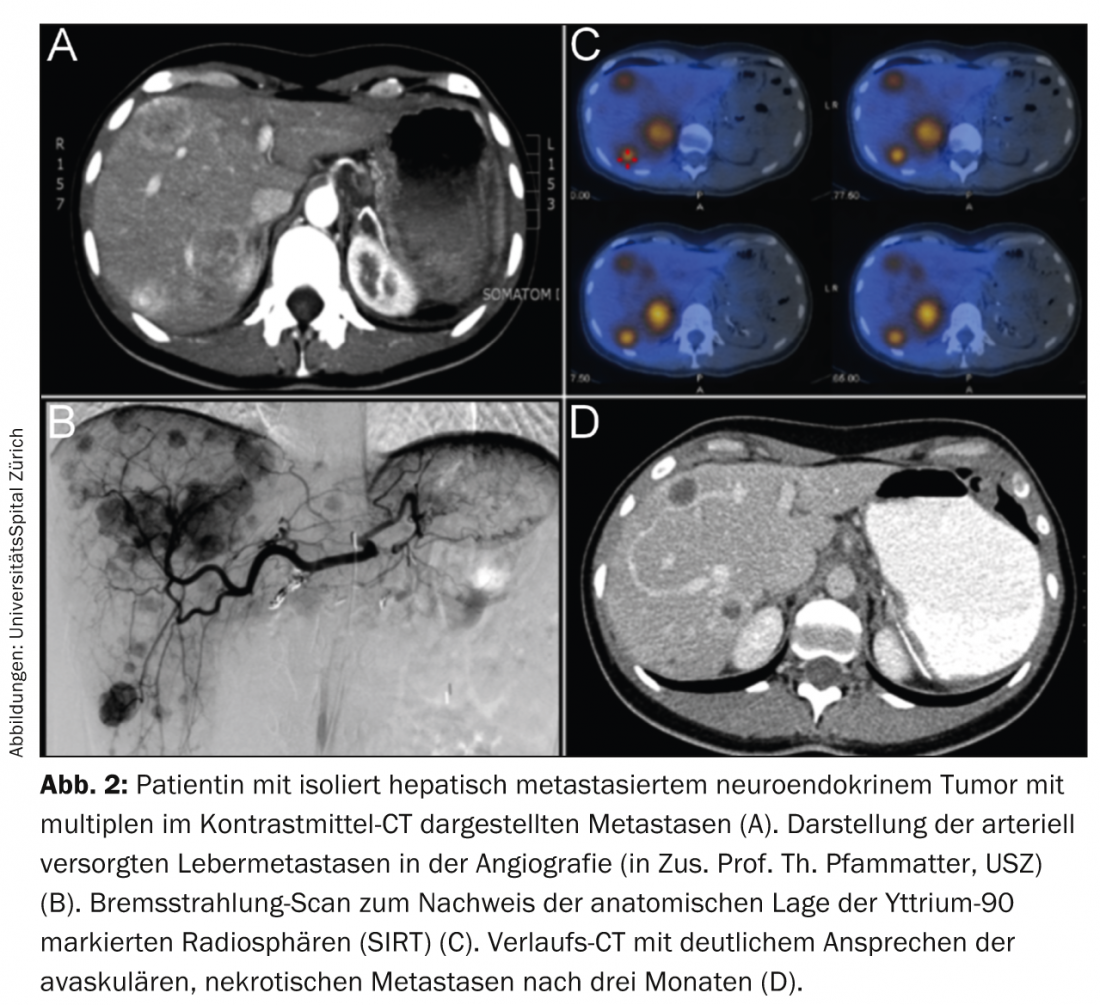
Devido à baixa taxa de efeitos secundários da radioembolização ambulatorial correctamente executada, a quimioembolização e especialmente a embolização foram quase completamente substituídas [17]. Contudo, esta terapia só é realizada regularmente em alguns centros na Suíça, por exemplo, o Centro de Excelência ENETS no Hospital Universitário de Zurique.
Se nenhuma terapia cirúrgica ou sistémica local for considerada, uma terapia sistémica paliativa deve ser discutida no conselho tumoral. Para tumores não pancreáticos, bem diferenciados “midgut”, a terapia com análogos somatostatina é o padrão como primeira linha de terapia. Em princípio, estão disponíveis duas terapêuticas diferentes de acção prolongada. Octreotide-LAR mostrou sobrevivência prolongada sem progressão em NET funcionalmente activa e inactiva num ensaio controlado por placebo (ensaio PROMID) em tumores “midgut” bem diferenciados [18]. A análise dos dados a longo prazo do estudo PROMID também mostrou uma tendência positiva por octreotídeo sobre a sobrevivência global prolongada, apesar do sucesso do cruzamento para o braço de tratamento (octreotídeo) após o progresso [19].
Foram também recentemente apresentados dados sobre lanreotide, que também mostraram uma melhoria significativa na sobrevivência sem progressão [20]. Estas preparações não foram directamente comparadas entre si e quais destas preparações podem ser utilizadas nas quais a indicação permanece por ver na prática clínica diária. Na melhor das hipóteses, o lanreotide será utilizado em tumores mais avançados com maior carga tumoral devido à concepção do estudo do Clarinete. Em tumores pancreáticos, bem diferenciados (poucos tumores de “grau intermédio”), everolimus mostrou um prolongamento da sobrevivência sem progressão e é aprovado como Afinitor® de primeira linha na p-NET [21].
Everolimus em combinação com octreotídeo também pode ser considerado para outras redes, por exemplo, pulmão e cólon, devido ao impacto positivo na sobrevivência sem progressão no ensaio RADIANT-2, que acabou de perder significado estatístico [22]. Sutent® também mostra um prolongamento da sobrevivência sem progressão e da sobrevivência global em pacientes com uma rede bem diferenciada do pâncreas [23]. Ambos os medicamentos são opções em pacientes com p-NET bem diferenciada. No entanto, os efeitos secundários destas terapias são por vezes consideráveis e devem ser realizados por um especialista experiente. As terapias sistémicas acima mencionadas são principalmente utilizadas para GEP-NET bem diferenciadas.
Para tumores G2 mais proliferativos, as quimioterapias combinadas são classicamente utilizadas. Em particular, as terapias à base de 5-fluorouracil são utilizadas em combinação com estreptozotocina ou Temodal® [24,25]. Estas quimioterapias são geralmente relativamente tóxicas, mas podem ser utilizadas com bom sucesso por oncologistas experientes, especialmente em pacientes com uma elevada carga tumoral, sintomas e crescimento relativamente rápido. Os doentes com carcinomas neuroendócrinos de células grandes ou pequenas altamente proliferativos e dediferenciados beneficiam frequentemente da combinação de quimioterapia com cisplatina e etoposida [26]. Os pacientes com alta expressão de receptores de somatostatina em cintilografia de octreotídeos ou gálio-68 DOTATATE/DOTATOC PET/CT podem ser avaliados para terapia de radionuclídeos à base de peptídeos. Esta terapia com radionuclídeos administrada sistemicamente irradia os tumores SSTR2 positivos através da ligação e absorção de análogos de somatostatina radiologicamente marcados. Esta terapia está actualmente a ser investigada num ensaio de fase III vs. octreotide-LAR. Nos ensaios da fase II, esta terapia demonstrou ser muito eficaz com uma taxa muito baixa de efeitos secundários [27]. Em particular, a insuficiência renal frequentemente mencionada ocorre em menos de 1% dos doentes. Esta terapia é oferecida por alguns centros na Suíça, por exemplo, o Centro de Excelência ENETS no Hospital Universitário de Zurique ou os Hospitais Universitários de Basileia e Berna. O Hospital Universitário de Basileia assumiu um papel pioneiro a este respeito. Novas abordagens terapêuticas estão a investigar novas combinações da terapia acima referida e a explorar novas formas, tais como a redução dos sintomas carcinoides [28]. Os análogos de somatostatina de segunda geração (pasireotide Signifor®) não mostraram um melhor controlo dos sintomas num ensaio de fase III, mas um prolongamento da sobrevivência sem progressão de cinco meses em comparação com o octreotídeo-LAR [29].
Em geral, existe uma grande variedade de terapias diferentes para a GEP-NET e estas devem ser adaptadas à localização do tumor primário e à sua diferenciação. Esta é uma das razões pelas quais os pacientes com NET devem ser discutidos num conselho especializado em tumores.
Acompanhamento de pacientes com NET
O seguimento dos pacientes com NET varia em função do tumor primário e da diferenciação do tumor. Em geral, os insulinomas benignos após a remoção, os carcinoides rectos após a remoção e os carcinoides apêndices precoces não necessitam de acompanhamento. A NET gástrica tipo I precisa de endoscopia anual. Em geral, os tumores G1 necessitam de monitorização por imagem e laboratório de doze em doze meses, os tumores G2 de seis em seis meses e os carcinomas G3 de três em três meses. O método bem sucedido de encenação [30] é recomendado.
Prof. Dr. med. Niklaus G. Schaefer
Literatura:
- Yao JC, et al: Cem anos após “carcinoide”: epidemiologia e prognóstico de factores para tumores neuroendócrinos em 35.825 casos nos Estados Unidos. J Clin Oncol 2008; 26(18): 3063-3072.
- Tsikitis VL, Wertheim BC, Guerrero MA: Trends of Incidence and Survival of Gastrointestinal Neuroendocrine Tumours in the United States: A Seer Analysis. J Cancer 2012; 3: 292-302.
- Rindi G, et al: TNM staging of foregut (neuro)endocrine tumours: uma proposta consensual que inclui um sistema de classificação. Arquivo Virchows 2006; 4; 395-401.
- Rindi G, et al: TNM staging of midgut and hindgut (neuro) endocrine tumours: uma proposta consensual que inclui um sistema de classificação. Virchows Archive 2007; 4; 757-762.
- Ruszniewski P, et al: Tumores/Carcinomas Gástricos Bem Diferenciados. Neuroendocrinologia 2006; 84: 158-164.
- Lawrence B, et al: Uma perspectiva clínica sobre neoplasia neuroendócrina gástrica. Curr Gastroenterol Rep 2011 Fev; 13(1): 101-109.
- Robert T, et al: Tumor/Carcinoma Duodenal bem diferenciado (Excluindo Gastrinomas). Neuroendocrinologia 2006; 84: 165-172.
- Falconi M, et al: Tumores/Carcinoma Pancreáticos Não Funcionais Bem Diferenciados. Neuroendocrinologia 2006; 84: 196-211.
- Eriksson B, et al: Consensus Guidelines for the Management of Patients with Digestive Neuroendocrine Tumours – Tumor/Carcinoma Jejunal-Ileal bem diferenciado. Neuroendocrinologia 2008; 87: 8-19.
- Ramage JK, et al: Consensus Guidelines for the Management of Patients with Digestive Neuroendocrine Tumours: Well-Differentiated Colon and Rectum Tumour/Carcinoma. Neuroendocrinologia 2008; 87: 31-39.
- Klöppel G, et al: ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumours: Towards a Standardized Approach to the Diagnosis of Gastroenteropancreatic Neuroendocrine Tumours and Their Prognostic Stratification. Neuroendocrinologia 2009; 90: 162-166.
- Sundin A, et al: ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumours: Radiological Examinations. Neuroendocrinologia 2009; 90: 167-183.
- Dik J, et al: ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumours: Somatostatin Receptor Imaging with 111 In-Pentetreotide. Neuroendocrinologia 2009; 90: 184-189.
- Plöckinger U, et al: ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumours: Echocardiography. Neuroendocrinologia 2009; 90: 190-193.
- O’Toole D, et al: ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumours: Biochemical Markers. Neuroendocrinologia 2009; 90: 194-202.
- Akerström G, et al: ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumours: Pre- and Perioperative Therapy in Patients with Neuroendocrine Tumours. Neuroendocrinologia 2009; 90: 203-208.
- Kennedy A, et al: Radioembolização para Metástases Neuroendócrinas Hepáticas Inesecáveis Utilizando Resina 90Y-Microsferas: Resultados iniciais em 148 Pacientes. Am J Clin Oncol 2008; 31: 271-279.
- Rinke A, et al: Estudo prospectivo e randomizado controlado por placebo, duplo-cego sobre o efeito do LAR octreotídeo no controlo do crescimento tumoral em doentes com tumores neuroendócrinos metastáticos a meio do intestino: um relatório do Grupo de Estudo PROMID. J Clin Oncol 2009 Oct 1; 27(28): 4656-4663.
- Arnold R, et al: Estudo prospectivo e randomizado controlado por placebo, duplamente cego, sobre o efeito do LAR octreotídeo no controlo do crescimento tumoral em doentes com tumores neuroendócrinos metastáticos a meio do intestino (PROMID): Resultados sobre a sobrevivência a longo prazo. J Clin Oncol 2013; 31 (suppl; abstr 4030).
- www.esmo.org/Conferences/Past-Conferences/European-Cancer-Congress-2013/News/Phase-III-Trial-Results-Favour-Lanreotide-Therapy-in-Patients-with-Gastroenteropancreatic-Neuro-Endocrine-Tumours.
- Yao JC, et al: Everolimus para tumores neuroendócrinos pancreáticos avançados. N Engl J Med 2011 Fev 10; 364(6): 514-523.
- Pavel ME, et al: Everolimus plus octreotide de acção prolongada repetível para o tratamento de tumores neuroendócrinos avançados associados à síndrome carcinoide (RADIANT-2): um estudo aleatório, controlado por placebo, fase 3. Lancet 2011 Dez 10; 378(9808): 2005-2012.
- Raymond E, et al: Malato de Sunitinib para o tratamento de tumores neuroendócrinos pancreáticos. N Engl J Med 2011 Fev 10; 364(6): 501-513.
- Engstrom PF, et al: Streptozocin plus fluorouracil versus doxorubicinoterapia para tumor carcinoide metastásico. J Clin Oncol 1984 Nov; 2(11): 1255-1259.
- Strosberg JR, et al: Quimioterapia de primeira linha com capecitabina e temozolomida em doentes com carcinomas endócrinos metastásicos do pâncreas. Cancro 2011 15 de Janeiro; 117(2): 268-275.
- Fazio N, Spada F, Giovannini M: Quimioterapia em carcinomas gastroenteropancreáticos (GEP) neuroendócrinos (NEC): uma visão crítica. Cancer Treat Rev 2013 Maio; 39(3): 270-274.
- Kwekkeboom DJ, et al.: Tratamento com o somatostato analógico radiolabelado [177 Lu-DOTA 0,Tyr3]octreotate: toxicidade, eficácia, e sobrevivência. J Clin Oncol 2008 1 de Maio; 26(13): 2124-2130.
- http://telotristat-telestar.com/what-is-the-telestar-trial.php.
- Wolin EM, et al: Um estudo multicêntrico, randomizado, cego, fase III do LAR pasireótido versus LAR octreótido em doentes com tumores neuroendócrinos metastáticos (NET) com sintomas relacionados com a doença inadequadamente controlados por análogos somatostatina. J Clin Oncol 2013; 31 (suppl; abstr 4031).
- Arnold R, et al: ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumours: Follow-Up and Documentation. Neuroendocrinologia 2009; 90: 227-233.
InFo Oncologia & Hematologia 2014; 2(5): 14-18