A neutropenia é um hóspede frequente na prática como quadro clínico independente, mas também como sintoma concomitante de muitas doenças e como reacção adversa aos medicamentos. A susceptibilidade associada à infecção pode ser um desafio em muitos casos. A boa gestão evita consequências perigosas.
A Neutropenia é um hóspede frequente na prática hematológica e oncológica como um quadro clínico independente, mas também como um sintoma de muitas doenças e como uma reacção adversa aos medicamentos. A susceptibilidade associada à infecção pode ser um desafio em muitos casos. Isto deve-se, entre outras coisas, à amplitude do espectro clínico. Desde a situação de emergência de neutropenia febril até à forma crónica muitas vezes inofensiva, tudo está representado. Por conseguinte, para uma gestão óptima, é importante conhecer a causa da neutropenia.
Severidade da neutropenia
A abordagem terapêutica também difere em função da gravidade e, portanto, do risco de infecção. Uma forma suave é entendida como tendo uma contagem absoluta de neutrófilos (ANC) entre 1000 e 1500 células por microlitro. A neutropenia moderada está presente com ANC entre 500 e 1000 células por microlitro e a neutropenia/agranulocitose grave tem ANC inferior a 500 células por microlitro (Quadro 1) .
Embora as formas suaves não exijam frequentemente tratamento, a utilização imediata e empírica de antibióticos de largo espectro e, se necessário, do factor estimulante das colónias de granulócitos (G-CSF) é indicada em casos de febre e agranulocitose [1–3].

Nem toda a neutropenia é a mesma
Para a caracterização da neutropenia, não só a sua severidade é importante, mas também o seu curso. Em princípio, é feita uma distinção entre as formas agudas e crónicas. A dinâmica temporal, medicamentos e infecções anteriores, bem como a história da família, podem fornecer informações sobre o mecanismo subjacente. Existem formas primárias e secundárias de neutropenia (visão geral 1) . A neutropenia primária é muito mais rara do que a neutropenia extrínseca. No entanto, devem ser considerados especialmente em pacientes mais jovens, cursos crónicos desde a infância e uma história familiar positiva [2–4].

A neutropenia idiopática crónica é uma das neutropenias primárias mais comuns. Predominantemente afectadas são as mulheres. Com uma duração de pelo menos três meses, trata-se de um diagnóstico de exclusão. Consequentemente, não deve haver nenhuma causa genética, infecciosa, inflamatória, auto-imune, maligna ou relacionada com drogas. Embora haja uma maior susceptibilidade a infecções bacterianas, a doença tem geralmente um curso benigno. O tratamento com G-CSF nem sempre é necessário e não é recomendado com valores de ANC superiores a 500 células/µl e sem a presença de infecções recorrentes [5]. Deve ser pesada individualmente. Até agora, não foi encontrada nenhuma causa para as grandes diferenças individuais na susceptibilidade à infecção.
A neutropenia étnica benigna, que afecta principalmente pessoas de origem africana e mediterrânica, geralmente não tem efeitos clínicos ou um curso suave [6]. Isto também se aplica à neutropenia familiar benigna, que é claramente determinada geneticamente mas independente da etnicidade [2]. Embora a base genética da neutropenia familiar benigna seja desconhecida, a neutropenia étnica benigna está associada a variantes do receptor de antigénios Duffy [7,8].
Outro exemplo de neutropenia congénita maioritariamente ligeira é a neutropenia cíclica. Esta é uma doença hereditária autossómica dominante, frequentemente com mutações no gene ELANE [9]. Caracteriza-se por flutuações periódicas na contagem dos neutrófilos com um tempo de oscilação de cerca de 21 dias. Durante o nadir, alguns doentes desenvolvem aphthae oral ou outras infecções, mas o curso geral é, na sua maioria, benigno [2].
A síndrome de Kostmann, também conhecida como neutropenia congénita grave (SCN), por outro lado, é uma condição que leva a uma elevada susceptibilidade a infecções já na infância e aumenta o risco de desenvolver leucemia mielóide aguda [10]. A persistência de neutropenia em crianças, adolescentes ou jovens adultos pode indicar falha de medula óssea subjacente. Nesses casos, recomenda-se um maior esclarecimento por peritos especializados.
Embora a neutropenia congénita e idiopática não deva ser negligenciada na clarificação das causas, a neutropenia isolada é adquirida na maioria dos casos. Vários medicamentos, doenças da medula óssea, sintomas de deficiência, infecções e processos imunológicos podem ser considerados como desencadeadores.
Um fenómeno comum: neutropenia induzida por drogas
A maior proporção de neutropenias é devida a medicamentos [1,11–13]. A incidência da agranulocitose iatrogénica é de cerca de 1-5 por milhão de habitantes por ano, com uma taxa de mortalidade de cerca de 5% [1,14]. Tipicamente, existe uma associação temporal com a terapia medicamentosa. Em princípio, muitos medicamentos podem causar neutropenia por dois mecanismos diferentes, sendo mais de metade dos casos desencadeados por alguns agentes (Síntese 2) [11–16,22]. Por um lado, os anticorpos induzidos por drogas podem levar à destruição imunitária de granulócitos neutrófilos. Por outro lado, existem agentes com efeitos citotóxicos directos sobre os precursores mielóides, tais como fenotiazinas, clozapina, dapsona e procainamida [15].

Ao contrário da neutropenia imunitária, a toxicidade directa é dose-dependente. Enquanto aqui a quantidade faz o veneno, os danos aos granulócitos no contexto da formação de anticorpos induzidos por drogas são independentes do tempo e da dose. Como é provável que a sensibilização dure uma vida inteira, uma pequena dose da substância desencadeante é suficiente para causar neutropenia ou mesmo agranulocitose uma e outra vez. Devido aos diferentes mecanismos dos danos neutrófilos, os efeitos das diferentes drogas são difíceis de prever e de caracterizar. A figura 1 dá uma visão geral de alguns valores empíricos.
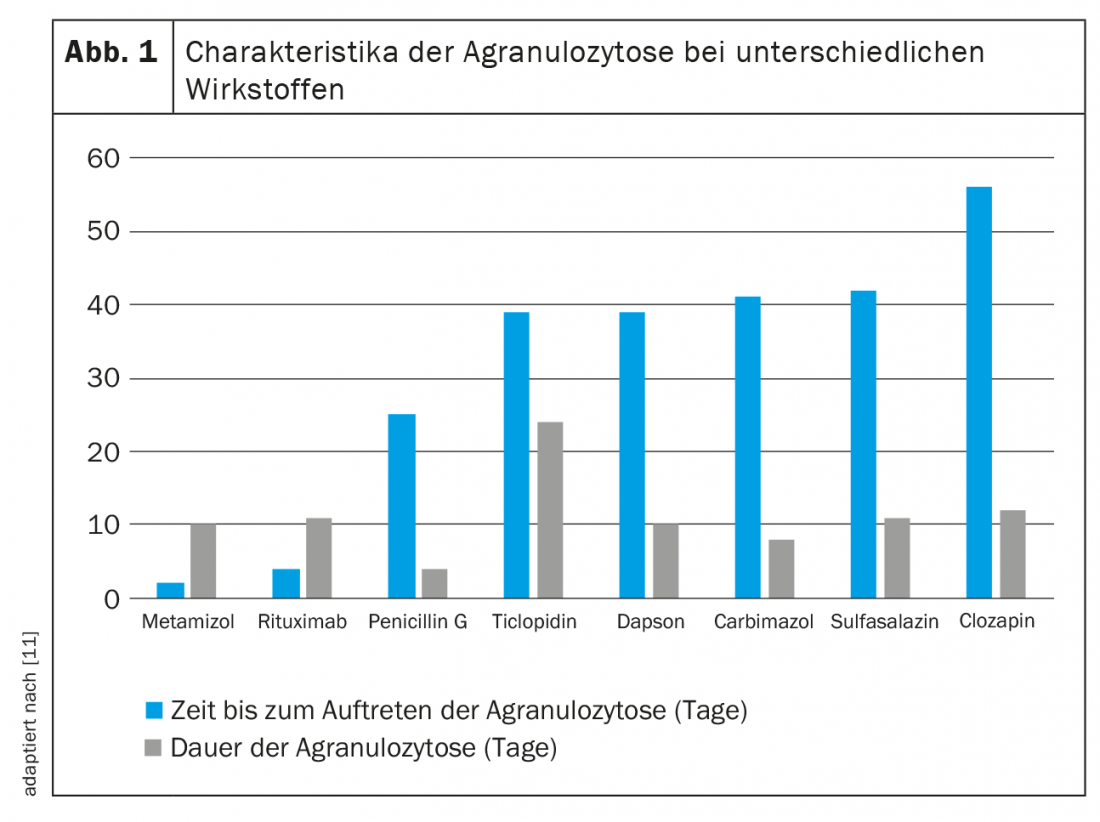
Provavelmente o agente mais notório que representa um risco de agranulocitose é o metamizol (Novalgin®). Os dados correspondentes foram publicados já em 1964 [16]. A neutropenia ocorre normalmente nos primeiros dois meses de tratamento e normaliza-se no prazo de duas semanas [11]. Estima-se que o risco de neutropenia induzida por metamizol se situa entre 1/116 e 1/466 000 exposições. O risco absoluto é baixo com uma dosagem normal e uma utilização curta, com grandes diferenças geográficas [17,18]. Embora a incidência seja elevada na Suécia, por exemplo, parece ser mais baixa nos Países Baixos ou em Espanha. Isto pode ser devido a diferentes padrões de utilização, uma vez que o risco aumenta com uma administração mais prolongada de medicamentos e uma co-medicação desfavorável. A hipótese de que, por exemplo, os britânicos, irlandeses e escandinavos têm um risco mais elevado de agranulocitose relacionada com o metamizol devido à sua etnia foi investigada num estudo epidemiológico [19]. Isto concluiu que certos alelos HLA poderiam também ter uma ligação com o desenvolvimento da neutropenia sob terapia de metamizol.
O resultado final é que o metamizol – embora crítico do ponto de vista hematológico – é uma escolha defensável em alguns casos, apesar do risco de agranulocitose, especialmente em comparação com analgésicos alternativos como os anti-inflamatórios não esteróides (AINEs). Estes tendem a ter um perfil de efeitos secundários ainda menos favorável, que não deve ser descurado [20]. No entanto, o metamizol deve ser usado com cautela e com o cuidado necessário. Embora não sejam recomendados controlos laboratoriais regulares em doentes assintomáticos, os indivíduos afectados devem ser educados sobre o risco de agranulocitose e os seus sintomas [21].
Em geral, a velhice, mau estado de desempenho, septicemia ou choque, insuficiência renal e valores de ANC inferiores a 100 células/µl são considerados factores prognósticos desfavoráveis na neutropenia induzida por drogas [1]. Por outro lado, a terapia com antibióticos intravenosos de largo espectro e G-CSF melhora o prognóstico [1]. Através da crescente experiência na gestão de pacientes afectados, grandes progressos têm sido feitos neste campo nos últimos anos. Contudo, a administração do G-CSF, em particular, ainda é controversa. Estatisticamente, a administração mostra hospitalizações mais curtas e menos uso de antibióticos, mas não há directrizes claras sobre o uso de G-CSF em não quimioterapia, agranulocitose induzida por fármacos [13,22–24]. Se a contagem de neutrófilos for inferior a 100 células/µl, devem ser dados factores de crescimento hematopoiético, caso contrário a decisão tem de ser pesada individualmente.
Neutropenia e infecções: A galinha e o ovo
Vírus como o VIH, EBV, CMV , hepatite A e Sars-CoV-2 podem causar neutropenia. Além disso, a neutropenia pode ocorrer em febre tifóide, brucelose, tularemia, shigellosis e tuberculose, com a deficiência de neutrófilos a favorecer novamente a infecção. Rickettsiae e vários parasitas também podem causar neutropenia. A gripe é mais disseminada nas nossas latitudes e afecta a Suíça todos os anos. A maioria dos casos ligeiros e transitórios de neutropenia ocorrem, mas existe uma correlação clara. O risco parece ser maior para a gripe B do que para a gripe A [25]. Outro risco que pode ser eliminado com a vacinação contra a gripe.
A gestão na vida clínica diária
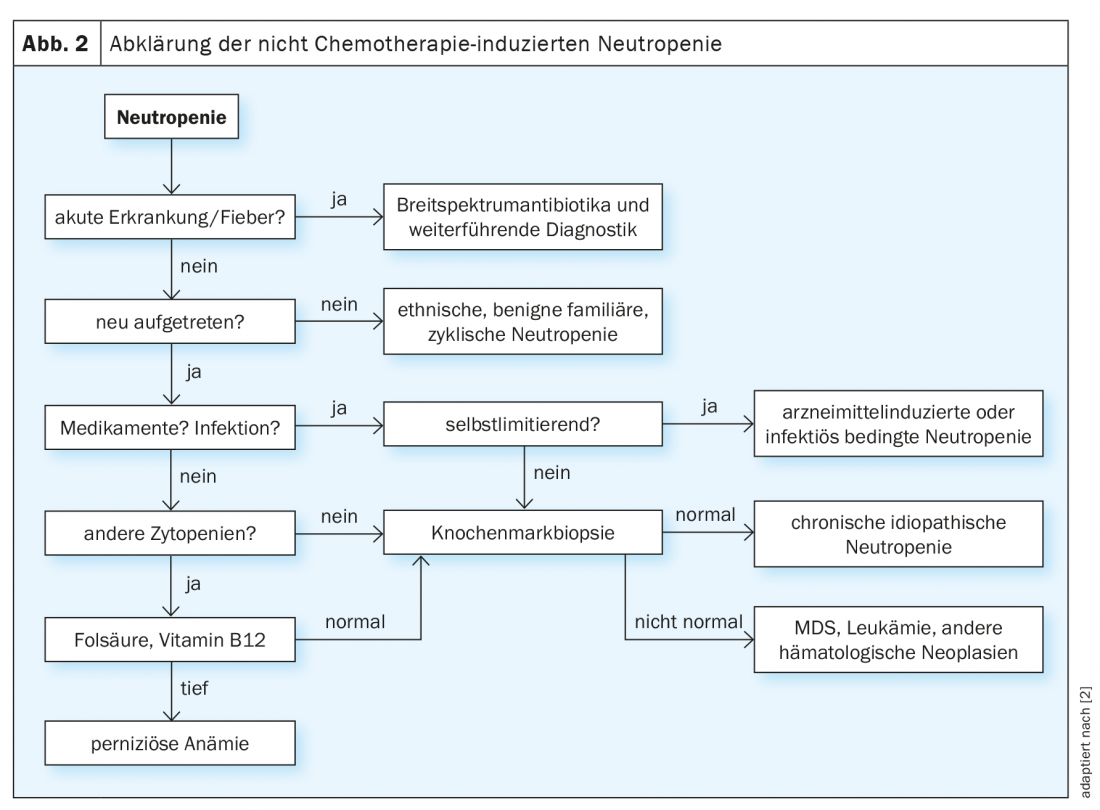
Embora a febre na neutropenia seja sempre uma indicação para uma terapêutica antibiótica adequada com ou sem administração de G-CSF, a procura subsequente da causa revela-se frequentemente um processo moroso (Fig. 2) [2,3]. Cursos crónicos, especialmente suaves, na idade adulta são mais indicativos de formas primárias de neutropenia, tais como neutropenia étnica benigna. Uma ocorrência aguda, por outro lado, é um indicador de uma génese induzida por drogas ou infecciosa da desordem, especialmente se houver uma exposição correspondente na história. Se a contagem dos neutrófilos se normalizar no decurso da doença, não é necessário qualquer esclarecimento adicional neste caso. No entanto, se a etiologia não for clara, deve ser realizado um exame à medula óssea.
A terapia de neutropenia não induzida por terapias químicas depende principalmente do risco individual de infecção e da causa, sendo que o espectro varia desde a administração contínua de G-CSF até um procedimento de espera e observação. É importante que todos os doentes conheçam o seu risco individual de infecção, bem como os sinais de aviso e as precauções e possam agir em conformidade.
Em caso de infecções agudas, a administração de G-CSF pode ser considerada [2,3,26]. Isto nunca deve basear-se puramente na contagem de neutrófilos e, portanto, só deve ser utilizado em neutropenia sintomática. Mesmo um aumento do ANC para mais de 250 a 300 células/µl pode reduzir drasticamente a taxa de infecção em doentes sintomáticos [2].
Naturalmente, a terapia causal da neutropenia – se disponível – é a primeira prioridade. A substituição do ácido fólico e da vitamina B12, bem como, por exemplo, a terapia da neutropenia auto-imune com metotrexato ou ciclofosfamida são apenas alguns exemplos que demonstram a importância de um esclarecimento adequado das causas [27].
Caso especial COVID-19
Os dados sobre a administração de G-CSF na presença de infecção por Sars-CoV-2 são poucos, mas no entanto bastante preocupantes, especialmente em doentes com tumores. Por exemplo, num estudo que incluiu 55 pacientes, observou-se um resultado pior da doença com o tratamento com G-CSF [28]. As 16 pessoas que receberam G-CSF tiveram uma maior procura de oxigénio e mortalidade. Num estudo de caso de três casos, o G-CSF foi postulado para promover a inflamação e activação de macrófagos. Em todos os pacientes, a deterioração clínica ocorreu cerca de 72 horas após a administração do medicamento [29]. Observações comparáveis foram descritas noutro relatório de caso sobre um paciente COVID-19 de 47 anos [30].
O risco de tratamento com G-CSF na presença de COVID-19 não pode certamente ser avaliado de forma conclusiva com base nos dados actuais. A necessidade de dados adicionais é grande e isto pode ser pioneiro para os anos vindouros.
Perspectivas
Uma análise retrospectiva de todos os casos com neutropenia isolada inferior a 500 células/µl entre 2015 e Setembro de 2020 está actualmente em curso na Universidade Inselspital de Berna. Os pacientes com quimioterapia ou radioterapia e aqueles com outras citopénias concomitantes não estão incluídos. O principal objectivo é recolher dados sobre a causa, terapia, taxas de infecção e hospitalização, bem como outros resultados. Esperamos descobrir correlações que possam ser relevantes para a estratificação do risco e, portanto, também terapêuticas.
Mensagens Take-Home
- Neutropenia/agranulocitose deve receber a nossa atenção devido ao aumento do risco de infecção com possíveis cursos severos.
- A neutropenia induzida por drogas é a forma mais comum de neutropenia isolada.
- As formas crónicas benignas de neutropenia em adultos são diagnósticos de exclusão e têm geralmente um curso benigno.
- O tratamento com G-CSF deve ser sempre pesado individualmente e é recomendado para infecções recorrentes e contagens de neutrófilos inferiores a 0,5 ×109/L. A administração profiláctica de antibióticos não é recomendada.
- A Neutropenia pode ocorrer como resultado da infecção por COVID-19. O efeito do G-CSF em doentes com COVID-19 ainda não está claro. A utilização de G-CSF, especialmente em pacientes com tumores, deve ser feita com cautela até que estejam disponíveis mais dados.
Literatura:
- Andres E, et al: Apresentação clínica e gestão da agranulocitose induzida por fármacos. Revisão especializada em hematologia 2011; 4(2): 143-151.
- Gibson C, Berliner N: Como avaliamos e tratamos a neutropenia em adultos. Sangue 2014; 124(8): 1251-1258.
- Dale DC: Como diagnosticar e tratar a neutropenia. Opinião actual em hematologia 2016; 23(1): 1-4.
- Palmblad J, et al: Como diagnosticamos e tratamos a neutropenia em adultos. Revisão especializada em hematologia 2016; 9(5): 479-487.
- Dale DC, Bolyard AA: Uma actualização sobre o diagnóstico e tratamento da neutropenia idiopática crónica. Curr Opinião Hematol 2017; 24(1): 46-53.
- Atallah-Yunes SA, Ready A, Newburger PE: neutropenia étnica benigna. Revisões de sangue 2019; 37: 100586.
- Rappoport N, et al: The Duffy antigen receptor para quimiocinas, ACKR1,- ‘Jeanne DARC’ de neutropenia benigna. Revista britânica de hematologia 2019; 184(4): 497-507.
- Reich D, et al: A redução da contagem de neutrófilos em pessoas de origem africana deve-se a uma variante regulamentar no receptor de antigénio Duffy para o gene das quimiocinas. PLoS Genet 2009; 5(1): e1000360.
- Dale DC: neutropenia cíclica e crónica: uma actualização sobre diagnóstico e tratamento. Avanços clínicos em hematologia e oncologia 2011; 9(11): 868-869.
- Welte K, Zeidler C, Dale DC: Neutropenia congénita grave. Seminários em hematologia. 2006; 43(3): 189-195.
- Andersohn F, Konzen C, Garbe E: Revisão sistemática: agranulocitose induzida por fármacos não quimioterápicos. Anais de medicina interna 2007; 146(9): 657-665.
- Garbe E: Agranulocitose não induzida por fármacos de quimioterapia. Parecer de peritos sobre segurança dos medicamentos 2007; 6(3): 323-335.
- Andres E, et al: Gestão moderna da agranulocitose não induzida por medicamentos: um estudo de coorte monocêntrico de 90 casos e revisão da literatura. Revista Europeia de Medicina Interna 2002; 13(5): 324-328.
- Kaufman DW, et al: Incidência relativa de agranulocitose e anemia aplástica. Am J Hematol 2006; 81(1): 65-67.
- Tesfa D, Keisu M, Palmblad J: Agranulocitose induzida por drogas Idiosincráticas: possíveis mecanismos e gestão. Revista americana de hematologia 2009; 84(7): 428-434.
- Huguley CM: Agranulocitose induzida pela dipirona, um antipirético e analgésico perigoso. JAMA 1964; 189: 938-941.
- Ibanez L, et al: Agranulocitose associada à dipirona (metamizol). Revista Europeia de Farmacologia Clínica 2005; 60(11): 821-829.
- Hedenmalm K, Spigset O: Agranulocitose e outras discrasias sanguíneas associadas à dipirona (metamizol). Revista Europeia de Farmacologia Clínica 2002; 58(4): 265-274.
- Shah RR: Agranulocitose induzida por metamizol (dipirona): O risco varia de acordo com a etnia? J Clin Pharm Ther 2019; 44(1): 129-133.
- Fauler J: Efeitos indesejáveis dos AINSIDA e coxibs. MMW Avanços em Medicina 2005; 147(31-32): 31-35.
- Stamer UM, et al.: Dipirona (metamizol): Considerações sobre a monitorização para a detecção precoce da agranulocitose. Dor 2017; 31(1): 5-13.
- Njue L, Baerlocher GM: neutropenia/agranulocitose induzida por drogas. o médico informado 2018; 02/2018: 23-26.
- Beauchesne MF, Shalansky SJ: Agranulocitose não induzida por medicamentos: uma revisão de 118 pacientes tratados com factores de estimulação da colónia. Farmacoterapia 1999; 19(3): 299-305.
- Sprikkelman A, de Wolf JT, Vellenga E: A aplicação de factores de crescimento hematopoiético na agranulocitose induzida por drogas: uma revisão de 70 casos. Leucemia 1994; 8(12): 2031-2036.
- Higgins P, et al: Taxas de neutropenia em adultos com gripe A ou B: uma análise retrospectiva de pacientes hospitalizados no Sudeste de Queensland durante 2015. Intern Med J 2016; 46(11): 1328-1332.
- Dale DC, et al: Um ensaio aleatório controlado fase III de factor estimulante de granulócitos humanos recombinantes (filgrastim) para o tratamento de neutropenia crónica grave. Sangue 1993; 81(10): 2496-2502.
- Starkebaum G: Neutropenia crónica associada à doença auto-imune. Seminários em hematologia 2002; 39(2): 121-127.
- Morjaria S, et al: The Effect of Neutropenia and Filgrastim (G-CSF) in Cancer Patients With COVID-19 Infection. medRxiv 2020.
- Nawar T, et al.: Granulocyte-colony stimulating factor in COVID-19: Estará a estimular mais do que apenas a medula óssea? Am J Hematol 2020; 95(8): E210-E3.
- Taha M, Sharma A, Soubani A: deterioração clínica durante a recuperação de neutropenia após terapia com G-CSF em paciente com COVID-19. Relatórios de casos de medicina respiratória 2020; 31: 101231.
InFo ONCOLOGy & HEMATOLOGy 2021; 9(1): 5-9