A incidência de carcinoma endometrial está a aumentar. Em mulheres na pós-menopausa, normalmente torna-se perceptível cedo através de hemorragia vaginal. Mais de 70% dos pacientes estão na fase I do FIGO no diagnóstico. A terapia cirúrgica consiste em histerectomia, adexectomia bilateral e, dependendo do perfil de risco, sentinela e/ou linfonodectomia pélvica e para-aórtica. A terapia adjuvante depende da encenação e do risco de recidiva.
O carcinoma endometrial é o tumor ginecológico maligno mais comum e a sexta doença maligna mais comum em todo o mundo. A incidência anual na Europa Ocidental está a aumentar e é actualmente de 10-25:100.000 mulheres [1]. A doença é geralmente diagnosticada em fases iniciais confinadas ao útero e em mulheres na pós-menopausa devido a hemorragia vaginal. Na pré-menopausa, a doença pode manifestar-se através de alterações na intensidade e frequência da menstruação.
Nova classificação biológica molecular?
O carcinoma endometrial está classicamente dividido em duas categorias: O Tipo I, que é mais comum (80%) e tem origem na hiperplasia endometrial atípica, corresponde histologicamente aos adenocarcinomas endometriais. Os carcinomas de tipo II são mais agressivos e incluem carcinomas celulares claros, carcinomas serosos e carcinosarcomas. No entanto, esta classificação, baseada apenas na histologia, está agora a ser questionada. Está actualmente em discussão uma nova classificação biológica molecular, que poderá ser mais prognóstica e terapeuticamente relevante. A idade média na altura do diagnóstico tem sido considerada mais elevada para os carcinomas de tipo II até agora. Contudo, um estudo prospectivo de mais de um milhão de mulheres norueguesas, que incluiu 992 cancros de tipo II, não mostrou diferença (idade média em ambos os grupos: 65 anos) [2].
O carcinoma endometrial de tipo I é dependente do estrogénio. Além disso, a utilização a longo prazo de estrogénios sem protecção de progestogénio, síndrome metabólica com obesidade, menarca precoce, menopausa tardia, tratamento com tamoxifeno e níveis elevados de estrogénio (por exemplo, na síndrome dos ovários policísticos) são considerados factores de risco para carcinomas de tipo I. A hipertensão arterial e a diabetes mellitus também estão incluídas. Além disso, o cancro endometrial ocorre em 40-60 doentes com síndrome de Lynch e em 5-10% dos doentes com síndrome de Cowden.
A contracepção hormonal, por outro lado, reduz o risco de cancro endometrial em cerca de 50%. O fumar também parece ser um factor de protecção. O seu efeito protector pode ser explicado pela estimulação do metabolismo dos estrogénios hepáticos. Outros factores de protecção são uma idade elevada no último nascimento e o consumo de café e chá.
Encenação e avaliação de risco
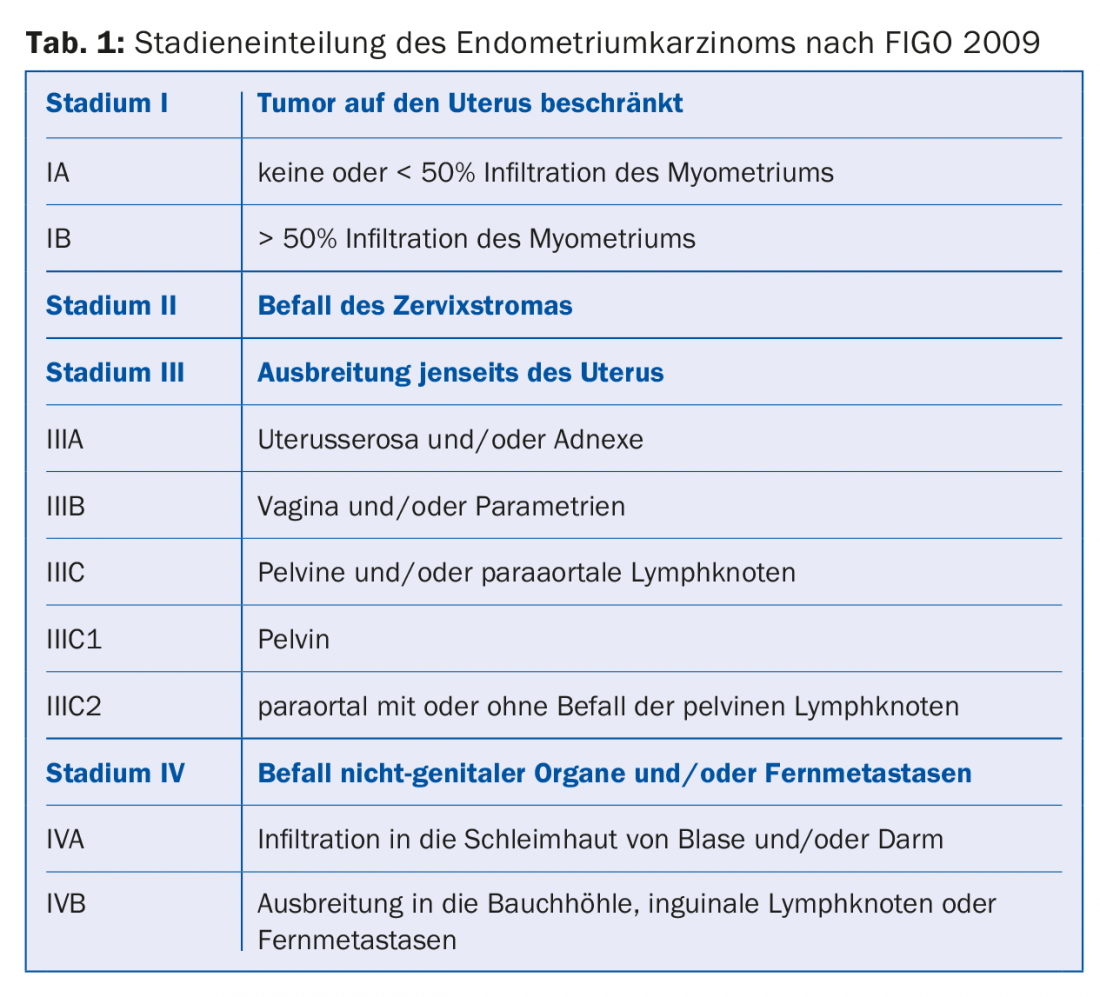
Desde 2009, a versão actualizada da encenação de acordo com FIGO [3] está em vigor (Tab. 1) . A sobrevivência de 5 anos para a fase IA é de ~90%, para a fase IB de 78% e diminui para 57% para a fase IIIC1 resp. a 49% no caso de envolvimento de gânglios linfáticos paraaórticos (IIIC2) [4].
Na fase I, são definidos três grupos de risco dependendo da fase histológica de maturidade (G1-3) e histologia (tipo endometrióide vs. tipo não endometrióide) (Tab. 2) . Uma análise molecular abrangente de 373 carcinomas endometriais publicada em 2013 identificou quatro subtipos de prognósticos diferentes. Isto poderia levar a uma nova classificação no futuro, o que possivelmente mudaria a terapia do carcinoma endometrial [5].

Diagnósticos
Não existe nenhuma medida de rastreio baseada em provas no que diz respeito ao carcinoma endometrial. A doença é mais frequentemente diagnosticada em mulheres na pós-menopausa devido a hemorragia vaginal. Na pré-menopausa, pode manifestar-se através de alterações na intensidade e frequência da menstruação. O diagnóstico já pode muitas vezes ser suspeito através de ultra-sons vaginais e depois estabelecido com a chamada pipelle de cornier (biópsia endometrial). É importante estabelecer se a fonte de hemorragia é realmente o cavum uteri e não o colo do útero, vagina, recto ou mesmo a bexiga. Se a pipeta não for possível ou a biopsia não for representativa, o diagnóstico é feito por histeroscopia e curetagem. Em caso de suspeita de uma fase avançada, pode ser realizada uma TC abdominal para o estadiamento pré-operatório.
Cirurgia
Desejo de ter filhos: No caso de um desejo urgente de ter filhos e de um carcinoma endometrióide bem diferenciado na fase T1a, a terapia de preservação da fertilização pode ser considerada se tiver sido assegurado histeroscopicamente que não há carcinoma residual no útero. A infiltração miométrica e as metástases ovarianas devem ser excluídas por ultra-sons transvaginais, ressonância magnética e laparoscopia. Os pacientes devem ser informados sobre a maior probabilidade de recorrência, a possibilidade de progressão e a necessidade de um acompanhamento próximo. A aplicação contínua de progestogénio oral com acetato de medroxiprogesterona 200 mg/d é a terapia de escolha. Um check-up com ultra-som transvaginal, histeroscopia e biópsia endometrial é realizado de três em três meses. A gravidez só deve ser tentada depois de uma reprogramação inconspícua, se necessário com reprodução assistida, a fim de manter o tempo de gravidez o mais curto possível. Após o desejo de ter um filho ter sido realizado, é necessária uma terapia cirúrgica adequada à fase, devido ao elevado risco de recidiva.
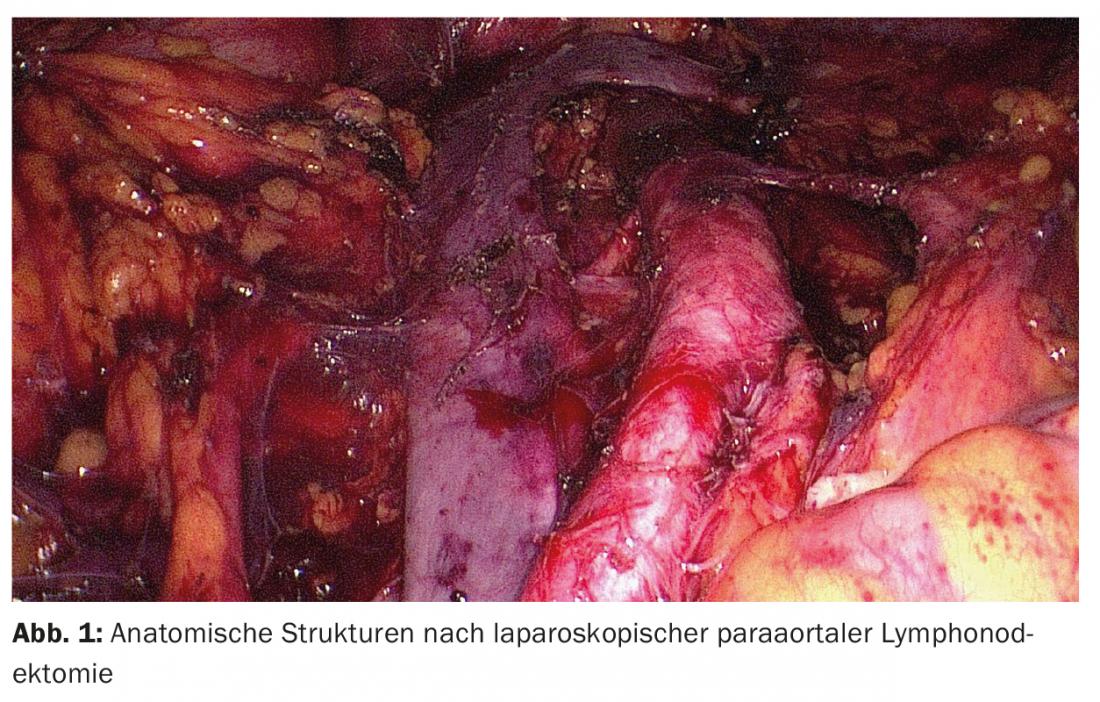
Encenação laparoscópica: Excepto em casos de desejo urgente de ter uma criança e situações de alto risco com operabilidade limitada, a terapia cirúrgica é realizada principalmente. O estadiamento cirúrgico sistemático consiste em histerectomia, adnexectomia bilateral e, dependendo do perfil de risco, sentinela e/ou linfonodectomia pélvica e para-aórtica. Em casos raros, é também indicada uma omentectomia. Tradicionalmente, a encenação do carcinoma endometrial tem sido realizada por laparotomia. Nos últimos anos, no entanto, vários estudos compararam o estadiamento por laparotomia com o estadiamento por laparoscopia [6]. Uma vez que as vantagens claras do procedimento laparoscópico em comparação com a cirurgia aberta clássica (menos complicações e hospitalização mais curta) com a mesma frequência de recorrência e taxa de sobrevivência de 5 anos foram demonstradas em estudos aleatórios e meta-análises, a cirurgia deve ser realizada laparoscopicamente como padrão nos dias de hoje (Fig. 1). No que diz respeito à cirurgia assistida por robôs, não foram publicados até à data quaisquer estudos que demonstrem uma vantagem sobre a laparoscopia no tratamento cirúrgico do carcinoma endometrial.
Linfonodectomia: Uma questão central controversa é quando deve ser realizada uma linfonodectomia e até que ponto. Dois ensaios multicêntricos randomizados, que infelizmente têm graves falhas formais, não conseguiram demonstrar um benefício de sobrevivência apenas para a linfonodectomia pélvica [7,8]. Os dados sobre o significado da linfonodectomia pélvica sistemática e para-aórtica são escassos; não há estudos aleatórios prospectivos. Um estudo de coorte retrospectivo mostrou que os pacientes com risco intermédio ou elevado de recorrência que foram submetidos a linfonodectomia pélvica e para-aórtica tinham uma esperança de vida mais longa do que aqueles que foram submetidos a linfonodectomia pélvica sozinhos. Esta vantagem não pôde ser encontrada com baixo risco [9].
Embora o efeito terapêutico directo da linfonodectomia continue a ser controverso, é geralmente aceite que é utilizada para avaliar o prognóstico e decidir sobre a terapia adjuvante. Se os gânglios linfáticos forem discretos, a terapia adjuvante pode ser dispensada, evitando assim uma toxicidade desnecessária. Uma vez que a linfonodectomia aumenta tanto a morbilidade operatória como a pós-operatória, só deve ser realizada se houver uma elevada probabilidade de nódulos linfáticos cancerígenos. Um estudo de coorte prospectivo mostra que em doentes com risco intermédio e elevado de recorrência, os gânglios linfáticos pélvicos foram positivos em 17% e os gânglios linfáticos para-aórticos em 12%. 55% dos doentes com gânglios linfáticos pélvicos positivos também tinham gânglios linfáticos para-aórticos positivos. Além disso, 3% dos doentes com gânglios linfáticos pélvicos negativos tinham gânglios linfáticos para-aórticos positivos.
Curiosamente, a maioria dos doentes com gânglios linfáticos paraaórticos positivos mostrou envolvimento entre os vasos renais e a artéria mesentérica inferior (IMA) [10]. Assim, para riscos intermédios e superiores de recorrência, recomenda-se geralmente a linfonodectomia pélvica e para-aórtica. Se o risco é baixo, por outro lado, a probabilidade de gânglios linfáticos cancerosos permanece tão baixa (3-5%) que uma linfonodectomia não é realizada.
Contudo, como já foi mencionado, a linfonodectomia está associada à morbilidade intra e pós-operatória. O risco de linfedema é relatado entre 5 e 38%, dependendo do estudo. Para contornar isto, o conceito do gânglio linfático sentinela está actualmente também a ser avaliado em carcinoma endometrial em vários estudos em curso. Uma meta-análise de 26 estudos com 1101 operações de gânglios linfáticos sentinela mostrou uma sensibilidade de 93 por cento para a detecção de metástases dos gânglios linfáticos [11]. A técnica da ICG parece dar as melhores taxas de detecção (Fig. 2) e poderá vir a estabelecer-se no futuro [12]. Isto permitiria a captura dos gânglios linfáticos raramente afectados pelo carcinoma com baixo e médio risco de recorrência.

Estádios superiores: Se o estroma cervical for afectado (FIGO II), pode assumir-se que o risco de envolvimento parametrial é semelhante ao do carcinoma cervical, mas isto não é confirmado pelos dados actuais. Parece que a invasão linfovascular é um melhor indicador da propagação do paramétrio do que a infestação do estroma cervical. Portanto, a histerectomia radical não é necessariamente recomendada para os carcinomas endometriais FIGO II. Se o tumor se espalhou para a vagina e/ou paramétria (FIGO IIIB), é realizada uma histerectomia radical prolongada, com ressecção dos paramétrios e, se necessário, com colpectomia. Em fases incuráveis e avançadas, a intervenção cirúrgica (histerectomia para profilaxia de hemorragias, descascamento de grandes massas tumorais) pode ser considerada num cenário paliativo.
Tratamentos adjuvantes
Radioterapia: A última metanálise Cochrane mostrou que a radioterapia percutânea pós-operatória para cancro endometrial de baixo risco FIGO estágio I não acrescenta benefícios [13]. Mesmo que a radioterapia externa, isto é, percutânea, melhore o controlo local do tumor em risco intermédio e elevado, não pode prolongar a sobrevivência. Devido à menor toxicidade com a mesma eficácia, a braquiterapia vaginal pós-operatória é preferível à radiação externa para o tratamento de carcinoma endometrial precoce com risco intermédio a elevado.
Quimioterapia adjuvante, combinação com radioterapia percutânea: Apenas em fases avançadas do tumor (FIGO III e pacientes cirurgicamente bem tratados com a doença FIGO IV) é indicada a quimioterapia adjuvante com doxorubicina e cisplatina e melhora a sobrevivência em 25% [14]. O ensaio PORTEC-3, que só será concluído dentro de alguns anos, está a testar aleatoriamente a radioterapia percutânea versus a radiochemoterapia em doentes da fase IB com uma constelação de alto risco.
Recidivas e terapias paliativas
As recaídas ocorrem normalmente dentro de três anos. O espectro é amplo e vai desde as recorrências vaginais isoladas, que podem ser novamente tratadas curativamente com terapias locais, até às manifestações disseminadas. Tumores bem diferenciados, recidivas tardias e metástases pulmonares podem ser melhor tratadas, enquanto as recidivas após quimioterapia adjuvante são prognosticadamente desfavoráveis. Existem poucos dados para esta situação em comparação com outros tumores, por exemplo para temsirolimus ou bevacizumab. As terapias com hormonas paliativas são uma alternativa frequentemente utilizada e bem tolerada em doentes oligossintomáticos com tumores bem diferenciados, receptores hormonais positivos. As taxas de resposta atingem ~30% e não raro são de longa duração. É utilizado acetato de medroxiprogesterona (=Farlutal), tamoxifeno, que é ligeiramente menos eficaz mas claramente melhor que os inibidores da aromatase, letrozol ou anastrozol.
Resumo e perspectivas
O carcinoma endometrial é frequentemente diagnosticado numa fase precoce. O diagnóstico pode muitas vezes ser feito sem complicações. É mais difícil ajustar a radicalidade da terapia com o perfil de risco do tumor e também os recursos do paciente.
No futuro, juntamente com a diferenciação molecular, cirurgia minimamente invasiva e linfonodectomia sentinela, cirurgia e terapias adjuvantes poderão ser adaptadas da forma mais ideal possível.
Literatura:
- Weiderpass E, et al: Tendências da mortalidade por cancro do corpus uteri nos estados membros da União Europeia. Eur J Cancer 2014;50: 1675-1684.
- Bjørge T, et. al.: Tamanho corporal em relação ao cancro do corpus uterino em 1 milhão de mulheres norueguesas. Int J Cancer 2007; 120: 378.
- Pecorelli S: Realização revista do FIGO para carcinoma da vulva, cérvix e endométrio. Int J Gynaecol Obstet. 2009;105: 103-104.
- Lewin SN, et al: Desempenho comparativo da Federação internacional de 2009 de ginecologia e obstetrícia do sistema de estadiamento do cancro do corpo uterino. Obstet Gynecol. 2010;116: 1141-1149.
- Cancer Genome Atlas Research N, Kandoth C, et al: Caracterização genómica integrada do carcinoma endometrial. Natureza 2013;497: 67-73.
- Santi A, et al: Laparoscopia ou laparotomia? Uma comparação de 240 pacientes com cancro endometrial em fase inicial. Surg Endosc. 2010;24(4): 939-43
- Benedetti Panici P, et al: Linfadenectomia pélvica sistemática vs. não linfadenectomia no carcinoma endometrial em fase inicial: ensaio clínico aleatório. J Natl Cancer Inst. 2008;100: 1707-1716.
- Grupo de estudo ASTEC, Kitchener H, et al: Eficácia da linfadenectomia pélvica sistemática no cancro endometrial (ensaio MRC ASTEC): um estudo randomizado. Lancet 2009;373: 125-136.
- Todo Y, et al: efeito de sobrevivência da linfadenectomia para-aórtica no cancro endometrial (estudo SEPAL): uma análise de coorte retrospectiva. Lanceta. 2010;375: 1165-1172.
- Kumar S, et al: Avaliação prospectiva da prevalência de metástase pélvica, paraaórtica e de gânglios linfáticos paraaórticos elevados no cancro endometrial. Gynecol Oncol. 2014; 132(1): 38-43.
- Kang S, et.al.: Biópsia dos gânglios linfáticos sentinela em cancro endometrial: meta-análise de 26 estudos. Gynecol Oncol 2011; 123: 522.
- Papadia A, et. al: Mapeamento Laparoscópico do Nódulo Linfático de Sentinela Verde Indocianina em Cancro Endometrial. Ann Surg Oncol. 2016; 2206-2211
- Kong A, et al: Radioterapia adjuvante para o cancro endometrial de fase I. Cochrane Database Syst Rev. 2012;4.
- Galaal K, et al.: Quimioterapia adjuvante para o cancro endometrial avançado. Cochrane Database Syst Rev. 2014;5.
PRÁTICA DO GP 2017; 12(2): 19-24