O tratamento sistémico adjuvante melhora a sobrevivência e a ausência de recidivas no cancro da mama precoce. Os exames genéticos do tumor podem ajudar na escolha da terapia. Os cuidados de apoio também são úteis anos após a conclusão da terapia adjuvante.
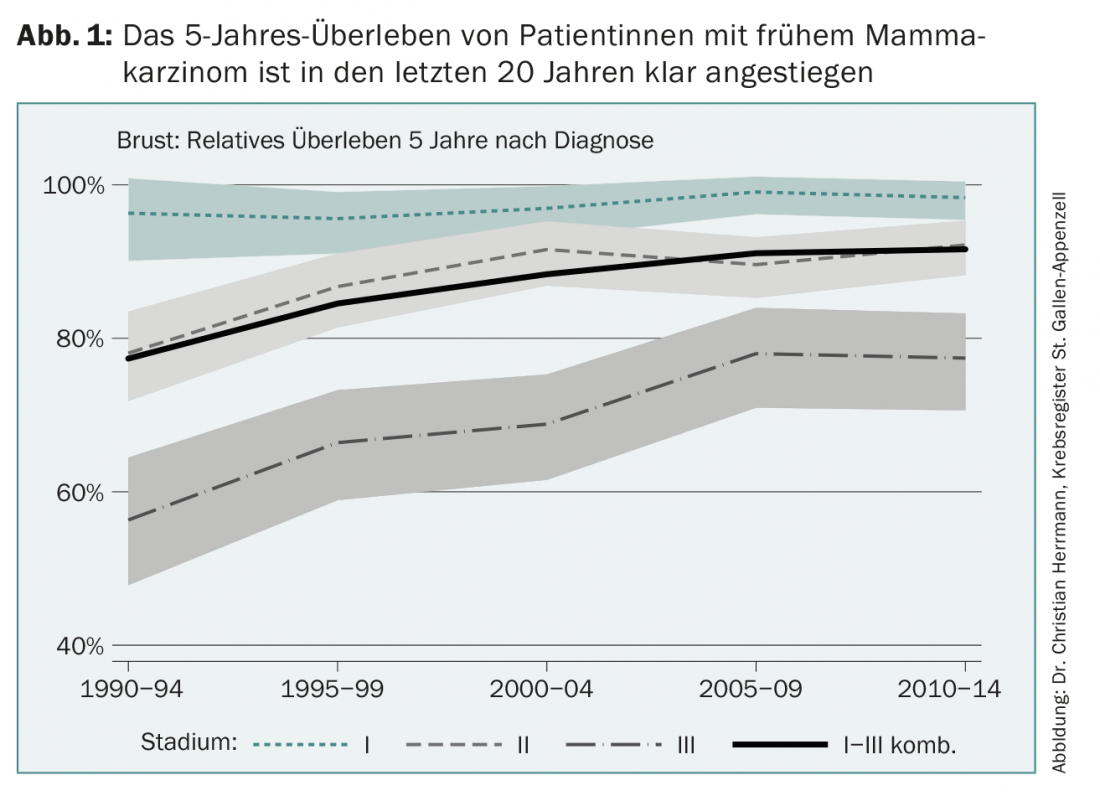
A terapia adjuvante para o cancro da mama precoce fez grandes progressos desde o seu início há pouco mais de 40 anos. Hoje em dia, mais de 80% das mulheres com cancro da mama na Europa podem ser curadas (Fig. 1). Este progresso tem várias causas, tais como uma melhor detecção precoce, programas de mamografia, novas opções cirúrgicas e de radiação, mas também o desenvolvimento contínuo das terapias adicionais do sistema medicamentoso chamadas adjuvantes. Esta história de sucesso é o resultado de ensaios internacionais aleatórios e a sua subsequente implementação na prática clínica diária, um processo que não é de modo algum evidente por si mesmo. Em alguns países asiáticos, por exemplo, a taxa de sobrevivência a longo prazo após o cancro da mama recentemente descoberto é agora apenas de cerca de 40% por várias razões.
As conferências regulares de St. Gallen sobre o tratamento do carcinoma mamário precoce, que são agora realizadas de dois em dois anos, fornecem uma boa ilustração dos desenvolvimentos científicos desde os anos 80. Estes congressos são sempre acompanhados por um consenso de especialistas em cancro da mama de renome internacional, que recebe atenção mundial e é publicado de forma proeminente.
Nas discussões interdisciplinares nos conselhos regulares sobre tumores, são implementadas directrizes reconhecidas no planeamento individualizado e optimizado da terapia, um procedimento institucionalizado nos centros de mama que contribui significativamente para a melhoria dos resultados da terapia.
O 15º Congresso St. Gallen sobre o tema da terapia primária do carcinoma mamário precoce realizou-se pela segunda vez em Viena de 15 a 18 de Março de 2017 e foi realizado sob o lema de planeamento individualizado da terapia. Isto deve ser tão não invasivo quanto possível, mas tão forte quanto necessário (“desescalonamento e escalonamento dos tratamentos para o cancro da mama na fase inicial”). As recomendações de consenso formuladas subsequentemente podem ser lidas nos Anais de Oncologia [1]. Em anos anteriores, a personalização da terapia em adaptação à diferente biologia dos tumores tinha sido apontada. As recomendações gerais devem também ser adaptadas aos valores, desejos e possibilidades individuais dos pacientes em causa, bem como às possibilidades económicas. O Painel observa também no consenso que os ensaios aleatórios não podem fornecer respostas adequadas em todos os casos individuais e a todas as questões clínicas relevantes.
Com o aumento da sobrevivência a longo prazo dos doentes com cancro da mama (“sobreviventes”), outros aspectos estão a ganhar importância, por exemplo, as consequências a longo prazo das terapias e questões sociais como a reintegração profissional.
Se e que terapia adicional do sistema é possível e útil depende principalmente da biologia do carcinoma, mas também do estadiamento, e portanto da probabilidade de recidiva ou metástase.
Diferentes tipos de carcinomas mamários são distinguidos com base na biologia molecular, uma classificação que pode, contudo, ser feita de forma semelhante na prática, de acordo com recomendações de consenso anteriores, utilizando métodos imunohistoquímicos amplamente disponíveis [2]. Estes subtipos são chamados Luminal A, Luminal B, HER 2-positivo e tripel-negativo e mostram comportamentos diferentes com recomendações terapêuticas correspondentes.
Terapias de base hormonal
No caso de receptores de estrogénio detectados imunohistoquimicamente em células tumorais, recomenda-se a terapia hormonal adjuvante, no caso de tumores A luminal, muitas vezes como terapia única do sistema ou também para além da quimioterapia, dependendo da constelação. Mesmo uma baixa expressão de receptores de estrogénio é suficiente para esta indicação.
Nas mulheres na pós-menopausa, um dos inibidores da aromatase letrozol, anastrozol ou exemestano é preferível ao tamoxifeno devido a uma eficácia ligeiramente melhor. Em caso de problemas de tolerância ou comorbidades, o tamoxifen pode ser utilizado como alternativa devido aos diferentes perfis de efeitos secundários, especialmente se o risco de recorrência for menor.
Os ensaios clínicos mostraram que dez anos de terapia hormonal adjuvante, seja com tamoxifen [3], um inibidor da aromatase [4] ou uma sequência, é ligeiramente superior a um período de tratamento de cinco anos, o que tem sido a norma. Esta maior duração da terapia é de significado clínico especialmente para as mulheres com risco acrescido de recaída.
Nas mulheres em pré-menopausa, a monoterapia com tamoxifen continua a ser uma boa opção de tratamento reconhecida. A terapia adicional de agonista LHRH ou um inibidor de aromatase e agonista de LHRH são ligeiramente mais eficazes – como mostraram os ensaios aleatórios – mas estão associados a efeitos secundários consideravelmente mais graves [5]. Isto é geralmente justificado em casos de maior risco de recorrência, tais como em mulheres com menos de 35 anos de idade, em tumores com menor grau de diferenciação e em casos de envolvimento de pelo menos quatro gânglios linfáticos axilares; situações que geralmente também levaram à escolha de quimioterapia adjuvante adicional.
Quimioterapia para carcinoma mamário receptor-positivo
A quimioterapia adjuvante adicional para tumores receptores positivos é indicada quando o risco de recaída é maior; geralmente já é este o caso para o tipo Luminal B.
O risco de recorrência pode ser deduzido da biologia e depende também da fase do tumor, especialmente do número de gânglios linfáticos axilares afectados. Factores importantes são o grau de diferenciação e a taxa de proliferação, que pode ser medida imuno-histoquímica com o marcador Ki-67. A padronização e reprodutibilidade deste factor quantitativo foi um desafio para os patologistas.
Um parâmetro de prognóstico adicional interessante é o grau de infiltração do tumor pelos linfócitos. Um número mais elevado de TILs (linfócitos infiltrantes tumorais) indica uma resposta imunitária antitumoral mais pronunciada e está associado a um melhor prognóstico. Contudo, este factor não está actualmente suficientemente normalizado para ser utilizado nas decisões terapêuticas de rotina.
Há também possibilidades baseadas na Internet para obter uma indicação de prognóstico com um algoritmo baseado em dados clínicos/patológicos, que pode ser uma ajuda no aconselhamento de pacientes (www.adjuvantonline.com ou Predict www.predict.nhs.uk). Este último algoritmo também tem em conta o nível de proliferação Ki-67 e o estatuto HER 2.
Testes genéticos validados e reprodutíveis sobre material tumoral podem influenciar ainda mais a decisão a favor ou contra a quimioterapia adjuvante adicional. Isto aplica-se em particular aos carcinomas mamários receptor-positivos sem ou apenas com envolvimento limitado de gânglios linfáticos axilares se o resultado do teste indicar um prognóstico muito bom e, portanto, permitir que se dispense quimioterapia adicional. Existem vários testes concorrentes estabelecidos à disposição dos clínicos, tais como Oncotype®, Endopredict® ou Mammaprint®. A utilização de tais testes nestas situações é explicitamente apoiada pelo Consenso de St Gallen.
Tumores HER 2-positivos
Um ano de tratamento com trastuzumab, actualmente também disponível sob forma subcutânea, para além da quimioterapia e possivelmente da terapia anti-hormonal, melhora substancialmente a sobrevivência sem recaídas. A quimioterapia pode ser uma terapia com antraciclina e contendo taxanos; para pequenos tumores com menor risco de recorrência, esta também pode ser limitada apenas aos taxanos.
Na situação pré-operatória, a administração combinada dos anticorpos anti-HER-2 trastuzumab e pertuzumab pode também melhorar substancialmente a resposta [6]. Isto também sugeriu o uso de adjuvantes no pós-operatório. Os dados ansiosamente esperados dos ensaios Aphinity foram apresentados no Congresso ASCO de 2017 e mostraram uma melhoria estatisticamente significativa em termos de ausência de recorrência, mas em termos absolutos num pequeno intervalo de 1% [7]. Este tratamento adicional dispendioso trará provavelmente apenas um benefício adicional clinicamente relevante na situação adjuvante num grupo restrito de pacientes com um risco acrescido de recaída.
Carcinomas triplo-negativos
Estes tumores sem expressão dos receptores de estrogénio e progesterona e sem sobreexpressão dos receptores HER 2 são biologicamente um grupo heterogéneo. Se for escolhida terapia adjuvante, só é considerada quimioterapia, geralmente uma combinação de antraciclinas/alquilantes e taxanos.
Os carcinomas mamários com mutações BRCA 1 ou 2 são frequentes, mas de forma alguma são sempre carcinomas tri-negativos. Para estes pacientes, a quimioterapia contendo platina pode ser escolhida. Fora dos ensaios actualmente em curso, o uso de inibidores PARP não se encontra (ainda?) justificado nesta situação.
Terapias neoadjuvantes
Embora não haja vantagem de sobrevivência se for realizada uma terapia de sistema necessária antes da cirurgia para o carcinoma da mama (ou seja, neoadjuvante). No entanto, a operação deve então cobrir apenas a área residual do tumor, ou seja, não a extensão original do tumor. Se um exame de nó sentinela realizado após quimioterapia mostrar que não há envolvimento de tumor, pode ser evitada uma excisão axilar. A vantagem do tratamento neoadjuvante é, portanto, a possibilidade de uma terapia cirúrgica menos invasiva, que pode mesmo ser realizada com a conservação dos seios, apesar de um tumor inicialmente grande.
A terapia neoadjuvante também dá tempo para o planeamento cirúrgico, que pode ser importante para mulheres com suspeitas de mutações BRCA, a fim de realizar aconselhamento genético e análise genética e, subsequentemente, discutir a opção de mastectomia, possivelmente até bilateralmente.
O consenso recomenda terapias neoadjuvantes para carcinomas mamários HER 2-positivos e tri-negativos.
Terapias anti-ressortivas
Com base nos estudos austríacos que afirmam que o zoledronato ou denosumabe não só protege contra a osteoporose mas também reduz o risco de recaída [8,9], o painel de consenso aceitou que o tratamento adicional com bisfosfonatos (ainda não denosumabe) foi indicado no estado hormonal pós-menopausa.
Terapias de apoio
Muitos pacientes são muito receptivos às recomendações dietéticas. É motivador poder contribuir para a recuperação numa área que é geralmente objecto de muita discussão e manter o controlo sobre o tratamento, pelo menos em algumas áreas. Embora não exista uma dieta real que os doentes esperem que tenha um efeito sobre um tumor existente, o aconselhamento nutricional é útil. Tanto a quimioterapia como os tratamentos (anti)hormonais podem ocasionalmente causar um acentuado aumento de peso. O aconselhamento proactivo é portanto útil por este motivo, incluindo informação equilibrada de que uma dieta sem açúcar, lactose ou glúten é uma medida não comprovada no tratamento do cancro. Contudo, a obesidade tem uma eficácia comprovada no desenvolvimento do cancro e os doentes com cancro da mama sem obesidade podem esperar uma mortalidade mais baixa [10] e uma taxa de recorrência.
Um aspecto importante adicional é o exercício físico suficiente. Há dados crescentes de que a actividade física pode reduzir a taxa de recidiva [11]. Deve ser feita uma orientação adequada e referências a ofertas regionais.
Em 2010, já existiam quase 300.000 chamados “sobreviventes” de vários tipos de tumores na Suíça, dos quais o cancro da mama é o grupo mais importante [12]. Devido aos números continuamente crescentes, existirão hoje cerca de 350 000. Existem programas especiais, de acordo com a Krebsliga Ostschweiz (Liga do Cancro da Suíça Oriental), que aconselham as mulheres nestas áreas após terem completado o tratamento de tumores. Outro serviço importante é o apoio psico-oncológico. É também importante prevenir activamente a osteoporose, especialmente ao tomar inibidores da aromatase (determinação da densidade óssea, ingestão suficiente de cálcio e vitamina D, se necessário também de Prolia®).
Após tratamento adjuvante intensivo, um número considerável de pacientes sofre frequentemente de sintomas de fadiga de longa duração, bem como de concentração reduzida, dificuldade em encontrar palavras e esquecimento (“cérebro quimio”). Estas queixas não devem ser simplesmente rejeitadas como psicogénicas. Existem provas que apontam para alterações orgânicas e mensuráveis no cérebro e que demonstraram que os processos inflamatórios no cérebro são causais [13].
Perspectivas
Outros novos medicamentos encontrarão o seu caminho para a terapia adjuvante, possivelmente inibidores da quinase 4 e 6 dependentes da ciclina (palbociclib) e inibidores PARP em pacientes com mutações BRCA. O tratamento de doentes com neratinibe a seguir ao trastuzumabe em carcinomas HER 2 positivos resultou numa taxa de recidiva mais baixa [14]. Uma possível esperança para os carcinomas mamários tripel-negativos são as novas imunoterapias.
Com as modernas terapias neoadjuvantes para o cancro da mama HER 2-positivo, pode ser observada uma resposta completa sem tumor residual na cirurgia em mais de metade das situações. Se a cirurgia pode ser totalmente dispensada em tais situações será objecto de ensaios clínicos. Neste caso, a terapia medicamentosa já não seria adjuvante, mas a principal terapia para o carcinoma mamário precoce.
Mensagens Take-Home
- O tratamento sistémico adjuvante melhora significativamente a sobrevivência e a ausência de recidivas no cancro da mama precoce.
- Uma equipa de tratamento interdisciplinar com quadros regulares de tumores é um factor importante para a recomendação terapêutica óptima.
- Os exames genéticos do tumor podem ajudar na escolha da terapia adjuvante ou levar a uma omissão de quimioterapia.
- Os cuidados de apoio mesmo anos após a conclusão da terapia adjuvante são uma parte importante do tratamento (“programa de sobrevivência”).
Literatura:
- Curigliano G, et al: De-escalating and Escalating Treatments for Early Stage Breast Cancer: The St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Annals of Oncology 2017; 28(8): 1700-1712.
- Goldhirsch A, et al: Strategies for subtypes – dealing with the diversity of breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011; 22(8): 1736-1747.
- Davies C, et al: Efeitos a longo prazo da continuação do tamoxifeno adjuvante a 10 anos versus paragem aos 5 anos após o diagnóstico de cancro da mama receptor de estrogénio positivo: ATLAS, um ensaio aleatório. Lancet 2013; 381(9869): 805-816.
- Goss PE, et al: Prolongamento da terapia adjuvante de Aromatase-Inhibitor para 10 anos. N Engl J Med 2016; 375(3): 209-219.
- Pagani O, et al: Adjuvante isento com supressão ovariana no cancro da mama na pré-menopausa. N Engl J Med 2014; 371: 107-118.
- Gianni L, et al: análise de 5 anos de neoadjuvant pertuzumab e trastuzumab em doentes com cancro da mama HER2-positivo (NeoSphere) localmente avançado, inflamatório, ou em fase inicial: um ensaio aleatório de fase 2 multicêntrico, aberto. Lancet Oncol 2016; 17(6): 791-800.
- von Minckwitz G, et al: Adjuvant pertuzumab e trastuzumab no início do cancro da mama HER2-positivo. N Engl J Med 2017; 377: 122-131.
- Gnant M, et al: Zoledronic acid combined with adjuvant endocrine therapy of tamoxifen versus anastrozole plus ovarian function suppression in premenopausal early breast cancer: final analysis of the Austrian Breast and Colorectal Cancer Study Group Trial 12. Ann Oncol 2015; 26: 313-320.
- Gnant M, et al: Adjuvant denosumab no cancro da mama (ABCSG-18): um ensaio multicêntrico, aleatório, duplo-cego, controlado por placebo. Lancet 2015; 386: 433-443.
- Chan DS, et al: Body mass index and survival in women with breast cancer – systematic literature review and meta-analysis of 82 follow-up studies. Annals Oncology 2014; 25(10): 1901-1914.
- Dieli-Conwright CM: Reduzir o risco de recorrência do cancro da mama: uma Avaliação dos Efeitos e Mecanismos da Dieta e do Exercício. Currast Breast Cancer Rep 2016; 8(3): 139-150.
- Herrmann C: Sobreviventes de cancro na Suíça: uma população em rápido crescimento para cuidar. BMC Cancer 2013; 13: 287.
- Morant R: Deficiência cognitiva associada à quimioterapia. Informação @ oncologia 2016; 6: 14-17.
- Chan A, et al: Neratinibe após terapia adjuvante baseada em trastuzumab em doentes com cancro da mama HER2-positivo (ExteNET): um ensaio multicêntrico, aleatório, duplo-cego, controlado por pl acebo, fase 3. Lancet Oncology 2016; 17: 367-377.
InFo ONCOLOGy & HEMATOLOGy 2017; 5(4): 10-13