Os distúrbios respiratórios do sono são atualmente um fator de risco cardíaco reconhecido. Pode desencadear não só doenças circulatórias como a hipertensão e a insuficiência cardíaca, mas também a fibrilhação auricular. Por isso, passa muitas vezes despercebida e compromete insidiosamente o prognóstico dos doentes.
Nos últimos anos, a apneia obstrutiva do sono (AOS) tem-se revelado uma doença comum nos adultos. Caracteriza-se por apneias repetidas e hipoxia causada pelo colapso da via aérea superior durante o sono, apesar do esforço respiratório do diafragma. Cinco ou mais apneias por hora de sono são geralmente consideradas anormais, os doentes gravemente afectados têm várias centenas de apneias por noite. A maioria das apneias e hipopneias termina com um despertar temporário do sono e subsequente hiperventilação.
Hipertensão arterial e apneia do sono
A pressão arterial nocturna está elevada nos doentes com AOS, e há cada vez mais provas de que a AOS é também um fator de risco independente para a hipertensão arterial durante o dia. Embora os mecanismos exactos ainda não sejam claros, pensa-se que a elevação persistente do tónus simpático causada pela hipóxia crónica repetitiva e pela excitação são os mecanismos chave para as elevações da pressão arterial a curto e longo prazo na AOS.
A pressão positiva contínua nasal nas vias aéreas (nCPAP) tornou-se o tratamento padrão para a AOS e demonstrou reduzir os sintomas e melhorar a qualidade de vida dos doentes com AOS. No entanto, os ensaios controlados não mostraram qualquer efeito ou mostraram apenas uma pequena redução da pressão arterial de 1,4 ou 2,5 mm Hg. A eficácia deste tratamento nas sequelas cardiovasculares em doentes com AOS tem sido questionada de uma forma geral, explica o Dr. Jan Börgel, Diretor do Departamento de Saúde da Universidade de Lisboa. Dr. Jan Börgel, St. Barbara Clinic Heessen Internal Medicine Hamm, Alemanha [1].
Efeito anti-hipertensivo da terapia CPAP
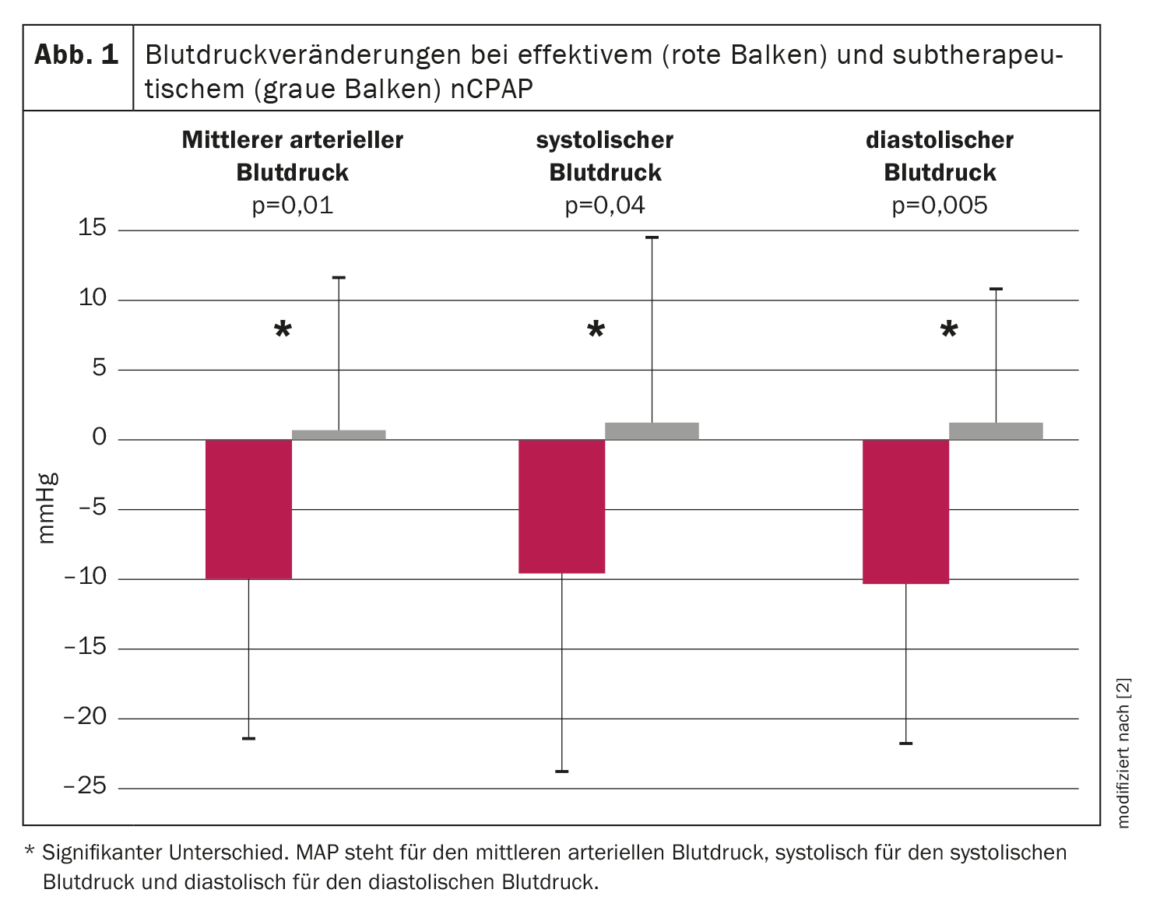
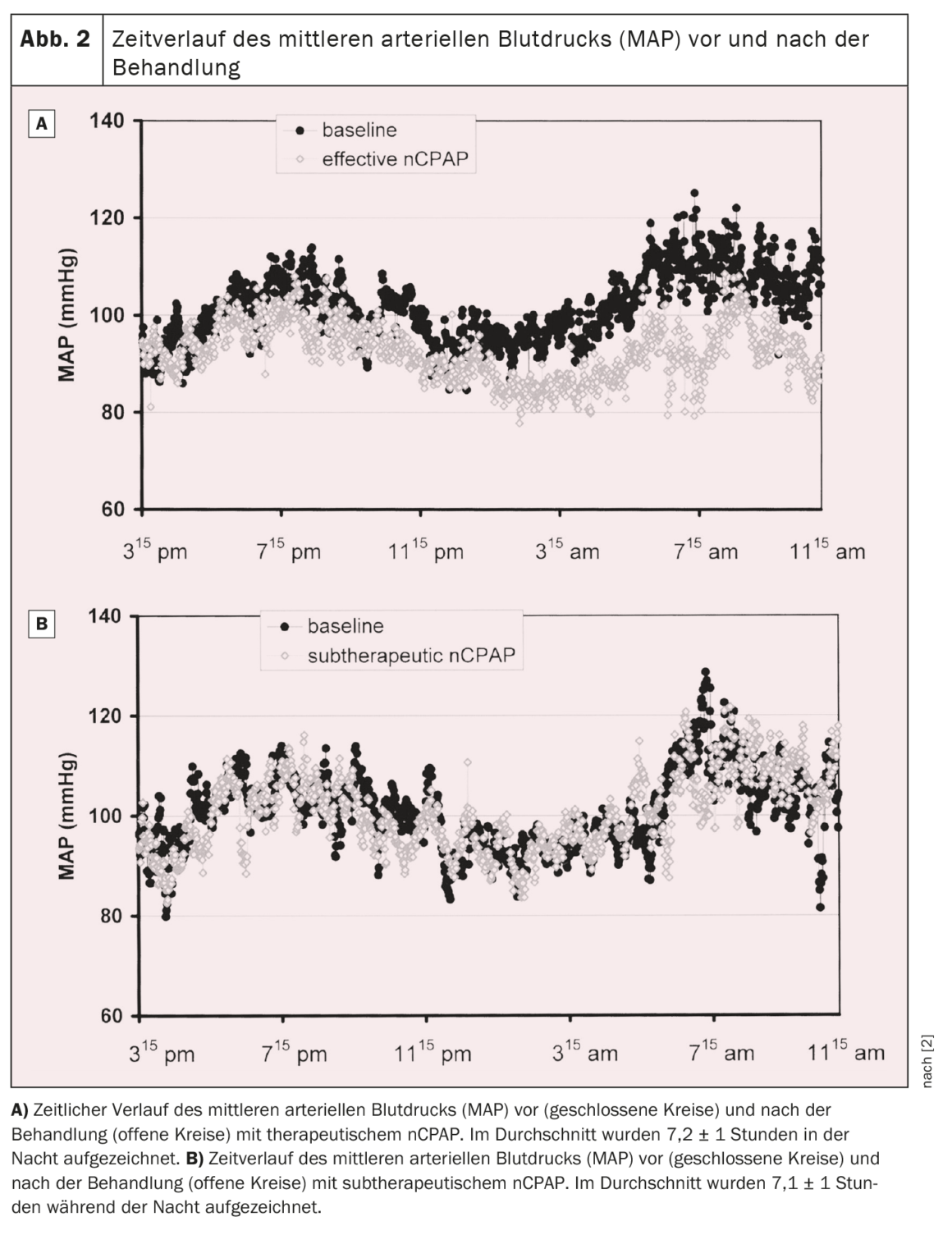
Por conseguinte, foi realizado um ensaio prospetivo aleatório para investigar o efeito do nCPAP na pressão arterial em doentes com AOS. Um total de 60 doentes consecutivos com AOS moderada a grave foi aleatoriamente atribuído a um tratamento eficaz ou subterapêutico com nCPAP durante uma média de nove semanas. A polissonografia nocturna e o registo contínuo da pressão arterial não invasiva durante 19 horas foram realizados antes e durante o tratamento. As apneias e hipopneias foram reduzidas em ≈95% e 50% nos grupos terapêutico e subterapêutico, respetivamente. A pressão arterial média diminuiu em 9,9 ± 11,4 mm Hg no grupo nCPAP terapêutico e aumentou em 0,6 ± 10,8 mm Hg no grupo nCPAP subterapêutico durante o período de registo de 19,1 ± 1,3 horas (p=0,01, interação ANOVA tempo por grupo). A pressão arterial diastólica e sistólica também diminuiu significativamente sob nCPAP terapêutico em 10,3 ± 11,4 mm Hg e 9,5 ± 15,0 mmHg, respetivamente (p<0,005 ou p=0,04, ANOVA interação tempo por grupo) em comparação com o nCPAP subterapêutico (fig. 1) . A diminuição da pressão arterial média sob nCPAP eficaz foi observada tanto durante o dia (-10,0 ± 12,1 mmHg) quanto à noite (-10,3 ± 15,3 mmHg). A evolução temporal da pressão arterial média antes e durante o tratamento para ambos os grupos é apresentada na figura 2 [2]. No grupo com tratamento eficaz, a pressão arterial média diminuiu durante todo o período de registo, com a maior diminuição a ocorrer à noite e de manhã até por volta do meio-dia. À tarde e à noite, a descida da tensão arterial continua presente, mas menos acentuada do que à noite e na primeira metade do dia [2].
Uma meta-análise de ensaios clínicos aleatorizados (RCT) continuou a quantificar o tamanho do efeito da redução da pressão arterial com a terapia CPAP em comparação com outros tratamentos passivos (CPAP simulado, comprimidos de placebo, medidas conservadoras) ou activos (deglutição, medicação anti-hipertensiva). Dos 1599 artigos, foram incluídos 31 ensaios clínicos aleatórios que compararam o CPAP com o tratamento passivo ou ativo. Na análise de efeitos aleatórios, em comparação com o tratamento passivo (29 ECRs, 1820 indivíduos), foi encontrada uma diferença líquida média ± SEM na pressão arterial sistólica de 2,6 ± 0,6 mmHg e na pressão arterial diastólica de 2,0 ± 0,4 mmHg, favorecendo o tratamento com CPAP (p<0,001). Nos estudos com monitorização ambulatória da pressão arterial de 24 horas que apresentaram dados relativos aos períodos diurno e noturno, a diferença média da pressão arterial sistólica e diastólica foi de 2,2 ± 0,7 e 1,9 ± 0,6 mmHg, respetivamente, durante o dia e de 3,8 ± 0,8 e 1,8 ± 0,6 mmHg, respetivamente, durante a noite. Na análise de regressão, um índice de apneia/hipopneia mais elevado na linha de base foi associado a uma maior diminuição líquida média da pressão arterial sistólica (β ± SE, 0,08 ± 0,04). Os resultados mostraram que a terapia com CPAP reduz significativamente a pressão arterial em pacientes com AOS, mas com um tamanho de efeito pequeno. Os doentes com episódios frequentes de apneia são os que mais beneficiam da terapêutica [3].
Outro estudo analisou o efeito do CPAP na pressão arterial (PA) em pacientes com AOS e hipertensão resistente. Foram incluídos ensaios clínicos randomizados que investigaram o efeito do CPAP na pressão arterial em pacientes com AOS e hipertensão resistente e que foram indexados na MEDLINE, Embase e na Biblioteca Cochrane desde o início até 20 de março de 2015. Foi identificado um total de cinco ensaios clínicos aleatórios que cumpriam os critérios de inclusão. As alterações combinadas após o tratamento com CPAP para a pressão arterial sistólica e diastólica (PAD) ambulatória de 24 horas foram de -4,78 mm Hg (intervalo de confiança de 95% [CI], -7,95 a -1,61) e -2,95 mmHg (IC 95%, -5,37 a -0,53) a favor do grupo CPAP. O CPAP também foi associado a uma redução da PAD nocturna (diferença média, -1,53 mmHg, IC 95%, -3,07-0). Estes resultados sugerem uma redução favorável da pressão arterial com o tratamento com CPAP em pacientes com AOS e hipertensão resistente [4].
O stress hipóxico prediz a mortalidade relacionada com a DCV
Até à data, o impacto da AOS nos eventos fatais de DCV continua a ser controverso, uma vez que as associações entre a exposição e o resultado têm sido inconsistentes. Evidências recentes sugerem que não há associação entre a terapia com pressão positiva nas vias aéreas e a prevenção secundária de DCV.
Até à data, a medicina do sono tem-se baseado na quantificação da frequência de apneias e hipopneias observadas durante o sono (índice de apneia-hipopneia, IAH) para diagnosticar a AOS e determinar a sua gravidade. Com base nestas métricas, verificou-se que a AOS prediz modestamente a mortalidade, mas os resultados limitaram-se em grande medida a homens jovens e de meia-idade. Tem sido questionado se o IAH capta os aspectos mais importantes da AOS que afectam negativamente o sistema cardiovascular. A apneia obstrutiva do sono é uma doença em que a obstrução repetida das vias respiratórias prejudica a ventilação e conduz a uma perturbação dos níveis de gases no sangue. Por conseguinte, o IAH, que é uma simples contagem de episódios obstrutivos por hora de sono, sem ter em conta a duração e a profundidade da perturbação ventilatória ou as alterações dos gases sanguíneos, não constitui uma descrição completa das perturbações fisiológicas. Vários estudos observacionais demonstraram que as medidas de hipoxemia nocturna, como a percentagem de tempo durante o sono com saturação de oxigénio inferior a 90% (TST90), são melhores preditores de DCV e de mortalidade por todas as causas do que o IAH. No entanto, o TST90 e medidas semelhantes caracterizam não só a hipoxemia intermitente secundária a eventos obstrutivos, mas também a hipoxemia persistente, por exemplo, devido à doença pulmonar obstrutiva crónica (DPOC) ou à hipoventilação na obesidade, que não está relacionada com a obstrução das vias aéreas superiores e a AOS.
Por conseguinte, um estudo procurou desenvolver uma medida da gravidade da AOS que quantificasse a hipoxemia relacionada com a AOS, a qual, segundo a hipótese, poderia prever de forma significativa a mortalidade relacionada com a DCV após o ajustamento para os índices de polissonografia (PSG) medidos por rotina. Por conseguinte, foi desenvolvida uma medida para captar a frequência, a duração e a profundidade da contribuição dos eventos respiratórios para a hipoxemia arterial, especificamente a “área sob a curva” da dessaturação de oxigénio associada a apneias e hipopneias individuais – a “carga hipóxica” específica da AOS.
As amostras provêm de dois estudos de coorte: o Resultados das perturbações do sono em homens idosos (MrOS), em que participaram 2743 homens com 76,3 ± 5,5 anos de idade, e o Estudo do sono e da saúde do coração (SHHS), que incluiu 5111 adultos de meia-idade e idosos (52,8% mulheres) com 63,7 ± 10,9 anos de idade. Os resultados incluíram mortalidade por todas as causas e mortalidade relacionada com doenças cardiovasculares (DCV). O stress da hipóxia foi determinado medindo a área sob a curva de saturação final em comparação com a situação de base antes do evento. Foram utilizados modelos de Cox para calcular os rácios de risco ajustados para o stress hipóxico. Ao contrário do IAH, o “stress hipóxico” previu fortemente a mortalidade por DCV e por todas as causas (apenas MrOS). Os indivíduos no estudo MrOS com exposição à hipoxia nos dois quintis mais elevados tinham rácios de risco de 1,81 [intervalo de confiança (IC) de 95% 1,25-2,62] e 2,73 (IC de 95% 1,71-4,36), respetivamente. Da mesma forma, o grupo no SHHS com “stress hipóxico” no quintil mais elevado tinha um rácio de risco de 1,96 (IC 95% 1,11-3,43). A “carga hipóxica”, um sinal facilmente derivado do estudo do sono noturno, prevê assim a mortalidade por DCV em diferentes populações. Os resultados sugerem que não só a frequência, mas também a profundidade e a duração da obstrução das vias aéreas superiores relacionada com o sono são factores importantes para caraterizar a doença [5].
O fenótipo de sonolência excessiva foi identificado como um fator de previsão de novos eventos cardiovasculares e de eventos cardiovasculares recorrentes, mas não de mortalidade cardiovascular. No entanto, mesmo em ensaios clínicos que se centraram em participantes com sintomas mínimos ou sem sonolência, foram encontrados benefícios limitados do tratamento da AOS na pressão arterial e nos resultados cardiovasculares [6].
Redução da pressão arterial – Estado do Dipper na AOS/hipertensão não tratada
Uma análise post-hoc investigou o efeito do CPAP na pressão arterial, tendo em conta o padrão circadiano da pressão arterial em doentes hipertensos não tratados. Os sujeitos foram classificados de acordo com o rácio de imersão (imersão/não imersão). Foram incluídos na análise 272 doentes hipertensos (113 mergulhadores e 159 não mergulhadores). As variáveis clínicas e polissonográficas de base foram semelhantes nos dois grupos. O tratamento com CPAP de doentes não mergulhadores foi associado a uma redução das variáveis da pressão arterial ambulatória de 24 horas e das medições da pressão arterial ambulatória nocturna. No entanto, verificou-se um efeito não significativo no grupo dos mergulhadores. Os efeitos diferenciais do CPAP entre os grupos foram -2,99 mmHg (IC 95% -5,92 a -0,06 mmHg) para a pressão arterial ambulatória média de 24 horas e -5,35 mmHg (IC 95% -9,01 a -1,69 mmHg) para a pressão arterial ambulatória média nocturna. Os resultados mostram um efeito diferencial do tratamento com CPAP na pressão arterial em pacientes hipertensos, dependendo do padrão circadiano. De acordo com este estudo, apenas os doentes não mergulhadores beneficiaram do tratamento com CPAP em termos de redução da pressão arterial [7].
Fibrilhação auricular e apneia do sono
A AOS não causa apenas hipoxemia, hipercapnia, disfunção autonómica, agitação e alterações significativas da pressão intratorácica negativa, explica o Prof. Dr. Anil-Martin Sinha, Sana Klinikum Hof GmbH Clinic for Cardiology, Nephrology, Pneumology and Internal Intensive Care Medicine Hof, Alemanha [8], a fisiopatologia da AOS também conduz a inflamação, disfunção endotelial, coagulação desequilibrada, alterações hemodinâmicas, remodelação eléctrica/estrutural das aurículas/ventrículos e desregulação autonómica. Estes factores estão associados ao desenvolvimento e manutenção da fibrilhação auricular. Assim, a fisiopatologia da AOS é multifatorial, e muitos mecanismos complexos ainda não resolvidos estão envolvidos no desenvolvimento da FA, com implicações agudas e de longo prazo para os substratos arritmogênicos [9].
Expressão de GJA1 e remodelação da aurícula esquerda
Estudos demonstraram que os genes que controlam a inflamação, as junções comunicantes e a fibrose auricular estão ligados ao mecanismo fisiopatológico da fibrilhação auricular. A proteína conexina-43 é codificada no ser humano pelo gene GJA1 do cromossoma 6 e é expressa por cardiomiócitos auriculares e ventriculares, células musculares lisas vasculares, células endoteliais, monócitos e macrófagos. A continuidade eléctrica do miocárdio é mantida por conexinas localizadas em junções de hiato que mantêm o acoplamento intercelular de baixa resistência. As diferenças na expressão da conexina-43 conduzem a uma condução descontínua inconsistente e a arritmias cardíacas. Os exossomas, vesículas ligadas à membrana com 40-100 nm de diâmetro, são libertados por muitos tipos de células, como as células sanguíneas, as células endoteliais, as células imunitárias, as plaquetas e as células musculares lisas, e estão presentes em quase todos os fluidos biológicos. Os ARN dos exossomas podem ser absorvidos por células vizinhas ou distantes quando os exossomas circulam e, subsequentemente, modulam as células receptoras. A descoberta da sua função no intercâmbio genético entre as células fez com que os exossomas recebessem uma atenção crescente.
Foi realizado um estudo para investigar os preditores da ocorrência de FA em pacientes com SAOS e os efeitos dos exossomos de pacientes com SAOS com e sem FA na expressão de GJA1 e outros genes inflamatórios e de fibrose envolvidos na fisiopatologia da FA em células HL-1 para esclarecer sua associação com a ocorrência de FA. O estudo forneceu várias conclusões importantes. Em primeiro lugar, os doentes com SAOS com FA tinham mais diabetes mellitus, menor eficiência do sono, menor FEVE e uma aurícula esquerda (AE) maior do que os doentes com SAOS sem FA. Segundo, o tamanho do átrio esquerdo foi o preditor mais significativo da ocorrência de FA em pacientes com SAOS, com um valor de corte de 38,5 mm. Em terceiro lugar, a expressão do gene mRNA do GJA1 foi menor e o TNF-α foi maior nas células HL-1 incubadas com exossomas de pacientes com SAOS com FA do que naquelas incubadas com exossomas de pacientes com SAOS sem FA. Após o controlo da idade e do sexo, a expressão genética do GJA1 foi ainda mais baixa nas células HL-1 incubadas com exossomas de doentes com SAOS e FA. Finalmente, a expressão do gene GJA1 foi negativamente correlacionada com o IAH e o índice de dessaturação de oxigénio em doentes com SAOS e FA, especialmente durante a fase não-REM [10].
Prevalência de apneia do sono não diagnosticada na fibrilhação auricular
O objetivo de outro estudo foi determinar a proporção de doentes com fibrilhação auricular (FA) que também tinham apneia do sono não diagnosticada e investigar o impacto deste diagnóstico na adesão à terapêutica da apneia do sono. O estudo prospetivo incluiu 188 doentes consecutivos com fibrilhação auricular sem um diagnóstico prévio de apneia do sono que foram programados para ablação de fibrilhação auricular. O teste de apneia do sono em casa foi positivo em 155 de 188 doentes (82,4%); destes 155, 127 (82%) tinham um componente predominantemente obstrutivo e 28 (18%) tinham apneia do sono mista com um componente central de 15,2 ± 7,4%. A gravidade da apneia do sono foi ligeira em 43,8%, moderada em 32,9% e grave em 23,2%. A sensibilidade e a especificidade do questionário STOP-BANG foram de 81,2% e 42,4%, respetivamente. Numa análise multivariada, o STOP-BANG não foi preditivo de apneia do sono (odds ratio: 0,54; intervalo de confiança de 95%: 0,17-1,76; p=0,31). A terapêutica com ventilador de pressão positiva contínua nas vias aéreas foi iniciada em 73 dos 85 doentes (85,9%) com apneia do sono moderada ou grave, e 68 dos 73 doentes (93,1%) permaneceram sem sintomas após um seguimento médio de 21 ± 6,2 meses. Assim, a apneia do sono é extremamente comum em pacientes com FA encaminhados para ablação, uma grande proporção dos quais não é diagnosticada porque o poder preditivo dos sintomas de apneia do sono neste grupo de pacientes com FA é limitado. O rastreio da apneia do sono resultou numa elevada taxa de pacientes que aderiram à pressão positiva contínua nas vias respiratórias a longo prazo [11].
Efeitos do CPAP no substrato da fibrilhação auricular
O estudo SLEEP-AF investigou como o tratamento da AOS afecta o substrato auricular na FA. Para isso, foram recrutados 24 pacientes consecutivos com pelo menos AOS moderada (IAH ≥15) encaminhados para tratamento de FA. Os participantes foram aleatorizados 1:1 para receberem pressão positiva contínua nas vias respiratórias (CPAP) ou nenhuma terapia (n=12 com CPAP; n=12 sem CPAP). Todos os participantes foram submetidos a um exame eletrofisiológico invasivo (mapeamento de alta densidade da aurícula direita) na fase inicial e após pelo menos seis meses. As variáveis de resultado foram: voltagem atrial (mV), velocidade de condução (m/s), área atrial <0,5 mV (%), porcentagem de pontos complexos (%) e período refratário atrial efetivo (ms). As características clínicas e os parâmetros electrofisiológicos eram semelhantes nos dois grupos no início do estudo. A adesão à terapia com CPAP foi elevada (utilização do dispositivo: 79% ± 19%; utilização média/dia: 268 ± 91 min) e resultou numa redução significativa do IAH (redução média: 31 ± 23 eventos/h). Não se registaram diferenças entre os grupos na pressão arterial e no índice de massa corporal ao longo do tempo. No seguimento, o grupo CPAP apresentava uma velocidade de condução mais elevada (0,86 ± 0,16 m/s vs. 0,69 ± 0,12 m/s; p (tempo × grupo) = 0,034), tensões significativamente mais elevadas (2,30 ± 0,57 mV vs. 1,94 ± 0,72 mV; p<0,05) e uma menor proporção de pontos complexos (8,8% ± 3,61% vs. 11,93% ± 4,94%; p=0,011) em comparação com o grupo de controlo. A terapia com CPAP também tendeu a resultar em uma menor proporção de área de superfície atrial <0,5 mV (1,04% ± 1,41% vs. 4,80% ± 5,12%; p=0,065). Os resultados mostram que a terapia com CPAP leva à reversão da remodelação atrial na FA e fornece evidências mecanicistas a favor do tratamento da AOS na FA [12].
Relação entre apneia do sono detectada por CDI e fibrilhação auricular
O Índice de Perturbação Respiratória (IDR) calculado por um algoritmo de cardioversor desfibrilhador implantável (CDI) permite a deteção precisa de apneia do sono (SA) grave. Um estudo recente testou agora se o RDI também pode prever o peso da fibrilhação auricular. Foi tida em conta a média semanal da RDI calculada durante todo o período de acompanhamento e durante o período de uma semana antes do estudo do sono. A fibrilhação auricular grave (RDI ≥30 episódios/h) foi diagnosticada em 92 (56%) doentes aquando do estudo do sono. Durante o seguimento, foi documentada uma carga de FA ≥5 minutos/dia em 70 (43%), ≥6 horas/dia em 48 (29%) e ≥23 horas/dia em 33 (20%) doentes. O RDI registado pelo dispositivo ≥30 episódios/h no momento da poligrafia e o índice de apneia-hipopneia ≥30 episódios/h medido com a poligrafia não foram associados à ocorrência dos parâmetros utilizando um modelo de regressão de Cox. No entanto, utilizando um modelo dependente do tempo, uma RDI média semanal medida continuamente ≥30 episódios/h foi independentemente associada a uma exposição à FA ≥5 min/dia (hazard ratio [HR]2,13, intervalo de confiança de 95% [CI]: 1,24-3,65, p=0,006), ≥6 h/dia (HR: 2,75, IC 95%: 1,37-5,49, p=0,004) e ≥23 h/dia (HR: 2,26, IC 95%: 1,05-4,86, p=0,037) foram associados. Os resultados mostram que os doentes com insuficiência cardíaca com FA grave diagnosticada por CDI têm duas a três vezes mais probabilidades de ter um episódio de FA, dependendo do limiar da carga diária de FA [13].
Insuficiência cardíaca e apneia do sono
Os distúrbios do sono são comuns em doentes com insuficiência cardíaca com fração de ejeção reduzida (IC-FER), com uma taxa de prevalência relatada de 50-75%. A AOS, em particular, é mais comum em doentes com insuficiência cardíaca do que na população em geral. A apneia central do sono, que se pode manifestar como respiração de Cheyne-Stokes, encontra-se em 25-40% dos doentes com insuficiência cardíaca com fração de ejeção reduzida. A prevalência da apneia central do sono aumenta paralelamente ao aumento da gravidade da insuficiência cardíaca e ao agravamento da disfunção cardíaca, explica o Prof. Dr. Michael Arzt, University Hospital Regensburg Clinic and Polyclinic for Internal Med. II, Cardiology Regensburg, Alemanha [14]. Existem vários mecanismos pelos quais a apneia central do sono pode afetar negativamente a função cardíaca, incluindo o aumento da atividade do sistema nervoso simpático e a hipoxemia intermitente. Além disso, a apneia central do sono é um marcador de risco independente para um mau prognóstico e morte em doentes com insuficiência cardíaca.
No estudo CanadianContinuous Positive Airway Pressure for Patients with Central Sleep Apnea and Heart Failure(CANPAP), os doentes com insuficiência cardíaca e apneia central do sono foram aleatoriamente designados para receber CPAP ou não receber CPAP. O estudo foi interrompido precocemente e não mostrou qualquer efeito positivo do CPAP na morbilidade ou mortalidade. Uma análise post-hoc sugeriu que a mortalidade poderia ser menor se o índice de apneia-hipopneia (IAH; o número de eventos de apneia ou hipopneia por hora de sono) fosse reduzido para menos de 15 eventos por hora [15].
Efeitos da servo-ventilação adaptativa
Ambos os tipos de distúrbios respiratórios do sono, apneia obstrutiva e apneia central do sono (AOS e ACS, respetivamente), são comuns em doentes com insuficiência cardíaca e fração de ejeção reduzida (ICFrEF). Até à data, não era claro se o tratamento dos distúrbios respiratórios do sono através da servo-ventilação adaptativa (ASV) reduzia a morbilidade e a mortalidade nestes doentes. A servoventilação adaptativa é uma terapia de ventilação não invasiva que alivia eficazmente a apneia central do sono, fornecendo um suporte de pressão inspiratória servo-controlada, para além da pressão positiva expiratória nas vias aéreas.
O estudo SERVE-HF (Tratamento dos distúrbios respiratórios do sono com apneia central predominante do sono através de ventilação servo adaptativa em doentes com insuficiência cardíaca) investigaram os efeitos da ASV (AutoSet CS, ResMed) na sobrevivência e nos resultados cardiovasculares em doentes com insuficiência cardíaca com fração de ejeção reduzida e apneia do sono predominantemente central, que foram tratados para além do tratamento médico exigido pelas directrizes. Um total de 1325 doentes com uma fração de ejeção do ventrículo esquerdo igual ou inferior a 45%, um índice de apneia-hipopneia (IAH) de 15 ou mais eventos (eventos de apneia ou hipopneia) por hora e uma predominância de eventos centrais foram aleatoriamente designados para tratamento médico baseado nas directrizes com ASV ou apenas tratamento médico baseado nas directrizes (controlo). O desfecho primário na análise do tempo até ao evento foi o primeiro evento de morte por qualquer causa, uma intervenção cardiovascular que salvasse a vida (transplante cardíaco, implantação de um dispositivo de assistência cardíaca, reanimação após paragem cardíaca súbita ou um choque adequado que salvasse a vida) ou uma admissão hospitalar não planeada devido ao agravamento da insuficiência cardíaca.
No grupo com ASV, o IAH médio após 12 meses foi de 6,6 eventos por hora. A incidência do ponto final primário não foi significativamente diferente entre o grupo ventilado com ASV e o grupo de controlo (54,1% e 50,8%, respetivamente; hazard ratio, 1,13; intervalo de confiança de 95% [CI], 0,97-1,31; p=0,10). A mortalidade por todas as causas e a mortalidade cardiovascular foram significativamente mais elevadas no grupo ASV do que no grupo de controlo (hazard ratio para morte por qualquer causa, 1,28; IC 95%, 1,06-,55; p=0,01; e hazard ratio para morte cardiovascular, 1,34; IC 95%, 1,09-1,65; p=0,006). Assim, a ASV não teve um efeito significativo no endpoint primário em doentes com insuficiência cardíaca com fração de ejeção reduzida e apneia do sono predominantemente central, mas tanto a mortalidade por todas as causas como a mortalidade cardiovascular aumentaram com esta terapêutica [16]. Várias explicações têm sido propostas para o facto de a VEA poder desencadear arritmias ventriculares, tais como alterações rápidas dos gases sanguíneos, do pH e dos níveis de potássio, e efeitos no retorno venoso e na tensão transmural da parede devido à pressão positiva aplicada nas vias aéreas.
Por conseguinte, uma análise auxiliar do subestudo principal do SERVE-HF avaliou o impacto da ASV no peso das arritmias ventriculares nocturnas em doentes tratados com ASV com ICFEr e apneia central do sono. Desde a linha de base até ao seguimento de 3 e 12 meses No seguimento de 12 meses, o número de complexos ventriculares prematuros (controlo: mediana de 19,7, 19,0 e 19,0; ASV: 29,1, 29,0 e 26,0 eventos/h; p=0,800) e a ocorrência de ≥1 taquicardia ventricular não contínua/noite (controlo: 18, 25 e 18% dos doentes; ASV: 24, 16 e 24% dos doentes; p=0,095) foram semelhantes nos grupos de controlo e ASV. A adição de ASV ao tratamento médico exigido pelas directrizes não teve qualquer efeito significativo na ectopia ventricular nocturna ou nas taquiarritmias durante um período de 12 meses em doentes vivos com ICFEr e apneia central do sono. Os resultados não suportam a hipótese de que a VEA possa levar à morte súbita cardíaca por desencadear taquiarritmias ventriculares [17].
Em contraste, o ensaio ADVENT-HF, um estudo multicêntrico, multinacional, aleatório, aberto, de grupos paralelos, com avaliação cega dos parâmetros da terapêutica médica padrão para a insuficiência cardíaca isolada versus a administração adicional de ASV em doentes com insuficiência cardíaca e distúrbios respiratórios do sono, não conseguiu demonstrar um efeito positivo ou negativo da terapêutica com ASV no prognóstico em doentes com insuficiência cardíaca (FEVE <45%) e apneia obstrutiva ou central do sono [18].
As perturbações respiratórias relacionadas com o sono não se limitam apenas aos doentes com insuficiência cardíaca grave
Os dados atualmente disponíveis sobre os distúrbios respiratórios do sono na insuficiência cardíaca centram-se principalmente na insuficiência cardíaca com fração de ejeção preservada (ICFEr), enquanto os dados sobre os distúrbios respiratórios do sono e a insuficiência cardíaca com fração de ejeção preservada (ICFEp) são limitados. No entanto, os distúrbios respiratórios do sono moderados a graves também parecem ser uma comorbilidade comum na ICFEP, afectando 37-58% dos doentes. Por exemplo, o tratamento da AOS em doentes com ICFEP oferece a oportunidade de melhorar a qualidade de vida e o desempenho físico, e tem o potencial de prevenir a progressão da ICFEP através da redução da pressão arterial e da carga de trabalho cardíaco e da prevenção da remodelação cardíaca. Devido à diferente fisiopatologia, impacto e implicações prognósticas e modalidades de tratamento, é, portanto, crucial distinguir entre pacientes com IC com predominância de AOS ou ACS.
O objetivo da análise do registo SleepHF-XT foi, portanto, investigar a prevalência específica do género e os preditores dos distúrbios respiratórios relacionados com o sono (tanto AOS como ASC) em doentes com ICFEp em comparação com os doentes com fração de ejeção ligeiramente reduzida (ICFEm) ou ICFEr. Dos 3289 pacientes incluídos, 2032 tinham ICFEp, 559 tinham ICFEm e 698 tinham ICFEr. A prevalência de distúrbios respiratórios do sono foi elevada na ICFEp, mas significativamente mais baixa do que na ICFEm ou na ICFEr (36% vs. 41 e 48%, respetivamente). As taxas de distúrbios respiratórios do sono em homens e mulheres foram de 41 e 28% para a ICFEp, 44 e 30% para a ICFEm, e 50 e 40% para a ICFEr. A proporção de homens e mulheres com distúrbios respiratórios do sono que tinham AOS foi significativamente maior na ICFEp do que na ICFEr. O sexo masculino, a idade mais avançada, o índice de massa corporal mais elevado e a classe funcional III/IV da New York Heart Association foram preditores significativos de distúrbios respiratórios do sono moderados a graves em doentes com insuficiência cardíaca. A prevalência de distúrbios respiratórios do sono na ICFEp foi, portanto, alta, mas menor do que em pacientes com ICFEm ou ICFEr. Os distúrbios respiratórios do sono moderados a graves ocorreram mais frequentemente nos homens do que nas mulheres em todo o espetro da insuficiência cardíaca. Em ambos os sexos, a proporção de AOS com ICFEp foi mais elevada do que com ICFEr [19].
Os agregados de doentes podem apoiar a tomada de decisões clínicas
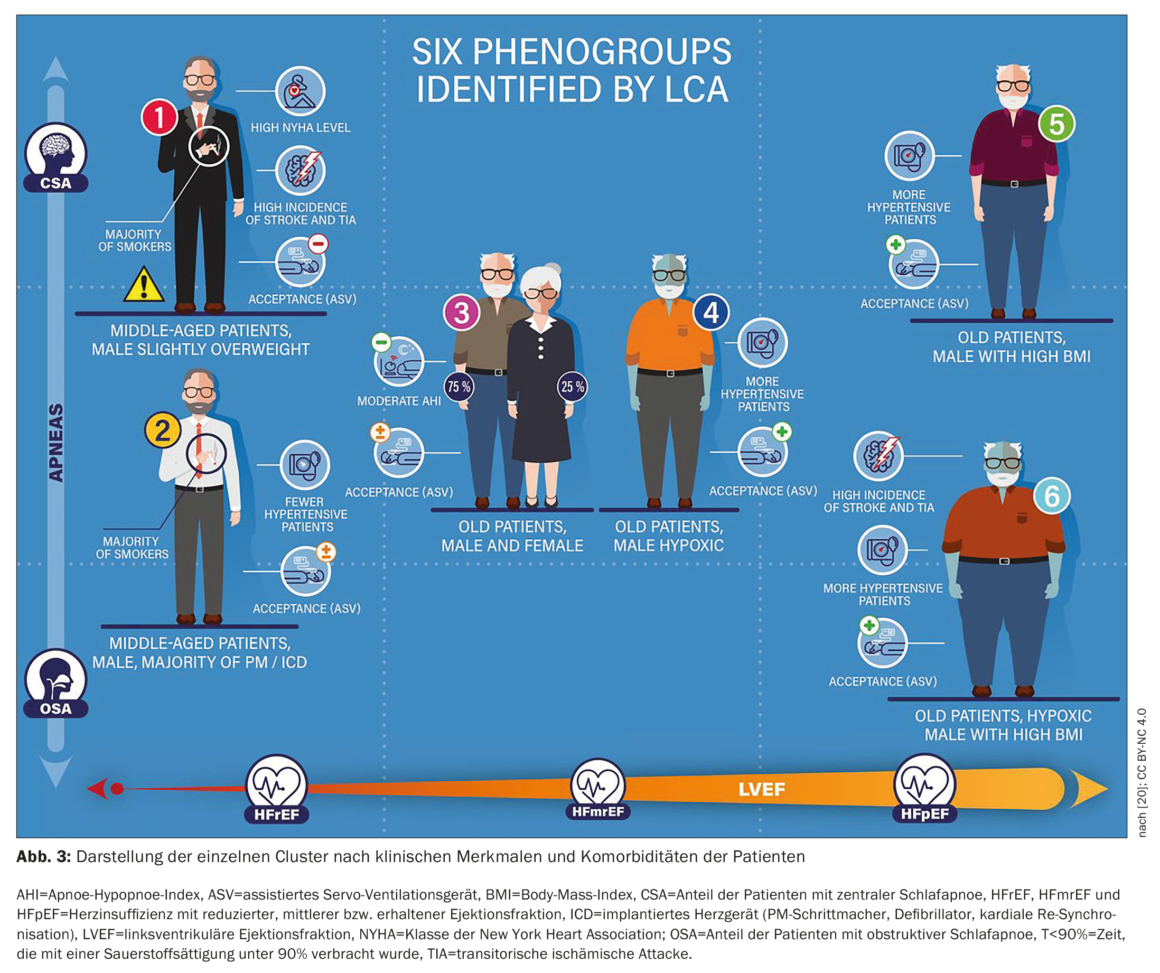
O estudo FACE, um estudo de coorte europeu, multicêntrico, prospetivo e observacional, utilizou dados do mundo real para avaliar o efeito da terapêutica PAP com ASV na morbilidade e mortalidade em doentes com ICFEr, ICFEr ou ICFEp e distúrbios respiratórios centrais do sono ou CSA/OSA coexistentes. Os dados relativos a três meses foram apresentados em subgrupos de doentes definidos através da análise de classes latentes (LCA). A LCA identificou, pela primeira vez, seis grupos distintos de doentes que representam subgrupos clinicamente relevantes relacionados com a gestão dos DRS em doentes com insuficiência cardíaca com diferentes utilizações de ASV e prognósticos. A taxa de endpoints primários aos 3 meses foi significativamente superior nos doentes do cluster 1 (predominantemente homens, FEVE baixa, IC grave, CSA; 13,9% versus 1,5-5% nos outros clusters, p<0,01). Isto pode melhorar a fenotipagem dos doentes na prática clínica e permitir a individualização da terapêutica.
A Figura 3 [20] mostra a apresentação clínica de cada grupo. Os principais parâmetros que diferenciaram os clusters foram o IAH obstrutivo, o IAH central, a FEVE (%), a classe I/II da NYHA, o T90 e a presença de ICFEr. Como esperado, houve diferenças significativas nos dados demográficos dos doentes, nas características da doença de IC e nas características dos DRS entre os grupos resultantes diretamente da metodologia LCA. É interessante notar que a adesão à ASV e a recusa da ASV diferiram significativamente entre os grupos, embora estas variáveis não tenham sido incluídas no modelo LCA. A taxa de desfechos primários em 3 meses foi significativamente maior nos pacientes do cluster 1 (predominantemente homens, baixa FEVE, IC grave, CSA; 13,9% versus 1,5-5% nos outros clusters, p<0,01). Este grupo correspondia aos que apresentavam um mau prognóstico sob terapêutica com ASV na população inscrita no SERVE-HF [20].
Congresso: 89ª Conferência Anual da DGK
Literatura:
- Börgel J: Neues vom unheilvollen Duo Nr. 1: Arterielle Hypertonie und Schlafapnoe. 89. Jahrestagung der DGK, 12.04.2023, Sitzung: Kardiovaskuläre Erkrankungen und schlafbezogene Atmungsstörungen im digitalen Zeitalter.
- Becker HF, et al.: Effect of Nasal Continuous Positive Airway Pressure Treatment on Blood Pressure in Patients With Obstructive Sleep Apnea. Circulation 2002; https://doi.org/10.1161/01.CIR.0000042706.47107.7A.
- Fava C, et al.: Effect of CPAP on Blood Pressure in Patients With OSA/Hypopnea: A Systematic Review and Meta-analysis. ScienceDirect 2014; https://doi.org/10.1378/chest.13-1115.
- Liping L, et al.: Continuous Positive Airway Pressure in Patients With Obstructive Sleep Apnea and Resistant Hypertension: A Meta-Analysis of Randomized Controlled Trials. J Clin Hypertens (Greenwich) 2016 Feb; doi: 10.1111/jch.12639.
- Azarbarzin A, et al.: The hypoxic burden of sleep apnoea predicts cardiovascular disease-related mortality: the Osteoporotic Fractures in Men Study and the Sleep Heart Health Study. Eur Heart J. 2019; doi: 10.1093/eurheartj/ehy624.
- Mehra R, Azarbarzin A: Sleep Apnea–Specific Hypoxic Burden and Not the Sleepy Phenotype as a Novel Measure of Cardiovascular and Mortality Risk in a Clinical Cohort. Am J Respir Crit Care Med 2022; doi: 10.1164/rccm.202110-2371ED.
- Sapiña-Beltrán E, et al.: Differential blood pressure response to continuous positive airway pressure treatment according to the circadian pattern in hypertensive patients with obstructive sleep apnoea. European Respiratory Journal 2019;
doi: 10.1183/13993003.00098-2019. - Sinha AM: Neues vom unheilvollen Duo Nr. 2: Vorhofflimmern und Schlafapnoe. 89. Jahrestagung der DGK, 12.04.2023, Sitzung: Kardiovaskuläre Erkrankungen und schlafbezogene Atmungsstörungen im digitalen Zeitalter.
- Iwasaki Y: Mechanism and management of atrial fibrillation in the patients with obstructive sleep apnea. Journal of Arrhythmia 2022;
https://doi.org/10.1002/joa3.12784. - Chen YL, et al.: GJA1 Expression and Left Atrial Remodeling in the Incidence of Atrial Fibrillation in Patients with Obstructive Sleep Apnea Syndrome. Biomedicines 2021; doi: 10.3390/biomedicines9101463.
- Shapira-Daniels A, et al.: Prevalence of Undiagnosed Sleep Apnea in Patients With Atrial Fibrillation and its Impact on Therapy. JACC Clin Electrophysiol 2020; doi: 10.1016/j.jacep.2020.05.030
- Nelliah CJ, et al.: Impact of CPAP on the Atrial Fibrillation Substrate in Obstructive Sleep Apnea: The SLEEP-AF Study. JACC Clin Electrophysiol 2022; doi: 10.1016/j.jacep.2022.04.015.
- Boriani G, et al.: Association between implantable defibrillator-detected sleep apnea and atrial fibrillation: The DASAP-HF study. J Cardiovasc Electrophysiol 2022; doi: 10.1111/jce.15506.
- Arzt M: Neues vom unheilvollen Duo Nr. 3: Herzinsuffizienz und Schlafapnoe. 89. Jahrestagung der DGK, 12.04.2023, Sitzung: Kardiovaskuläre Erkrankungen und schlafbezogene Atmungsstörungen im digitalen Zeitalter.
- Bradley TD, et al.: Continuous positive airway pressure for central sleep apnea and heart failure. N Engl J Med 2005; doi: 10.1056/NEJMoa051001.
- Cowie MR, et al.: Adaptive Servo-Ventilation for Central Sleep Apnea in Systolic Heart Failure. N Engl J Med 2015; doi: 10.1056/NEJMoa1506459.
- Fisser C, et al.: Effects of Adaptive Servo-Ventilation on Nocturnal Ventricular Arrhythmia in Heart Failure Patients With Reduced Ejection Fraction and Central Sleep Apnea-An Analysis From the SERVE-HF Major Substudy. Front Cardiovasc Med 2022; doi: 10.3389/fcvm.2022.896917.
- Lyons OD, et al.: Design of the effect of adaptive servo-ventilation on survival and cardiovascular hospital admissions in patients with heart failure and sleep apnoea: the ADVENT-HF trial. Eur J Heart Fail 2017; doi: 10.1002/ejhf.790; Bradley D, et al.: ESC Congress 2022.
- Arzt M, et al.: Prevalence and predictors of sleep-disordered breathing in chronic heart failure: the SchlaHF-XT registry. ESC Heart Fail 2022;
doi: 10.1002/ehf2.14027. - Tamisier R, et al.: Adaptive servo ventilation for sleep apnoea in heart failure: the FACE study 3-month data. Thorax 2022; doi: 10.1136/thoraxjnl-2021-217205.
CARDIOVASC 2023; 22(2): 42–47