É largamente desconhecida: a cistite intersticial. No entanto, a inflamação crónica não infecciosa da parede da bexiga está associada a sintomas dolorosos, doenças concomitantes e stress psicológico.
A primeira directriz sobre o diagnóstico e tratamento da cistite intersticial está em vigor desde o Outono de 2018 [1]. Destina-se a clínicos gerais, urologistas, ginecologistas, internistas, terapeutas da dor e psicossomáticos e destina-se a contribuir para uma melhor qualidade de cuidados para as pessoas afectadas.
Elevado número de casos não notificados
Embora não exista uma definição globalmente válida, a cistite intersticial (CI) é entendida como uma inflamação crónica não infecciosa da bexiga urinária, que se manifesta sintomaticamente como dor, pollakiuria e noctúria. Os sintomas ocorrem em diferentes graus e combinações. O diagnóstico da síndrome da dor na bexiga (SPB) não é suficiente aqui, pois concentra-se demasiado na dor, o que não faz justiça ao quadro clínico da CI. No entanto, devido à sobreposição por vezes estreita de diferentes quadros clínicos, não é tão fácil distinguir a CI de outras doenças da bexiga (Fig. 1).
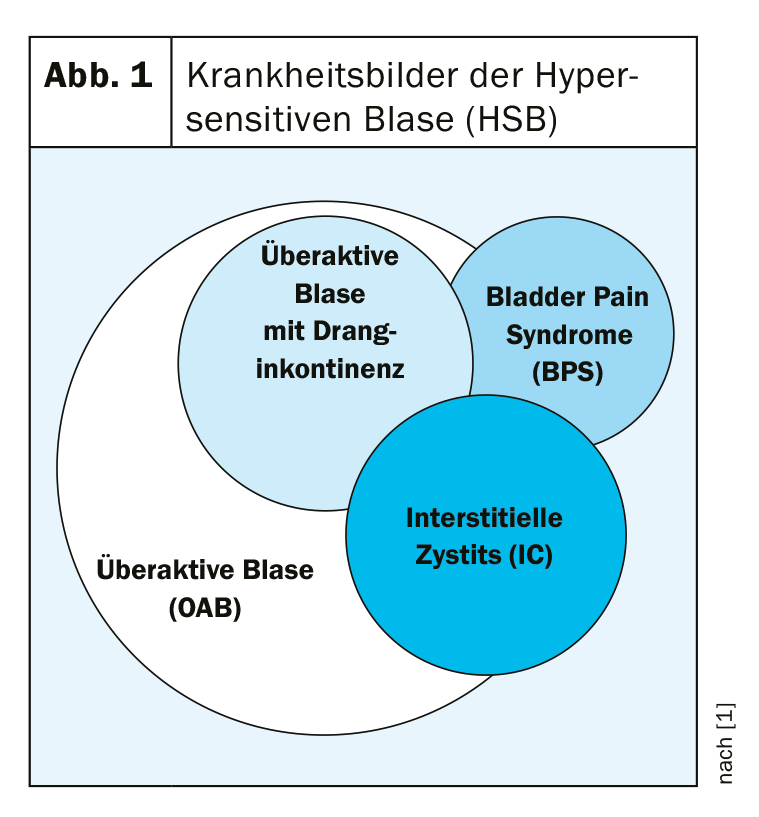
Em princípio, a CI pode ocorrer em qualquer faixa etária, com a maior prevalência encontrada em pessoas de meia-idade. As mulheres são afectadas cerca de nove vezes mais frequentemente do que os homens. Contudo, uma vez que faltam estudos epidemiológicos, não existem dados precisos. O número de casos não relatados é elevado.
Também não é claro como é criado um CI em primeiro lugar. Vários factores etiopatogénicos são discutidos. O foco está nos possíveis danos no urotelium: infecções frequentes da bexiga alteram a camada de GAG, a permeabilidade da bexiga urinária e a homeostase urotelial. Como resultado, substâncias irritantes da urina penetram nas camadas submucosa e mais profundas da parede da bexiga urinária. Este processo destrutivo pode mesmo levar à perda do urotelium. A mucosa defeituosa da bexiga evoca uma maior sensibilidade e dor na bexiga.
A maratona dos médicos intensifica o sofrimento
Pode demorar até nove anos para que os doentes afectados sejam diagnosticados com IC. Os diagnósticos incorrectos não são raros, especialmente nas fases iniciais da doença. Esta maratona de médicos é estressante e pode levar os doentes a sentirem-se como malignos, tornando-se solitários e até a desenvolverem depressão. Para piorar a situação, os pacientes com IC sofrem frequentemente de doenças concomitantes, tais como fadiga, síndrome do cólon irritável, fibromialgia, distúrbios psicológicos e outras queixas neurológicas, somáticas funcionais ou reumáticas.
Por conseguinte, é ainda mais importante que haja agora um consenso sobre a forma como a CI pode ser diagnosticada e tratada com a directriz S2k da Sociedade Alemã de Urologia.
Como diagnosticar?
Tal como com outras doenças, a orientação S2k recomenda que se inicie o diagnóstico com uma anamnese abrangente. Questionários tais como o índice ICSI/ICPI (frequência de micção, desconforto urinário), o questionário PUF (dypareunia, dor pélvica) e a pontuação de dor na bexiga/IC Symptom Score (BPIC-SS) fornecem apoio. As fichas de documentação sob a forma de um diário de dor ou de um registo de micção de bebida também são úteis. O exame físico incide sobre a área genital. Além disso, deve ser colhida uma amostra de urina. Exames adicionais incluem urosonografia, cistoscopia e, nos homens, uroflowmetry. Se necessário, a hidrodistensão, um EMG de fluxo ou um teste de cloreto de potássio podem ser considerados para obter uma maior sensibilidade à dor. Uma biópsia da parede da bexiga não é decisiva para o diagnóstico, mas também deve ser considerada. No entanto, como os mastócitos estão envolvidos em vários processos inflamatórios, este método não é conclusivo na determinação de uma CI. Outra opção de medicina complementar é uma amostra de fezes, que fornece informação sobre a flora intestinal. Não existem actualmente biomarcadores conhecidos, embora esteja a ser realizada investigação a este respeito.
O diagnóstico também inclui a exclusão de toda uma série de diagnósticos diferenciais. Estes incluem:
- Doenças músculo-esqueléticas (por exemplo, disfunção do pavimento pélvico, fibromialgia, hérnias, dores crónicas nas costas, malignidades)
- Doenças gastrointestinais (por exemplo, CED, síndrome do intestino irritável, estenose intestinal pequena e grande, doenças malignas)
- Doenças ginecológicas (por exemplo endometriose/adenomiosite, varicose pélvica, estenose cervical)
- Doenças urológicas (por exemplo, disfunção da bexiga, inflamação crónica do tracto urinário, prostatite, neoplasias malignas)
- Causas neurogénicas (por exemplo, herpes genital, neuralgia, varicela zoster)
- Perturbações mentais (por exemplo, perturbações afectivas, esquizofrénicas, somatoformes)
Tratamento multimodal!
IC não é curável. No entanto, a progressão da doença pode ser retardada e os sintomas aliviados. A terapia apropriada deve ser interdisciplinar e multimodal, tendo em conta aspectos biopsicossociais (Fig. 2). O primeiro passo é uma mudança no estilo de vida. O guarda-roupa, a sexualidade e o desporto devem ser organizados de tal forma que não se verifique um agravamento dos sintomas. O stress e o frio têm um efeito negativo, enquanto que o treino da bexiga tem alguma eficácia. Como as intolerâncias alimentares estão frequentemente associadas a sintomas de IC/BPS, deve ser dada especial atenção à dieta. Devido ao seu baixo teor de histamina, os alimentos não fermentados, fermentados ou amadurecidos microbiologicamente são os preferidos. Semelhante à IBS, uma dieta pobre em FODMAP pode revelar-se útil. Os sintomas psicossomáticos devem ser aliviados através de cuidados psicológicos ou psiquiátricos, em que o ambiente social do paciente também desempenha um papel importante. A disfunção do pavimento pélvico, que é comum na IC, pode ser tratada com fisioterapia.
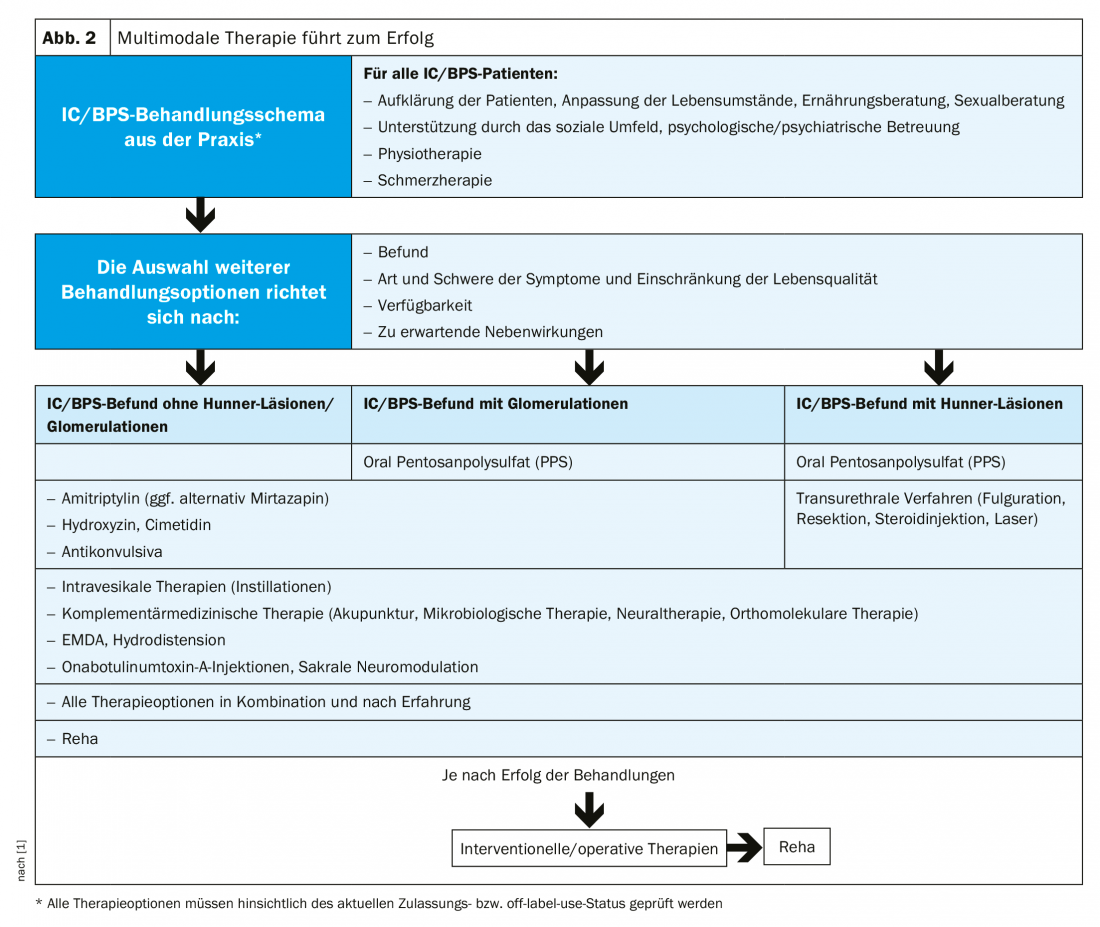
Actualmente, apenas o polissulfato de pentosano (PPS) é aprovado como terapia medicamentosa oral para CI na Europa. O ingrediente activo repara a camada de GAG do urotelium, impedindo a penetração de substâncias tóxicas ou irritantes para a parede da bexiga urinária. O PPS também promove o fluxo sanguíneo para a bexiga urinária. O efeito ocorre geralmente após três a seis meses, aplicando-se o seguinte: quanto mais cedo a terapia começar, melhor!
Fora do rótulo, outros agentes podem ser considerados. Amitriptilina, ao inibir a recaptação de serotonina/norepinefrina, modifica a transmissão da dor no SNC e reduz a activação dos mastócitos, resultando na redução da micção e da dor. Uma alternativa à amitriptilina é a mirtazapina antidepressiva tetraciclica, que – ao contrário da amitriptilina – não tem efeitos secundários anticolinérgicos. A hidroxizina também inibe a activação dos mastócitos e tem efeitos anticolinérgicos, ansiolíticos e analgésicos. Estudos mostraram uma redução da dor e noctúria em pacientes com IC tratados com o antagonista histamino-2 receptor cimetidina. Este efeito pode ser explicado pelo facto de a cimetidina inibir a sobreexpressão dos receptores H1 e H2, receptores purinérgicos P2X e receptores colinérgicos muscarínicos observados na CI. Montelukast, que é aprovado para a asma, também mostrou efeito na CI num pequeno estudo ao reduzir a inflamação induzida pelas células do mastro. Os inibidores de fosfodiesterase-5 (PDE5) têm um efeito relaxante sobre as células musculares lisas da bexiga urinária, embora a causa da acção ainda não seja clara. O antagonista do canal de cálcio nifedipina também provou ser eficaz no tratamento da CI. No entanto, ainda faltam estudos prospectivos aleatórios.
A directriz S2k também recomenda a terapia da dor adequada. A dor dos pacientes deve ser aliviada, e a utilização irreflectida de analgésicos pouco eficazes deve ser evitada. Actualmente, não existe consenso de tratamento em relação à CI, mas os peritos referem-se a diferentes grupos de medicamentos que também podem ser utilizados em combinação. Dependendo da gravidade e da resposta do paciente, podem ser utilizados AINS, anticonvulsivos, novamina sulfona e opiáceos.
Além disso, é possível o uso de relaxantes musculares (por exemplo, tizanidina), bloqueadores alfa (por exemplo, tamsulosina) e anticonvulsivos (por exemplo, pré-gabalina).
Os efeitos secundários sistémicos podem ser contornados através de formas de tratamento intravesicais. No entanto, as desvantagens da terapia, em que elevadas concentrações de substâncias activas são introduzidas directamente na bexiga urinária, são o risco de infecção, a invasividade e os elevados custos.
Os procedimentos de medicina complementar, tais como acupunctura, terapia neural, terapias microbiológicas ou substituição de micronutrientes, são outra opção. Se nenhuma das terapias for bem sucedida, a cirurgia é a única opção. Uma medida de acompanhamento é sempre o tratamento em centros especializados de reabilitação urológica. Em última análise, o objectivo continua a ser proteger o CI que sofre da ameaça de incapacidade para o trabalho e/ou isolamento social.
Literatura:
- Sociedade Alemã de Urologia, ed.: S2k-Leitlinie Diagnostik und Therapie der Interstitiellen Cystitis (IC/BPS), Langfassung, 1. Auflage, Versão 1. 2018.
PRÁTICA DO GP 2019; 14(5): 39-41











