O receptor HER2 pertence à família de quatro tirosinases transmembranas receptoras (EGFR/HER1, HER2, HER3 e HER4) que influenciam o crescimento, diferenciação e sobrevivência celular. A sobreexpressão do HER2 ocorre em aproximadamente 20% de todos os cancros mamários precoces e está associada a um curso de doença mais agressivo e a um mau prognóstico. Apenas a introdução de substâncias específicas dirigidas contra o HER2 melhorou significativamente o prognóstico das doentes com cancro da mama com HER2 positivo.
A única substância aprovada para a fase inicial do carcinoma da mama é o anticorpo monoclonal trastuzumab (Herceptin®), de acordo com a Conferência de Consenso Internacional de St. Gallen [1]. Outras substâncias como o lapatinibe (Tyverb®) e o pertuzumab (Perjeta®) estão actualmente a ser testadas nesta indicação em grandes ensaios internacionais. Estes já estão aprovados na situação metastática, e o T-DM1 (Kadcyla®) é outra nova opção terapêutica.
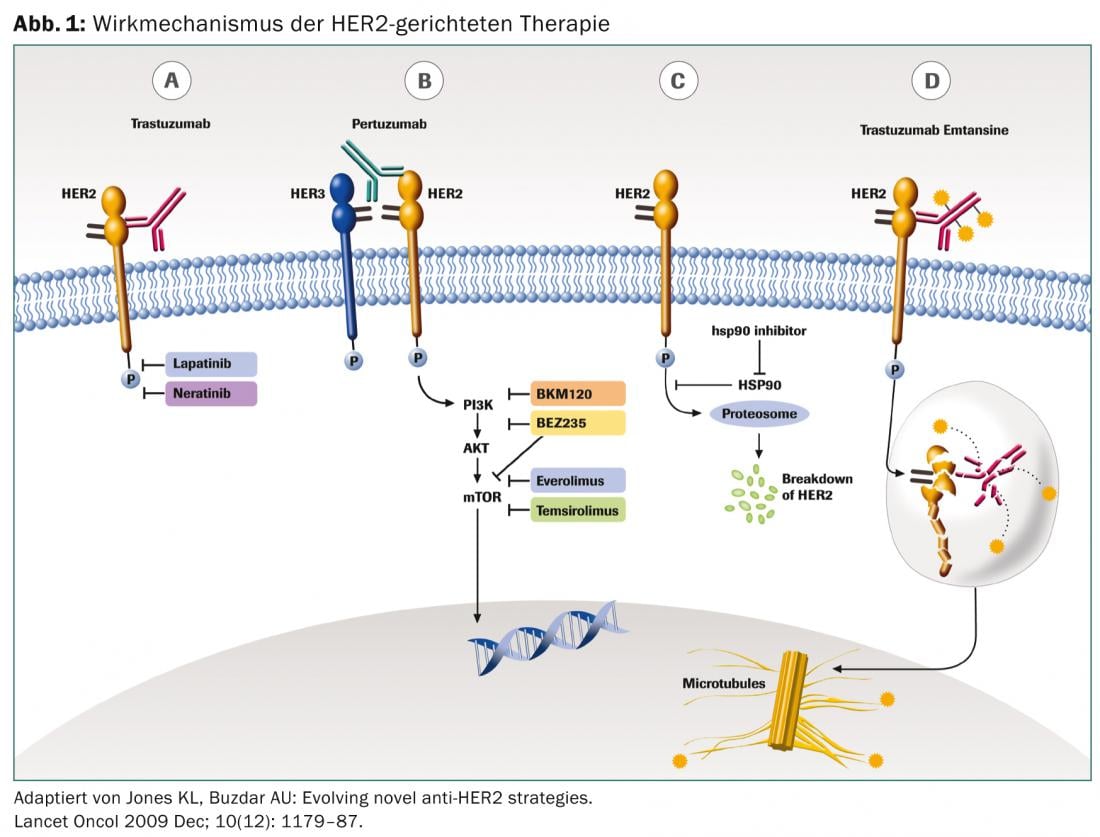
Trastuzumab
O trastuzumab monoclonal de anticorpos visa o domínio extracelular do receptor HER2. Como mediador da citotoxicidade mediada por células anti-corpo (ADCC), impede uma maior proliferação. A administração é intravenosa. A terapia é normalmente bem tolerada. A primeira aplicação pode causar uma reacção de infusão com febre, arrepios e dores articulares, que podem ser bem tratadas com paracetamol. A cardiotoxicidade cumulativa é conhecida, razão pela qual a ecocardiografia é recomendada antes de se iniciar a terapia e a intervalos regulares a partir daí.
Lapatinibe
Lapatinib, administrado oralmente, inibe reversivelmente os domínios de tirosina cinase dos receptores EGF (ErbB1) e ErbB2 (HER2). Em contraste com o trastuzumab, a molécula lapatinib é também mais pequena, o que poderia explicar o melhor efeito nas metástases cerebrais. Os efeitos secundários são principalmente sintomas gastrointestinais com diarreia, perda de apetite e náusea, bem como erupção cutânea, fadiga e hepatotoxicidade. A cardiotoxicidade acumulada também foi descrita com lapatinibe, razão pela qual se recomenda uma monitorização adequada.
Pertuzumab
Pertuzumab é também um anticorpo monoclonal e liga-se especificamente ao domínio de dimerização extracelular (subdomínio II) do receptor HER2, enquanto que o trastuzumab liga-se ao domínio IV. Desta forma, o pertuzumab bloqueia a formação de heterodimerização liga-dependente do HER2 com outros membros da família HER2, incluindo o HER1, HER3 e HER4. Assim, o pertuzumab liga-se a uma região diferente do receptor HER2 do que o trastuzumab, resultando num efeito sinérgico. O perfil do efeito secundário corresponde ao do trastuzumab.
T-DM1
Trastuzumab emtansine é um conjugado de trastuzumab e da droga citostática mertansine, um inibidor da microtubulinização. O anticorpo liga-se especificamente às células tumorais HER2-positivas, razão pela qual o medicamento citostático causa comparativamente pouco efeito fora das manifestações tumorais. Isto também explica a boa tolerância.
São observados os seguintes efeitos secundários: Reacções de infusão com arrepios e febre, hemato-toxicidade com trombocitopenia em particular requerendo controlo e elevações de enzimas hepáticas (ALT, AST).
Indicações
Antes de qualquer terapia, o estatuto HER2 deve ser determinado através de um exame imuno-histoquímico validado da preparação do tumor. Isto também pode ser examinado num bloco tumoral previamente removido. Apenas um resultado triplo positivo é considerado suficiente para a terapia anti-HER2 e, portanto, positivo. Em caso de dúvida (2+), a amplificação do gene HER2 é também determinada por meio de hibridação in situ fluorescente (FISH), que é considerada positiva a partir de uma relação >2.2 e, por conseguinte, habilita-se a uma terapia orientada.
Fase inicial – Tratamento adjuvante
Nesta fase, até agora só foi aprovado o trastuzumab, em combinação com a quimioterapia. A aprovação seguiu-se à publicação do ensaio HERA em 2005, que demonstrou um benefício significativo na sobrevivência sem doenças e na sobrevivência global para as doentes com cancro da mama com HER2 positivos que receberam terapia de trastuzumab durante um ano. Tomar o trastuzumab durante dois anos não aumenta ainda mais a sua eficácia, como sabemos desde o final de 2012 [2]. Recentemente, foram também mostrados os dados do estudo PHARE, que comparou a terapia durante seis meses versus um ano de trastuzumab [3]. Este estudo foi negativo, resp. não atingiu o ponto final primário de “não inferioridade”.
Com base nos dados da NOAH, o trastuzumab é também utilizado neoadjuvantemente, ou seja, pré-operatoriamente em combinação com quimioterapia. A sobrevivência sem recaída durante 3 anos foi significativamente melhor com 71% em comparação com os 56% tratados sem trastuzumab [4].
A imunoterapia adjuvante com trastuzumab é geralmente iniciada após quimioterapia com antraciclina (nenhuma combinação devido a uma potencial cardiotoxicidade cumulativa ) e pode ser combinada com quimioterapia, terapia endócrina e radioterapia sem antraciclina.
O Lapatinib está também actualmente a ser testado em ensaios. Este ano, foi publicado um estudo da fase III que comparou o lapatinibe contra o trastuzumabe e mostrou uma sobrevivência sem progressão comparável com uma toxicidade mais elevada [5].
Os dados ALTTO, que também testaram esta questão e adicionalmente uma combinação de trastuzumab e lapatinibe, estão pendentes, com o braço de lapatinibe a ter de ser fechado mais cedo. Isto acontece porque o braço de lapatinibe parece ser inferior ao braço de trastuzumab.
O actual padrão de cuidados no cenário adjuvante para o cancro da mama HER2-positivo inclui, assim, a imunoterapia com trastuzumab durante um ano.
Fase avançada, metastasisada
Existem várias opções terapêuticas para o tratamento de pacientes com cancro da mama metastásico HER2-positivo. Para além da terapia endócrina e citostática, a imunoterapia é aqui de grande importância. Em princípio, cada paciente com cancro da mama HER2-positivo deve receber uma terapia orientada adequada.
Enquanto que até há poucos anos apenas o trastuzumab e o lapatinibe estavam disponíveis, o espectro de opções terapêuticas expandiu-se novamente nos últimos meses.
Terapia de primeira linha: Em 2001, o primeiro grande estudo de fase III foi publicado pelo Slamon, que mostrou uma sobrevivência sem progressão significativamente mais longa, uma resposta melhor e mais longa, bem como uma vantagem de sobrevivência para uma combinação de tratamento com quimioterapia e trastuzumab [6]. Foi também demonstrado um benefício em combinação com a terapia endócrina [7].
Um estudo da SAKK (Associação Suíça para a Investigação Clínica do Cancro, www.sakk.ch) está a investigar se a monoterapia trastuzumab é suficiente como primeiro tratamento, seguido pela combinação com quimioterapia. Os resultados estão ainda pendentes. Hoje em dia, o trastuzumab é principalmente utilizado na primeira linha em combinação com quimioterapia ou, se a quimioterapia não parecer adequada, com terapia endócrina.
Dados recentes do ensaio CLEOPATRA mostraram que o docetaxel em combinação com o trastuzumab e o pertuzumab é superior ao docetaxel e ao trastuzumab em termos de sobrevivência sem progressão, bem como de sobrevivência global. No entanto, também deve ser aceite um aumento da toxicidade, especialmente neutropenia e diarreia febril [8]. Pertuzumab está agora autorizado pelo Swissmedic para esta indicação e está também sujeito à cobertura de seguro de saúde obrigatório após aprovação prévia dos custos.
A partir da terapia de segunda linha: Apesar do tratamento direccionado, a progressão da doença ocorre sob o traumatismo devido ao desenvolvimento de resistência. Este desenvolvimento da resistência baseia-se, entre outras coisas, numa mudança no receptor HER2 e na via de sinalização PI3K/Akt. Além disso, há uma upregulação do HER3 ou IGF1R [9]. Contudo, a terapia dirigida contra o HER2 deve ser prosseguida de acordo com o consenso geral (directrizes da OMPE) [10].
Uma opção é continuar o trastuzumab com uma mudança da componente de quimioterapia [11, 12]. Alternativamente, o lapatinibe (em combinação com capecitabina) também está disponível a partir da terapia de segunda linha [13]. A vantagem desta combinação terapêutica é a aplicação oral com, no entanto, principalmente aumento da toxicidade (especialmente síndrome do pé de mão, sintomas gastrointestinais). Para além do lapatinibe, o T-DM1 é agora também utilizado a partir da segunda linha, que foi comparado com a combinação de lapatinibe e capecitabina e era superior em termos de sobrevivência global e tolerabilidade [14]. Isto tem sido aprovado na Suíça desde 2013, mas ainda não está sujeito à cobertura de seguro de saúde obrigatório e requer aprovação prévia dos custos.
A melhor sequência de tratamento na situação metastática não é clara. O ensaio SAKK 22/10 está actualmente a testar as novas substâncias pertuzumab e T-DM1. Na terapia de primeira linha, o bloqueio duplo HER2 (trastuzumab e pertuzumab) com quimioterapia vs. sem quimioterapia é randomizado. O T-DM1 é então planeado como terapia de segunda linha.
Perspectivas
A aplicação subcutânea de trastuzumab [15] já foi testada, o que poderá ser um novo e possivelmente atractivo modo de aplicação no futuro.
Se as novas substâncias são também eficazes na situação adjuvante está actualmente a ser investigada em grandes estudos internacionais.
Além disso, novos inibidores de tirosina quinase peroral (TKIs) estão a ser testados. Em particular, o neratinibe, um EGFR-HER2 TKI irreversível, parece promissor.
LEVAR A MENSAGEM PARA CASA
- O prognóstico do cancro da mama HER2-positivo pode ser significativamente melhorado através de imunoterapia orientada.
- Na fase inicial (adjuvante), o trastuzumab é o padrão terapêutico actual durante um total de um ano.
- Na situação paliativa, a terapia dirigida contra o HER2 deve ser continuada mesmo após a progressão. Para além do trastuzumab e lapatinibe, estão disponíveis novas opções terapêuticas eficazes e bem toleradas com T-DM1 e pertuzumab.
UM RETENIR
- Une immunothérapie ciblée peut sensiblement améliorer le pronostic du carcinome mammaire HER2 positif.
- La thérapie standard au stade précoce (adjuvant) repose actuellement sur l’administration de trastuzumab pendant un an.
- En situation palliative, la thérapie anti-HER2 doit être poursuivie, même en cas de progression. Outre le trastuzumab et le lapatinib, le T-DM1 et le pertuzumab offrent de nouvelles options de traitement efficaces et bien tolérées.
Michael Schwitter, MD
Literatura:
- Goldhirsch A, et al: Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol 2013 set; 24(9): 2206-23.
- Goldhirsch A, et al: 2 anos versus 1 ano de trastuzumab adjuvante para o cancro da mama HER2-positivo (HERA): um ensaio randomizado e controlado de marca aberta. Lancet 2013 Jul 17. pii: S0140-6736(13)61094-6.
- Pivot X, et al: 6 meses versus 12 meses de trastuzumab adjuvante para doentes com cancro da mama precoce positivo HER2 (PHARE): um ensaio aleatório de fase 3. Lancet Oncol 2013 Jul; 14(8): 741-8.
- Gianni L, et al: quimioterapia Neoadjuvant com tras-tuzumab seguida de quimioterapia adjuvante tras-tuzumab versus quimioterapia neoadjuvant sozinha, em doentes com cancro da mama HER2-positivo localmente avançado (o ensaio NOAH): um ensaio aleatório de superioridade controlada com uma coorte paralela HER2-negativa. Lancet 2010 30 de Janeiro; 375(9712): 377-84.
- Goss PE, et al: lapatinibe adjuvante para mulheres com cancro da mama HER2 positivo em fase inicial: um ensaio aleatório, controlado, fase 3. Lancet Oncol 2013 Jan; 14(1): 88-96.
- Slamon DJ, et al: Utilização de quimioterapia mais um anticorpo monoclonal contra o HER2 para o cancro da mama metastásico que exagera no HER2. N Engl J Med 2001 Mar 15; 344(11): 783-92.
- Huober J, et al: Maior eficácia do letrozol em combinação com o trastuzumab em comparação com a monoterapia com letrozol como tratamento de primeira linha em doentes com cancro da mama com HER2-positivo, hormonas-receptor-positivo – resultados do ensaio eLEcTRA. Peito 2012; 21: 27-33.
- Swain SM, et al: Pertuzumab, trastuzumab, e docetaxel para cancro da mama metastásico positivo HER2 (estudo CLEOPATRA): resultados globais de sobrevivência de um estudo aleatório, duplo-cego, controlado por placebo, fase 3. Lancet Oncol 2013 Maio; 14(6): 461-71.
- Wong AL, Lee SC: Mecanismos de Resistência a Trastuzumab e Novas Estratégias Terapêuticas no Cancro da Mama HER2-Positivo. Int J Cancro da Mama 2012; 2012: 415170.
- Cardoso F, et al: Locally recurrent or metastatic breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012 Oct; 23(7): vii11-9.
- von Minckwitz G, et al: Trastuzumab além da progressão no receptor do factor de crescimento epidérmico humano 2-positivo cancro da mama avançado: um estudo do grupo alemão da mama 26/grupo de mama in-ternational 03-05. J Clin Oncol 2009; 27: 1999-2006.
- Huober J, et al.: Trastuzumab treatment beyond progressession in advanced breast cancer: patterns of care in six Swiss breast cancer centres. Oncologia 2011; 81(3-4): 160-6.
- Geyer CE, et al: Lapatinib mais capecitabina para o cancro da mama HER2-positivo avançado. N Engl J Med 2006; 355: 2733-2743.
- Verma S, et al: Trastuzumab emtansine para o cancro da mama avançado HER2-positivo. N Engl J Med 2012 8 de Novembro; 367(19): 1783-91.
- Ismael G, et al: Subcutaneous versus intravenous administration of (neo)adjuvant tras-tuzumab in patients with HER2-positive, clinical stage I-III breast cancer (estudo HannaH): a phase 3, open-label, multicentre, randomised trial. Lancet Oncol 2012 Set; 13(9): 869-78.
InFo Oncologia & Hematologia 2014; (2)1: 5-7











