No congresso da OMPE em Amesterdão, oradores de vários países discutiram os últimos resultados e recomendações terapêuticas no campo da leucemia linfocítica crónica. Globalmente, a quimioterapia com fludarabina, ciclofosfamida (FC) e o rituximab de anticorpos CD20 (R) mostra uma boa eficácia, mas os métodos de tratamento devem ser mais direccionados no futuro e, sobretudo, também aplicáveis a formas recorrentes, concluem os peritos.
De acordo com o Prof. Paolo Ghia, MD, Milão, nos últimos anos foram feitos novos conhecimentos sobre a genética da leucemia linfocítica crónica (CLL): “Por exemplo, estudos enfatizam a relevância da emenda pré-mRNA, um processo celular crítico que pode contribuir para a leucemia linfocítica crónica [1, 2]. Além disso, as mutações NOTCH1, MYD88 e XPO1 que ocorrem periodicamente promovem o desenvolvimento clínico da doença [3]”. No entanto, em última análise, a influência de algumas mutações parece desaparecer quando a terapia é fornecida por transplante alogénico de células estaminais hematopoiéticas [4].

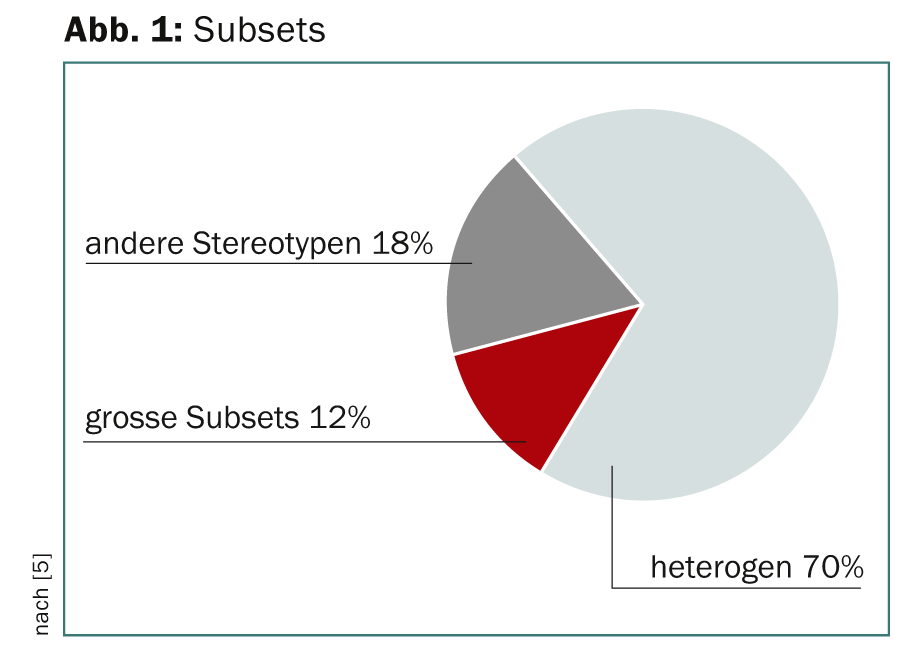
Funcionalmente e prognosticamente relevante é a suposição de que a CLL pode ser dividida em diferentes subconjuntos com receptores de células B estereotipadas (BCR). Isto permitiria uma classificação molecular e intervenções terapêuticas orientadas que se aplicam a um grande número de pacientes do mesmo subconjunto. Uma análise da sequência revelou dois grupos superordenados para doentes com CLL: Um com estereótipo, outro com BCR não estereotipado, com uma proporção de 1:2 [5]. 12% do grupo de estereótipos formaram grandes subconjuntos (Fig. 1).
Tratamento de primeira linha
Peter Hillmen, MD, Leeds, apresentou formas de terapia de primeira linha da CLL: “Ensaios aleatórios da fase III [6] concluem que a terapia quimioimune com fludarabina, ciclofosfamida e rituximab (FCR) melhora a progressão sem progressão e a sobrevivência geral. Três anos após a aleatorização (o segundo grupo foi submetido a quimioterapia com fludarabina, ciclofosfamida), 65% do primeiro grupo estavam sem progressão, e apenas 45% no segundo. Os autores concluem que uma terapia específica de primeira linha pode mudar o curso natural da CLL. Estes resultados definiram o novo padrão no tratamento CLL”. Se algum dos seguintes critérios se aplicar a um doente, não se recomenda a combinação de dose completa (FCR):
- Idade: 75 anos ou mais
- Estado de desempenho 2 ou 3 da OMS
- Restrições cardíacas (NYHA classe II), respiratórias (bronquiectasia ou DPOC moderada) ou problemas renais.
Outras opções terapêuticas
A questão de saber se a fludarabina é mais eficaz do que o clorambucil como mono-terapia (primeira linha) em doentes com mais de 65 anos de idade é controversa. Embora o fludarabine atinja taxas de remissão significativamente mais elevadas, nem a progressão nem as taxas de sobrevivência global são melhoradas em comparação com o clorambucil [7].
Ofatumumab, um anticorpo monoclonal humano (anti-CD20), mostra boa eficácia e tolerância em monoterapia em doentes insensíveis a fludarabina, incluindo aqueles que foram previamente tratados com rituximab [8]. “Ainda faltam estudos comparativos comparando oatumumab com o rituximab. O que se suspeita é que a combinação deatumumab com chlorambucil poderia melhorar a sobrevivência sem progressão em comparação com a monoterapia com clorambucil”, disse o Dr. Hillmen.
Um novo tipo II, anticorpo anti-CD20 chamado obinutuzumab (GA-101) também parece oferecer uma abordagem promissora para uma nova terapia [9].
A terapia actual não é suficientemente eficaz?
Apesar das muitas possibilidades: O Dr. Hillmen conclui que as vias de tratamento actuais são ineficazes para a CLL. Isto acontece por várias razões:
Toxicidade: Em primeiro lugar, ocorrem danos nas células normais. Além disso, as células CLL estão a desenvolver cada vez mais resistência. “As terapias actuais não são visadas”, salientou o Dr. Hillmen.
Eficácia: Apenas um pequeno número de pacientes consegue uma verdadeira e completa remissão. As recaídas são portanto inevitáveis e a maioria acaba por morrer de CLL.
Por conseguinte, são urgentemente necessárias novas abordagens que procurem compreender melhor a fisiopatologia, por exemplo, através do inibidor de tirosina quinase ibrutinibe, que na fase inicial Ib/II estudos multicêntricos permitiram taxas de remissão sustentadas em doentes com recaídas ou CLL persistentes, incluindo aqueles com lesões genéticas de alto risco [10].
Recidências CLL
No CLL recorrente, o transplante alogénico de células estaminais hematopoiéticas é o padrão de ouro porque leva a um bom controlo de doenças independente de mutações [4].
O Prof. Dr. med. Stephan Stilgenbauer, Ulm, descreveu a via de tratamento ideal da seguinte forma: “A CLL relapsed é uma doença biológica e clinicamente heterogénea, que deve ser abordada inicialmente com uma repetição do regime de tratamento inicial após uma remissão de >24 (-36) meses. As normas aqui são as terapias FCR, R-bendamustine, R-chlorambucil. Infelizmente, caso contrário, não há um padrão satisfatório de cuidados para recaídas após 24-36 meses. O transplante alogénico de células estaminais hematopoiéticas é uma opção para pacientes jovens de alto risco. Novos agentes biológicos (antagonistas de sinalização BCR, inibidores BCL2, anticorpos de tipo II, etc.) e combinações futuras sem quimioterapia ou pelo menos -reduzidas oferecem esperança”.
Fonte: “Tratamento da Leucemia Linfocítica Crónica”, sessão no 38º Congresso da OMPE, 27 de Setembro a 1 de Outubro de 2013, Amesterdão
Literatura:
- Wang L, et al: N Engl J Med 2011; 365: 2497-2506. doi: 10.1056/NEJMoa1109016.
- Quesada V, et al: Nat Genet 2011 Dez 11; 44(1): 47-52. doi: 10.1038/ng.1032.
- Puente XS, et al: Nature 2011 Jun 5; 475(7354): 101-105. doi: 10.1038/natura10113.
- Dreger P, et al: Blood 2013 Abr 18; 121(16): 3284-3288. doi: 10.1182/sangue-2012-11-469627. epub 2013 Fev 22.
- Agathangelidis A, et al: Blood 2012; 119(19): 4467-4475.
- Hallek M, et al: The Lancet 2010; 376(9747): 1164-1174.
- Eichhorst BF, et al: Blood 2009 Oct 15; 114(16): 3382-3391. doi: 10.1182/sangue-2009-02-206185. epub 2009 Jul 15.
- Wierda WG, et al: Publicado online antes da impressão Blood 2011. doi: 10.1182/blood-2011-04-348656.
- Mössner E, et al: Blood 2010 Jun 3; 115(22): 4393-4402. doi: 10.1182/blood-2009-06-225979.
- Byrd JC, et al: N Engl J Med 2013; 369: 32-42. doi: 10.1056/NEJMoa1215637.
InFo Oncologia & Hematologia 2013; 1(1): 39-40
CongressoEspecial 2014; 6(1): 19-20