A presença de DPI em pacientes com artrite reumatóide limita o prognóstico, a sobrevivência e a qualidade de vida. O diagnóstico precoce é de grande importância para que o tratamento possa ser iniciado a tempo e a progressão prognosticalmente relevante possa ser evitada. As exacerbações agudas do ILD podem complicar ainda mais o curso. Estes estão ou associados à progressão da doença ou desencadeados secundariamente por infecções.
A doença pulmonar intersticial (DPI) é mais comum nas colagenoses, especialmente na esclerose sistémica (SSc), miopatias auto-imunes, síndrome de Sjögren, lúpus eritematoso sistémico (LES), mas também na artrite reumatóide (AR). Durante a avaliação reumatológica clínica, a pessoa interessada deve ser sempre questionada sobre a possível presença de uma limitação respiratória. A presença de DPI em pacientes com artrite reumatóide limita o prognóstico, a sobrevivência e a qualidade de vida [1]. O diagnóstico precoce é de grande importância para que o tratamento possa ser iniciado a tempo e a progressão prognosticalmente relevante possa ser evitada. A progressão da DPI é comum e é observada de forma relevante, especialmente em pacientes SSc e RA; foram recentemente publicados critérios para determinar a progressão [2]. As exacerbações agudas do ILD podem complicar ainda mais o curso. Estes estão ou associados à progressão da doença ou desencadeados secundariamente por infecções.
Conselho ILD
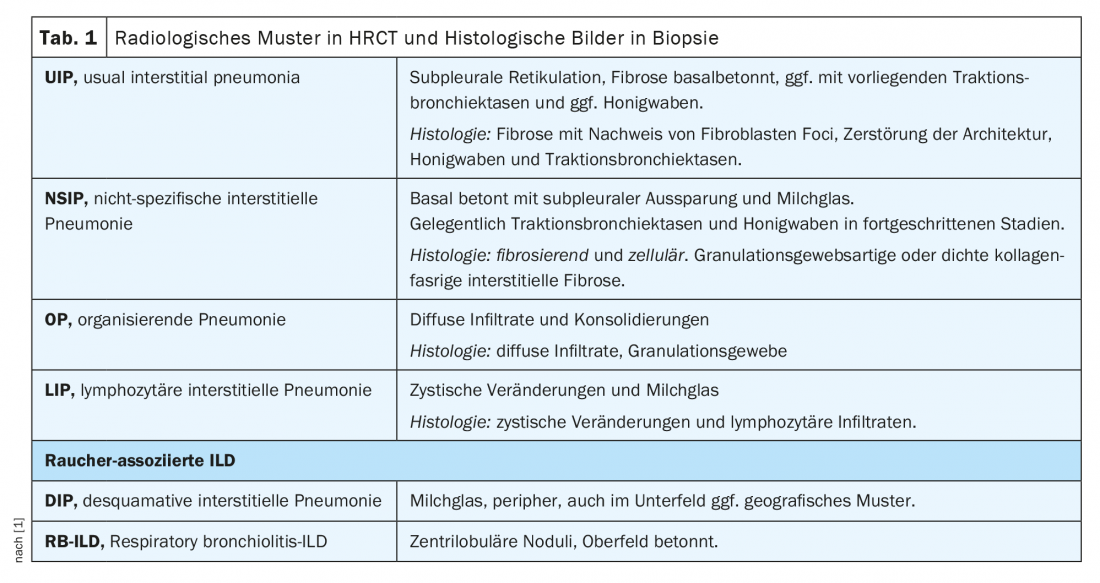
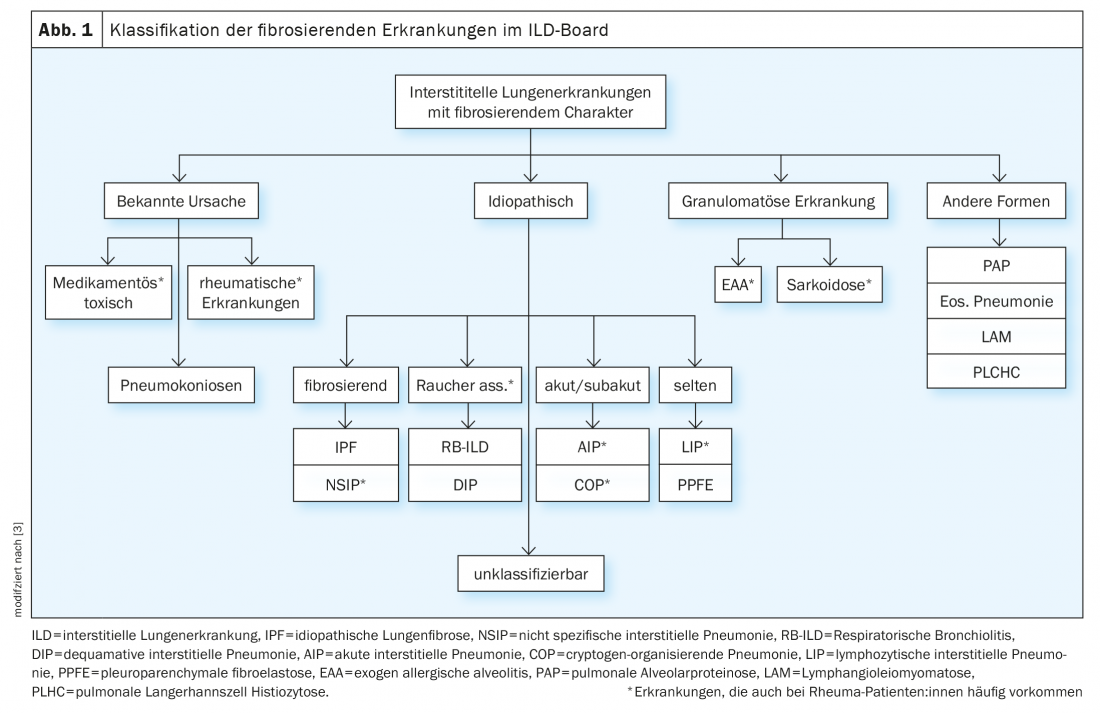
No âmbito do conselho do ILD, os casos são discutidos numa base interdisciplinar com base nos seguintes parâmetros: sintomas principais, história anterior incl. Exposições e noxae, serologia imunológica, limitação funcional pulmonar na pletismografia corporal (esp. FVC, TLC, FEV1) e capacidade de difusão (DLCO), imagiologia por meio de tomografia computorizada de alta resolução do tórax (HRCT), bem como resultados de diagnóstico invasivo por meio de broncoscopia, incl. Descobertas de microbiologia, lavado broncoalveolar (BAL) e descobertas histológicas de biópsias (Tab.1). Contudo, os pacientes com reumatismo podem desenvolver DPI não só como resultado da doença reumática, mas também devido a noxae, medicação ou exposição (especialmente no caso de BAL linfocítica), etc. (Fig. 1). É de notar que a obtenção de biópsias em doenças reumáticas confirmadas raramente é estritamente indicada, mas serve para simplificar a diferenciação dos diagnósticos diferenciais, especialmente em vasculites e sobretudo a coexistência de doenças tumorais e outras doenças.
Doenças reumáticas inflamatórias com possível envolvimento de ILD
AR-ILD: A AR é a doença reumática mais comum. A presença de artrite, especialmente em pequenas articulações, bem como de factores reumatóides elevados e anticorpos contra peptídeos cíclicos citrullinated (a chamada seropositividade) simplificam o diagnóstico e são, por conseguinte, indicativos [4]. A manifestação extra-articular mais comum da AR é a ILD, que é observada em 25-60% dos doentes com AR na TCAR e é responsável por 10-20% das mortes de AR. A LITERANÇA FERROVIÁRIA torna-se clinicamente relevante em cerca de 10% das pessoas afectadas. Em 10% dos casos, o envolvimento pulmonar precede mesmo o desenvolvimento da artrite [5]. Os factores de risco para o desenvolvimento de DPI incluem o sexo masculino, o tabagismo e a seropositividade. As imagens mostram mais frequentemente um padrão UIP. As mutações, como no promotor do gene MUC5B, são descritas na literatura. Fumar pode, adicionalmente, conduzir a um agravamento da situação pulmonar. A presença de uma fibrose pulmonar combinada e enfisema (CPFE) está associada a um prognóstico dramaticamente pior. Diferentemente, a DPI sob imunossupressão deve ser considerada. No entanto, o metotrexato (MTX)-associado ao ILD é extremamente raro (estimado em 0,1%); foi mesmo descrito um efeito protector do MTX.
O MTX não deve, portanto, ser descontinuado na RA-ILD. A LUTA FERROVIÁRIA é tratada principalmente através da optimização da imunossupressão. Faltam ensaios controlados aleatórios para o tratamento da LITRINA RA-ILD. As melhores provas apoiam o tratamento de pacientes de AR com DPI concomitante com abatacept e rituximab [6]. Os resultados do julgamento APRIL (abatacept in RA-ILD) estão ainda pendentes. Além disso, a eficácia dos inibidores JAK ou bloqueadores de IL-6 na RA-ILD foi recentemente relatada em séries de casos [7]. Nos cursos progressivos (visão geral 1), recomenda-se o início da terapia antifibrótica. Nintedanib é aprovado para este fim na UE com base nos resultados do ensaio INBUILD [8]. O prognóstico dos pacientes com TERRA é significativamente limitado em geral, com um tempo médio de sobrevivência de cerca de três anos [1].

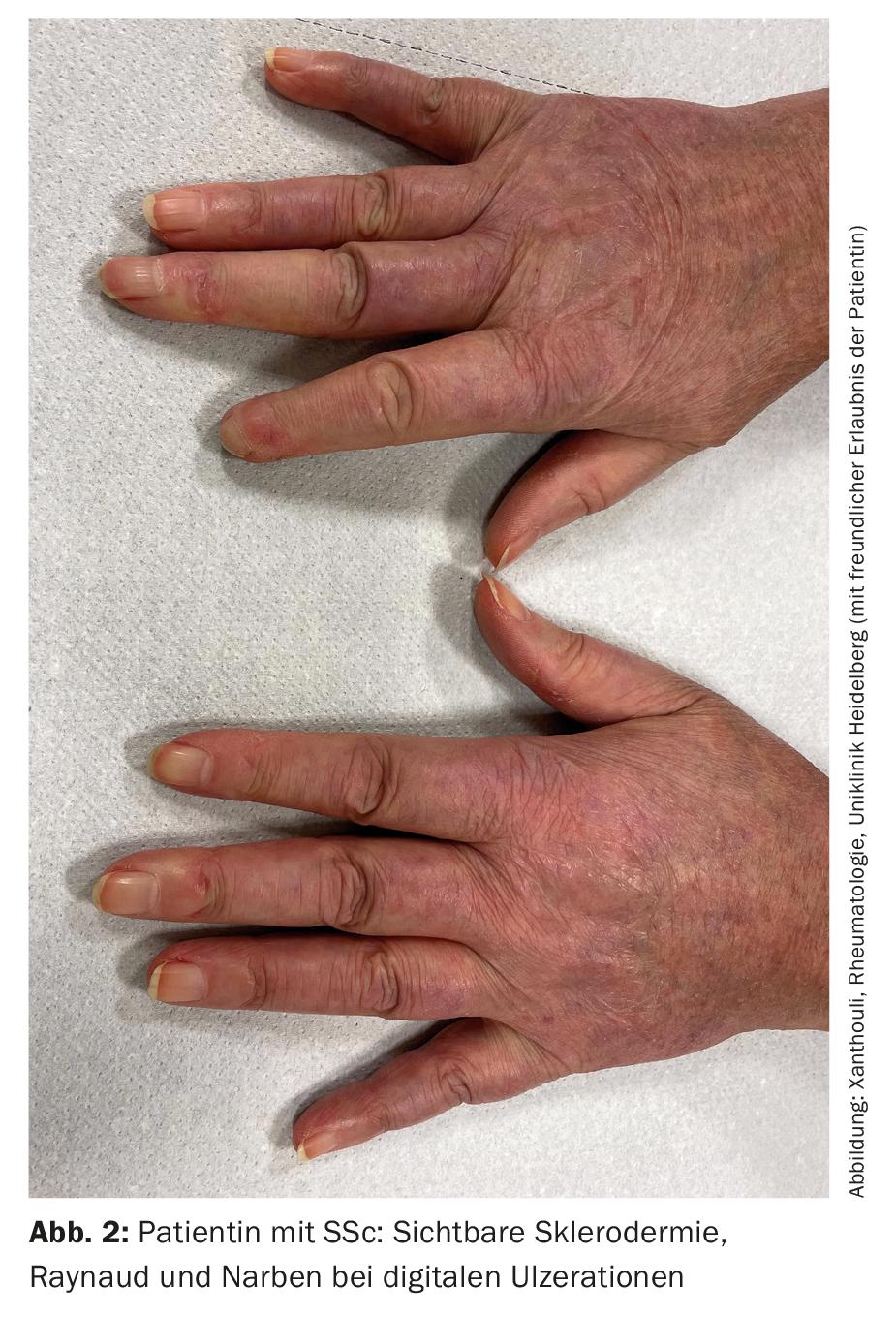
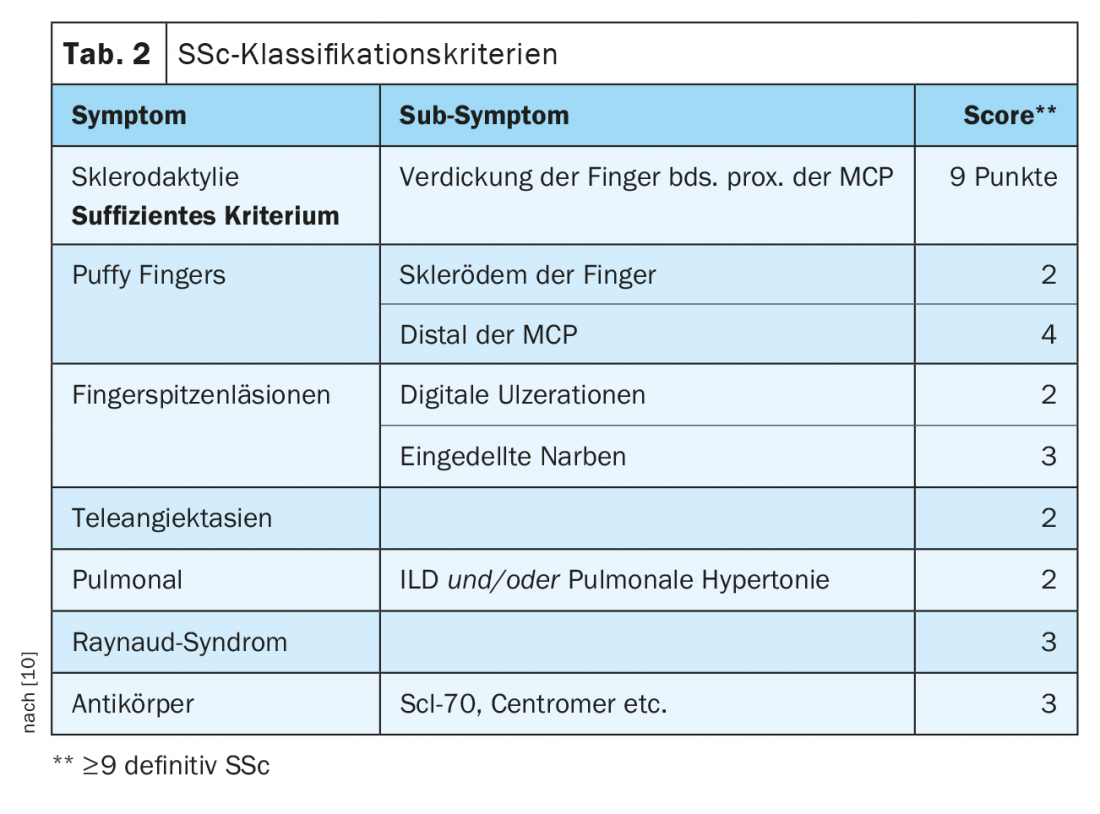
SSc-ILD: Cerca de 50-85% dos doentes com SSc já têm alterações pulmonares intersticiais no diagnóstico inicial. Em 20-30% dos casos, isto é progressivo no decurso da doença. ILD é actualmente a causa mais comum de morte em pacientes SSc, com uma mortalidade de 10 anos de cerca de 40% [1]. O diagnóstico precoce correcto e o reconhecimento da DPI são prognosticalmente relevantes [9]. Foram estabelecidos critérios de classificação para simplificar o diagnóstico (Tab. 2) [10]. Esclerodactilia, ulcerações digitais, sintomas de Raynaud e microstomia são sinais clínicos que devem sugerir imediatamente SSc (Fig. 2). O desenvolvimento e especialmente a progressão da doença ocorrem predominantemente durante os primeiros três anos da doença. Muitas vezes a DPI é assintomática na SSc. Recomenda-se que o rastreio por HRCT seja iniciado no diagnóstico inicial de SSc. São necessários testes de função pulmonar (pletismografia do corpo e medições da capacidade de difusão) a cada trimestre a meio ano. Os factores de risco para o desenvolvimento da DPI são o sexo masculino, a presença de esclerose cutânea sistémica difusa, a detecção de auto-anticorpos contra a Scl-70 e de origem afro-americana [11]. O refluxo, o envolvimento difuso da pele (e portanto uma pontuação de pele de Rodnan modificada mais elevada) e o sexo masculino são factores de risco para uma rápida progressão da DPI. No CT, um padrão NSIP está mais frequentemente presente, um padrão UIP é encontrado com menos frequência.
O tratamento é principalmente imunomodulador com antifibrótico complementar [1]. Com base nos resultados dos estudos SLS-I e -II, a terapia com ciclofosfamida ou micofenolato mofetil pode ser iniciada em SSc-ILD [12,13]. No estudo FocuSSed, o FVC melhorou no fenótipo inflamatório SSc com tocilizumabe (anticorpo contra o receptor IL-6). Tocilizumab recebeu portanto a aprovação da FDA para a indicação SSc-ILD, mas ainda é utilizada fora do rótulo na Europa [14]. Para rituximab (também ainda fora do rótulo), estão actualmente disponíveis bons dados para o tratamento de SSc-ILD a partir do estudo DESIRES [15]; os resultados finais do estudo RECITAL estão ainda pendentes. O estudo SCENCIS é o primeiro, maior, randomizado, duplo-cego, ensaio controlado para avaliar a eficácia da terapia antifibrótica com nintedanibe em doentes com SSc-ILD [16]. Nintedanib é aprovado pela FDA para o tratamento de SSc-ILD, mas funciona apenas para evitar a progressão do envolvimento pulmonar e não é adequado para o tratamento de outras manifestações SSc.
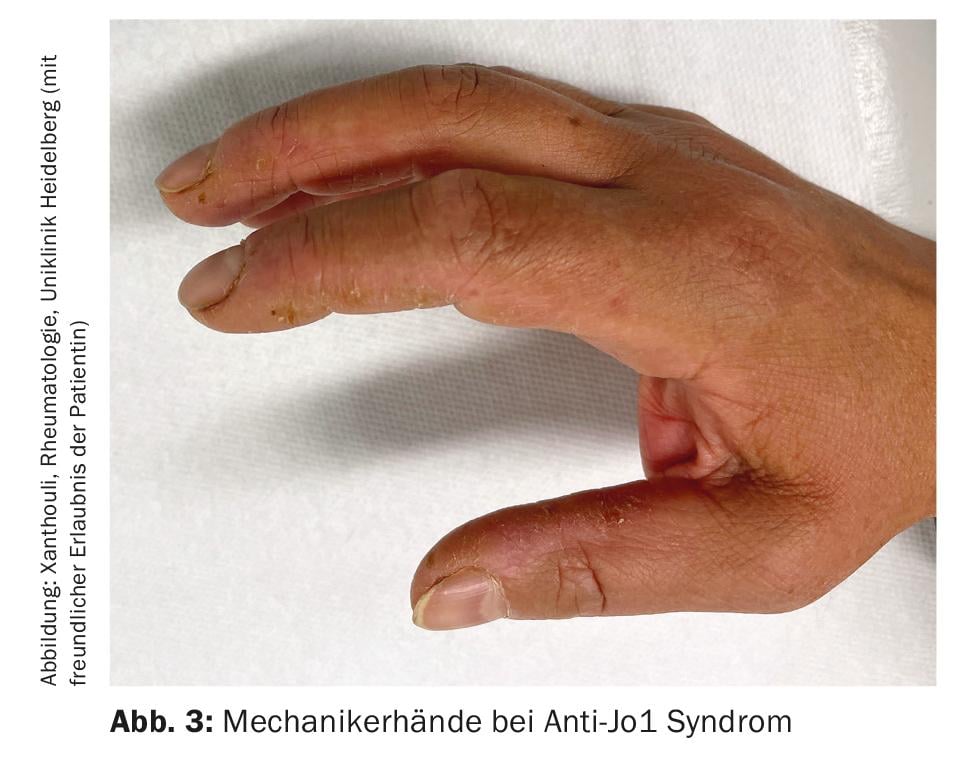
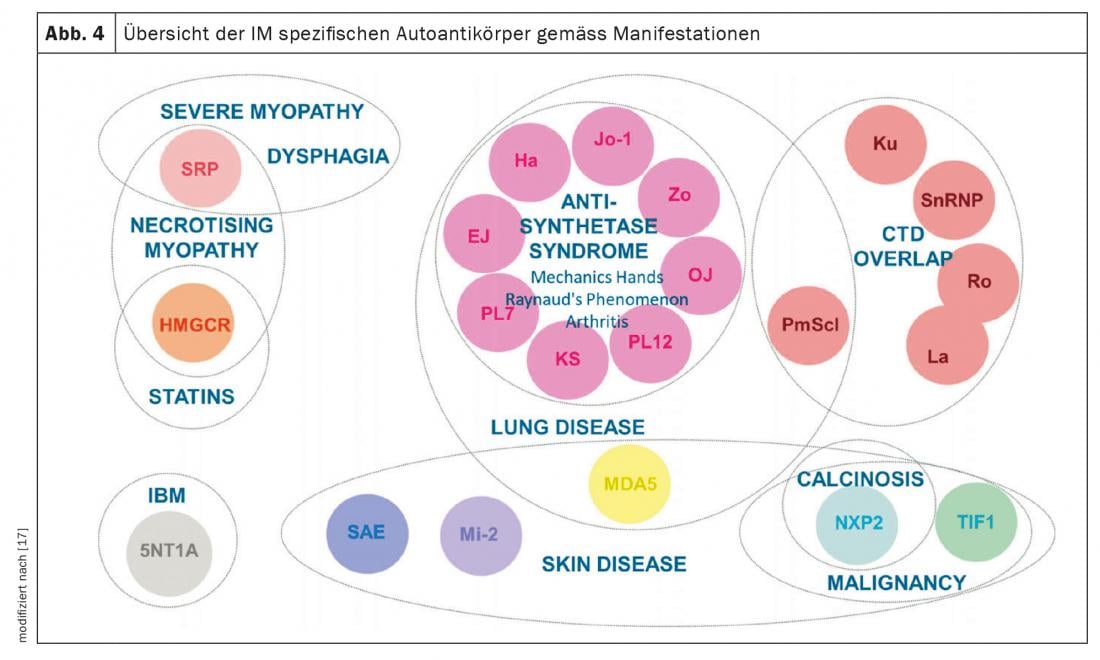
Miosite Inflamatória (MI): MI inclui síndrome antissintetase (ASD), dermato- e polimiosite, miosite corporal de inclusão e síndromes de sobreposição com outras colagenoses. Estes manifestam-se com e sem envolvimento muscular (miosite). Os pacientes com envolvimento muscular têm valores musculares excepcionalmente elevados no sangue (CK, creatina cinase) e mostram sinais patológicos na ressonância magnética do músculo e no exame neurofisiológico. Outras manifestações clínicas sugestivas de IM incluem as mãos do mecânico (Fig. 3) especialmente na síndrome anti-sintetase, artrites, exantema heliotropico na dermatomiosite, e o fenómeno de Raynaud. Até 70% dos doentes com ASA desenvolvem DPI. Além disso, ILD é a primeira manifestação da doença em um terço das pessoas com IM [7]. Os auto-anticorpos mais comuns na ASA são os anticorpos contra Jo-1, mas outros anticorpos, por exemplo contra PL12, PL7, Mi2, etc., são conhecidos e devem ser determinados se os sintomas são típicos. A detecção de anticorposMDA5 (melanoma differentiation accociated protein 5)no caso de envolvimento pulmonar pouco claro indica um curso rapidamente progressivo, terapêutico-refractário associado a uma mortalidade mais elevada, muitas vezes também sem miosite. Note-se a associação entre a malignidade e o IM. Isto é particularmente elevado para a detecção de TIFγ e anticorpos NXP2. Aqui, uma malignidade está presente em 30% dos casos, razão pela qual é indispensável um rastreio completo dos tumores (Fig. 4) [17].
O tratamento é principalmente com esteróides de alta dose com boa resposta, especialmente em pacientes mais jovens, aqueles com cirurgia, níveis elevados de CK e infiltrações de vidro de leite na TCAR. Em casos graves, deve ser considerado o início da terapia de pulso com ciclofosfamida. O tratamento com micofenolato, rituximab, tacrolimus, abatacept e inibidores JAK permanece fora do rótulo, embora estes sejam apoiados por bons resultados de estudos retrospectivos [18]. É também de notar que existe uma autorização de comercialização para a administração de imunoglobulinas intravenosas na miosite na UE [19]. Os doentes com anticorpos Jo-1 e provas de anticorpos anti-Ro-52 mostraram recentemente uma boa resposta ao rituximab no que diz respeito ao envolvimento de DPI, razão pela qual este deve ser considerado como uma opção de tratamento [20].
LES: As manifestações pulmonares multifacetadas do LES levam frequentemente a um diagnóstico tardio. Até 12% das pessoas afectadas poderiam desenvolver DPI no decurso da doença. Uma manifestação particularmente perigosa do LES é a síndrome hemorrágica pulmonar com hemoptise grave e deterioração respiratória rápida. Por outro lado, a dispneia grave, uma doença ventilatória restritiva com apraxia diafragmática sem a presença de DPI levanta suspeitas da presença de uma síndrome do pulmão encolhido difícil de tratar. A ecografia do tórax, a medição da força muscular respiratória e a espiroergometria podem ser úteis. O tratamento da DPI no LES é principalmente através da intensificação da imunossupressão. Os medicamentos antifibróticos podem ser utilizados em caso de progressão – em casos raros; uma autorização de introdução no mercado pois este está disponível para o nintedanib na UE [21].
Síndrome de Sjögren: Embora a maioria dos pacientes de Sjögren quase não exprima quaisquer sintomas pulmonares, em alguns casos, encontra-se um distúrbio de ventilação restritiva no diagnóstico da função pulmonar. A presença de sintomas objetáveis de doença com anticorpos SSA positivos é decisiva para o diagnóstico da doença subjacente [22]. Em 15% dos casos, a TCAR mostra um padrão LIP com alterações císticas difusas e bipulmonares com vidro de leite. A biopsia mostra um infiltrado linfocitário. No caso de massas intratorácicas pouco claras na síndrome de Sjögren primária, o linfoma deve ser considerado como um diagnóstico diferencial. O diagnóstico precoce da DPI associada a Sjögren é prognosticalmente relevante com uma sobrevivência de 5 anos de 88,5% [23].
Pneumonia Intersticial com Características Autoimunes (IPAF): Pacientes ILD com anticorpos antinucleares anormais (ANA) frequentemente presentes aos reumatologistas. Em 10-20% dos casos, estas são descobertas incidentais no decurso do diagnóstico de rastreio ILD. Na TCAR, um padrão NSIP é mais comum e as pessoas afectadas beneficiam significativamente dos esteróides. No entanto, outros sintomas indicativos de uma doença inflamatória e reumática raramente estão presentes. Neste caso, é necessário um cuidado combinado com um pneumologista e um reumatologista para identificar uma manifestação tardia de uma doença reumática inflamatória no tempo [7].
Outras doenças
Vasculípedes: Em doentes com granulomatose com poliangite (GPA), os granumolomas intrapulmonares podem muitas vezes ser detectados. A ILD pode desenvolver-se em casos raros. Em contraste, quando são detectados anticorpos contra a mieloperoxidase (MPO-ANCA), o ILD com um padrão predominantemente UIP é frequentemente descrito. Neste caso, deve ser feito um diagnóstico complementar em relação a outras manifestações de órgãos.
Colagenose mista: Estima-se que a incidência de DPI seja muito variável em 47-78%. Os indivíduos afectados têm anticorpos positivos de ANA e U1 RNP. No HRCT, pode estar presente um padrão NSIP, um padrão UIP ou infiltra-se no sentido de uma OP. O tratamento é principalmente com substâncias imunomoduladoras [7].
Outros tratamentos não medicinais e profilácticos
Todos os doentes com doenças reumáticas devem receber as vacinas recomendadas, especialmente contra COVID-19, gripe e pneumococos, e actualizá-las regularmente. Em fases avançadas da DPI, pode ocorrer insuficiência respiratória. A substituição do oxigénio é muitas vezes necessária durante o curso, começando com o exercício e possivelmente mais tarde em repouso. Para este fim, é normalmente realizada uma titulação para determinar a dose. Medidas de reabilitação, tais como desportos pulmonares e reumáticos, bem como medidas de reabilitação hospitalares ou ambulatórias, melhoram a situação clínica e a absorção de oxigénio das pessoas afectadas por doenças reumáticas inflamatórias e ainda são recomendadas. Se as opções terapêuticas se esgotarem, a listagem para transplante pulmonar deve ser considerada. Não existem directrizes claras sobre o momento exacto da apresentação para a listagem. No SSc, o transplante de células estaminais autólogas está a tornar-se cada vez mais importante, especialmente em cursos clínicos severos [24]. Se o transplante não for uma opção, o início de medidas paliativas e de alívio de sintomas deve ser considerado [25].
Resumo
As doenças reumáticas podem manifestar-se no parênquima pulmonar e levar ao desenvolvimento de doença pulmonar intersticial (DPI), entre outras coisas. As manifestações pulmonares podem preceder a doença reumática subjacente em cerca de 10% dos casos. Portanto, os reumatologistas estão envolvidos no conselho interdisciplinar do ILD para contribuir para o diagnóstico diferencial e determinação do algoritmo de tratamento. O prognóstico do OIDP reumatóide é limitado, mas a cooperação entre reumatologistas e pneumologistas pode melhorar significativamente a qualidade dos cuidados de saúde. Embora a patogénese do desenvolvimento de DPI permaneça pouco clara, o desenvolvimento de terapias medicamentosas para DPI reumatóides está a progredir. Tanto o reumatologista como o pneumologista devem ter sólidos conhecimentos e confiança na utilização de substâncias imunomoduladoras e antifibróticas.
Mensagens Take-Home
- As doenças reumáticas inflamatórias podem manifestar-se no parênquima pulmonar.
- Para diagnóstico e tratamento, há necessidade de uma estreita cooperação entre pneumologistas e reumatologistas.
- O tratamento é principalmente imunossupressor.
- Desde 2020, a substância antifibrótica nintedanib foi aprovada para o tratamento da SSc-ILD com base nos resultados do ensaio do SENSCIS. O medicamento é também utilizado para o tratamento de ILD progressivo (estudo INBUILD).
Literatura:
- Wijsenbeek M, Cottin V: Espectro de Doenças Pulmonares Fibróticas. N Engl J Med 2020; 383: 958-968; doi: 10.1056/NEJMra2005230.
- Raghu G, Remy-Jardin M, Richeldi L et al: Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2022; 205: e18-e47; doi: 10.1164/rccm.202202-0399ST.
- Kreuter M, Ladner UM, Costabel U, et al: The Diagnosis and Treatment of Pulmonary Fibrosis. Dtsch Arztebl Int 2021; 118; doi: 10.3238/arztebl.m2021.0018.
- Aletaha D, Neogi T, Silman AJ, et al: 2010 critérios de classificação da artrite reumatóide: uma iniciativa colaborativa do Colégio Americano de Reumatologia/Liga Europeia Contra o Reumatismo. Ann Rheum Dis 2010; 69: 1580-1588; doi: 10.1136/ard.2010.138461.
- Duarte AC, Porter JC, Leandro MJ: O pulmão numa coorte de pacientes com artrite reumatóide – uma visão geral dos diferentes tipos de envolvimento e tratamento. Rheumatology (Oxford) 2019; 58: 2031-2038; doi: 10.1093/rheumatology/kez177.
- Mena-Vázquez N, Rojas-Gimenez M, Romero-Barco CM, et al: Predictors of Progression and Mortality in Patients with Prevalent Rheumatoid Arthritis and Interstitial Lung Disease: A Prospective Cohort Study. J Clin Med 2021; 10(4): 874.
- Bastian HKA: Doenças pulmonares – Doenças pulmonares intersticiais. Lei Rheumatol 2021; 46: 544-551.
- Flaherty KR, Wells AU, Cottin V, et al: Nintedanib em Doenças Pulmonares Intersticiais por Fibrosão Progressiva. N Engl J Med 2019; 381: 1718-1727; doi: 10.1056/NEJMoa1908681.
- Xanthouli P, Hermann W, Hunzelmann N, et al: Scleroderma-associated interstitial lung disease. O Pneumologista 2018; 15: 383-395.
- van den Hoogen F, Khanna D, Fransen J, et al: 2013 classification criteria for systemic sclerosis: an American college of rheumatology/European league against rheumatism collaborative initiative. Ann Rheum Dis 2013; 72: 1747-1755; doi: 10.1136/annrheumdis-2013-204424.
- Distler O, Volkmann ER, Hoffmann-Vold AM, et al: Perspectivas actuais e futuras na gestão da doença pulmonar intersticial associada à esclerose sistémica. Perito Rev Clin Immunol 2019; 15: 1009-1017; doi: 10.1080/1744666X.2020.1668269.
- Tashkin DP, Elashoff R, Clements PJ, et al: Cyclophosphamide versus placebo na esclerodermia da doença pulmonar. N Engl J Med 2006; 354: 2655-2666; doi: 10.1056/NEJMoa055120.
- Tashkin DP, Roth MD, Clements PJ, et al: Micofenolato mofetil versus ciclofosfamida oral na doença pulmonar intersticial relacionada com esclerodermia (SLS II): um ensaio de grupo paralelo, duplo-cego, controlado aleatoriamente. Lancet Respir Med 2016; 4: 708-719; doi: 10.1016/S2213-2600(16)30152-7.
- Khanna D, Lin CJF, Furst DE, et al: Tocilizumab em esclerose sistémica: um ensaio aleatório, duplo-cego, controlado por placebo, fase 3. Lancet Respir Med 2020; 8(10): 963-974.
- Ebata S, Yoshizaki A, Oba K, et al: Segurança e eficácia do rituximab na esclerose sistémica (DESIRES): um ensaio duplo-cego, iniciado por um investigador, aleatorizado e controlado por placebo. The Lancet Rheumatology 2021; 3: E489-E497; doi: 10.1016/S2665-9913(21)00107-7.
- Distler O, Highland KB, Gahlemann M, et al: Nintedanib para a Esclerose Sistémica – Doença Pulmonar Intersticial Associada. N Engl J Med 2019; 380(26): 2518-2528.
- Betteridge Z, McHugh N: Autoanticorpos específicos da miosite: uma ferramenta importante para apoiar o diagnóstico da miosite. J Intern Med 2016; 280: 8-23; doi: 10.1111/joim.12451.
- Mehta P, Aggarwal R, Porter JC, et al: Gestão da doença pulmonar intersticial (DPI) nas síndromes de miosite: Um guia prático para os clínicos. Best Pract Res Clin Rheumatol 2022; 101769; doi: 10.1016/j.berh.2022.101769.
- Aggarwal R, Charles-Schoeman C, Schessl J, et al: Estudo prospectivo, duplo-cego, randomizado e controlado por placebo fase III avaliando a eficácia e segurança da octogâmia 10% em doentes com dermatomiosite (“Estudo ProDERM”). Medicine (Baltimore) 2021; 100: e23677; doi: 10.1097/MD.0000000000023677.
- Bauhammer J, Blank N, Max R, et al: Rituximab in the Treatment of Jo1 Antibody-associated Antisynthetase Syndrome: Anti-Ro52 Positivity as a Marker for Severity and Treatment Response. J Rheumatol 2016; 43: 1566-1574; doi: 10.3899/jrheum.150844.
- Medlin JL, Hansen KE, McCoy SS, et al: Manifestações pulmonares em lúpus eritematoso sistémico tardio versus precoce: Uma revisão sistemática e meta-análise. Semin Arthritis Rheum 2018; 48: 198-204; doi: 10.1016/j.semarthrit.2018.01.010.
- Shiboski CH, Shiboski SC, Seror R, et al: 2016 American College of Rheumatology/European League Against Rheumatism Classification Criteria for Primary Sjogren’s Syndrome: A Consensus and Data-Driven Methodology Involving Three International Patient Cohorts. Artrite Rheumatol 2017; 69: 35-45; doi: 10.1002/art.39859.
- Gao H, Zhang XW, He J, et al: Prevalência, factores de risco e prognóstico de doença pulmonar intersticial numa grande coorte de doentes com síndrome de Sjogren primária chinesa: Um estudo de caso-controlo. Medicina (Baltimore) 2018; 97: e11003; doi: 10.1097/MD.0000000000011003.
- Farge D, Ait Abdallah N, Marjanovic Z, et al: Transplante de células estaminais autólogas em esclerodermia. Imprensa Med 2021; 50: 104065; doi: 10.1016/j.lpm.2021.104065.
- Kreuter M, Bendstrup E, Russell AM, et al: Cuidados paliativos na doença pulmonar intersticial: viver bem. Lancet Respir Med 2017; 5: 968-980; doi: 10.1016/S2213-2600(17)30383-1.
InFo PNEUMOLOGIA & ALERGOLOGIA 2022; 4(3): 8-13