Em hematologia, a reunião anual da Associação Europeia de Hematologia é uma das datas do calendário anual. A associação promove a excelência nos cuidados aos doentes, na investigação e na educação em hematologia. Assim, o congresso transmite as descobertas e os resultados de investigação mais recentes e inovadores no domínio das doenças hematológicas. Abrangerá a investigação e a prática clínicas, a investigação básica e translacional e as abordagens mais recentes em matéria de diagnóstico e tratamento.
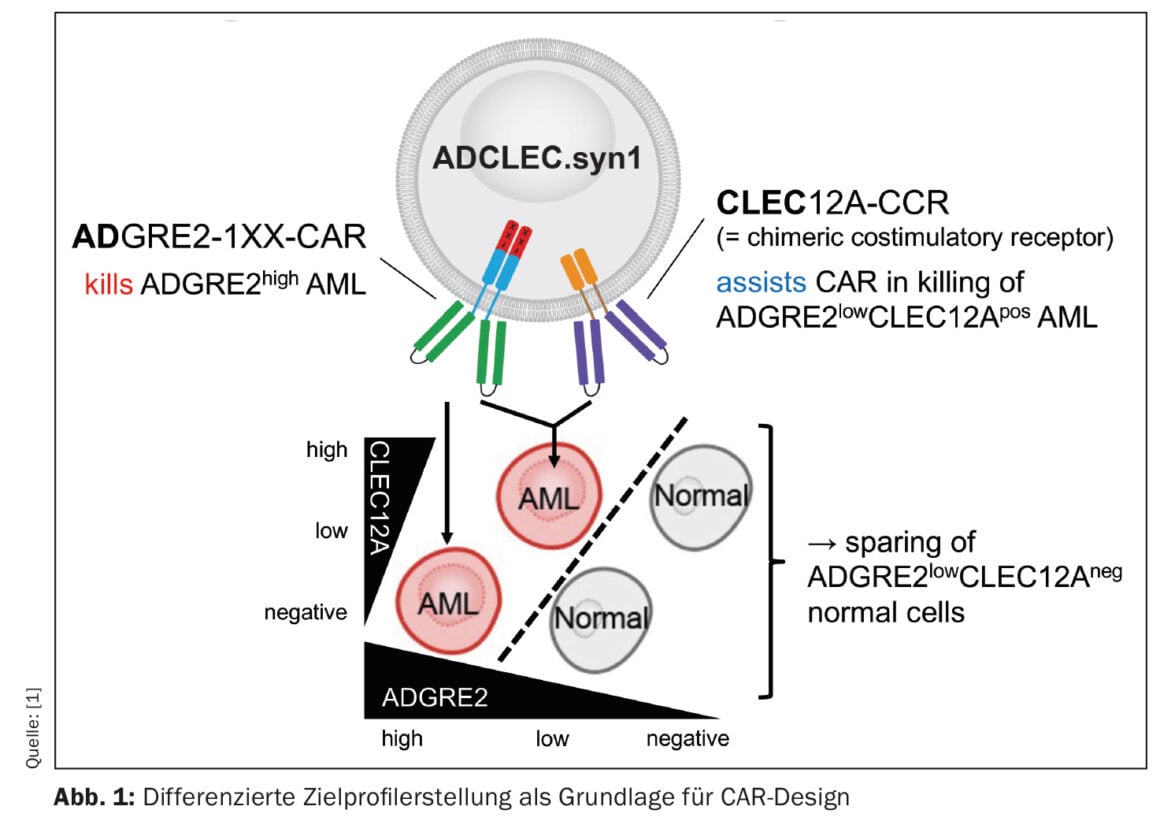
Uma nova terapia CAR para a leucemia mieloide aguda (LMA) está a ser investigada por um grupo de investigadores cujos resultados pré-clínicos são encorajadores [1]. O conceito denominado ADCLEC.syn1 utiliza receptores cooperativos que visam ADGRE2 e CLEC12A. Desta forma, a LMA deve ser eliminada e as toxicidades hematológicas minimizadas ao mesmo tempo. Este facto foi demonstrado por uma série exaustiva de modelos de eficácia e toxicidade in vivo. As terapias CAR para a LMA enfrentam obstáculos devido à heterogeneidade clonal e à semelhança com a hematopoiese inicial normal, o que pode levar à fuga do antigénio e a toxicidades hematológicas. O presente estudo investigou a expressão quantitativa de alvos de superfície na LMA e em tecidos normais para determinar janelas terapêuticas que podem ser exploradas por novas concepções combinatórias de CAR. Assim, foi desenvolvida a ADCLEC.syn1, uma nova terapia CAR combinatória que tem como alvo conjunto ADGRE2 e CLEC12A para a eliminação selectiva de células de LMA com baixos níveis de ADGRE2 e poupando as células estaminais e progenitoras hematopoiéticas normais (Fig. 1). Os investigadores correlacionaram a expressão do antigénio alvo com a eficácia das células T ADCLEC.syn1 e CD33-CAR utilizando xenoenxertos de LMA. Os resultados mostraram que o ADCLEC.syn1 induziu uma remissão duradoura em várias linhas celulares de LMA humanas representativas dos fenótipos de doentes com LMA recidivante/refractária. No entanto, os ratinhos a quem foram administrados enxertos de LMA e reconstituídos com células hematopoiéticas humanas normais responderam apenas ao ADCLEC.syn1, mas não ao CD33-CAR. Estes resultados realçam a importância da caraterização quantitativa dos alvos CAR na LMA. O ADCLEC.syn1 está agora a ser investigado num primeiro ensaio clínico de Fase I em humanos para LMA recidivante/refractária.
Progressos na APL
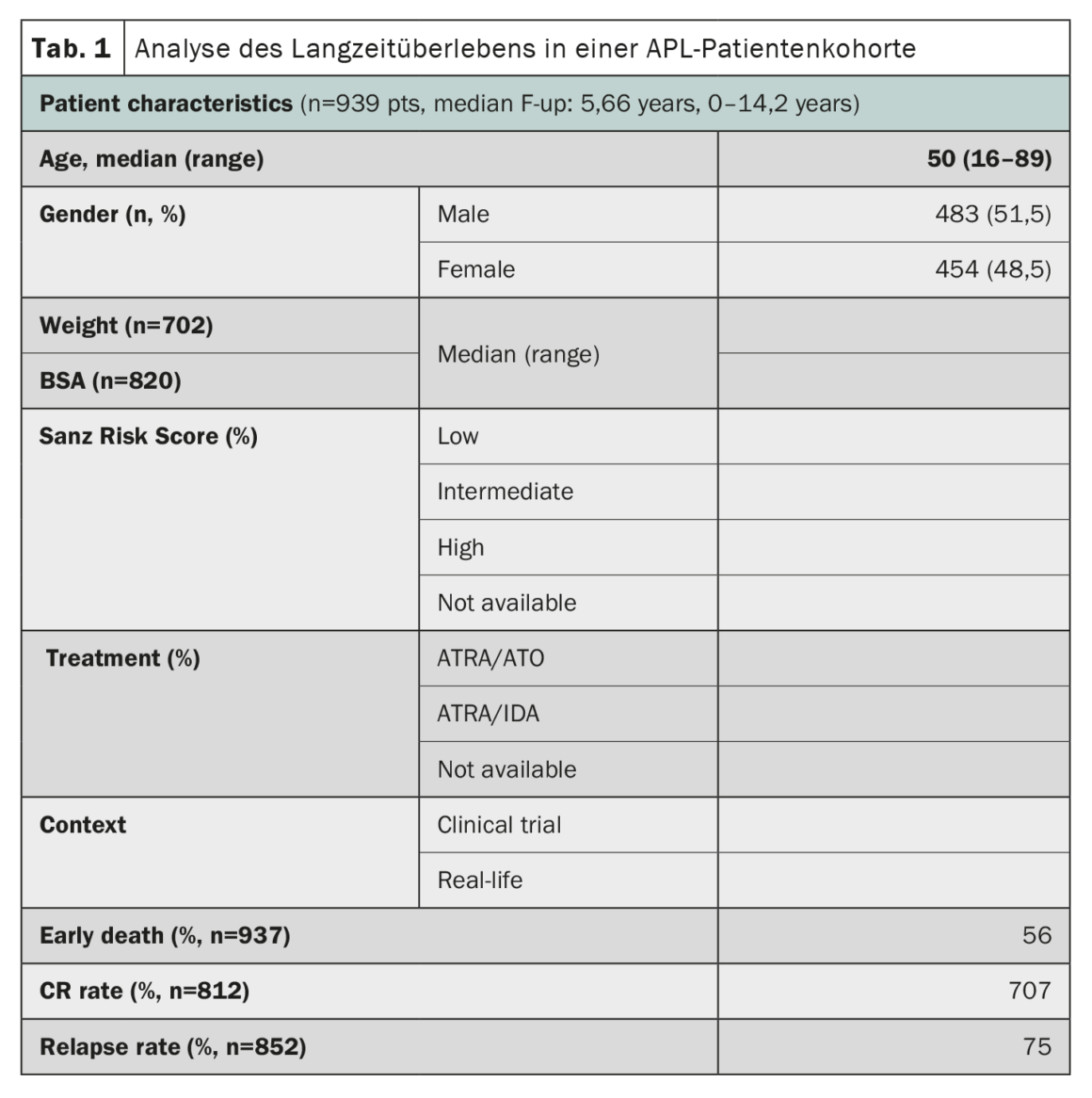
A leucemia promielocítica aguda (LPA), outrora considerada uma das formas mais rapidamente fatais de leucemia mieloide aguda, tem registado progressos notáveis nos resultados do tratamento. Um estudo que utilizou dados do registo HARMONY com uma grande coorte de doentes confirmou que a terapêutica combinada de ácido trans-retinóico (ATRA) e trióxido de arsénio (ATO) resultou em taxas de sobrevivência global a 10 anos de 85-92% em doentes com APL [2]. O registo HARMONY inclui 1868 doentes com APL, provenientes de dois ensaios clínicos e de registos nacionais em seis países, diagnosticados entre 2007 e 2020. Destes, 937 doentes cumpriram os requisitos de qualidade dos dados e foram incluídos na presente análise. Os dados foram harmonizados utilizando um modelo de dados comum da Observational Medical Outcomes Partnership e registados na HARMONY Big Data Platform. Os resultados da análise mostraram que os doentes tratados com o regime ATRA-ATO tinham uma taxa de sobrevivência global (OS) a 10 anos de 92% em comparação com 75% para os doentes tratados com o regime ATRA-idarubicina (AIDA) (Tab. 1). O benefício de sobrevivência foi o mesmo nos diferentes grupos de risco definidos pela pontuação de risco de Sanz. A idade também desempenhou um papel importante na sobrevivência, com os doentes mais jovens (<50 anos) a obterem melhores resultados. No entanto, a taxa de mortes precoces (<30 dias após o diagnóstico) foi semelhante em ambos os grupos (3,4%-5,7%). Globalmente, estes resultados numa grande coorte internacional de doentes confirmam o benefício significativo em termos de sobrevivência da terapêutica ATRA-ATO sem quimioterapia para doentes com APL, independentemente do seu perfil de risco, e fornecem informações valiosas para o tratamento de APL.
Cura funcional em TDT?
Os resultados provisórios iniciais são encorajadores [3]: Um ensaio de fase III com autotemcel exagamglogénico (exa-cel), uma terapia celular não viral, está a aumentar a esperança de uma cura funcional única para doentes com β-talassemia dependente de transfusão (TDT). Foram registados resultados significativos na independência da transfusão, na melhoria dos níveis de hemoglobina e na qualidade de vida. O Exa-cel reactiva a síntese de hemoglobina fetal (HbF) através da edição genética ex vivo CRISPR/Cas9, visando o gene BCL11A em células estaminais e progenitoras hematopoiéticas CD34+ autólogas. Dos 48 pacientes TDT que receberam exa-cel, 27 foram avaliados para os pontos finais do estudo na análise interina pré-especificada. Aqueles que foram independentes de transfusão durante ≥12 meses tiveram um tempo médio para a última transfusão de 37 dias após a infusão de exa-cel e permaneceram sem transfusão durante 12,1-40,7 meses. Os níveis de hemoglobina, bem como os alelos BCL11A editados nas células CD34+ da medula óssea e nas células sanguíneas nucleadas periféricas, mantiveram-se estáveis ao longo do tempo.
O estudo também observou melhorias significativas na qualidade de vida e um enxerto bem sucedido de neutrófilos e plaquetas em todos os doentes, realçando a eficácia da terapia. O perfil de segurança do exa-cel foi consistente com o regime de condicionamento mieloablativo à base de busulfan e com os procedimentos de transplante autólogo, com eventos adversos controláveis. Todos os eventos adversos graves foram resolvidos e não se registaram mortes, desistências do estudo ou doenças malignas.
Eritrocitose não controlada na policitemia vera
O estudo REVIVE investigou a eficácia do rusfertide, um novo mimético da hepcidina, em doentes com policitemia vera (PV) [4]. O rusfertide inibe a produção de glóbulos vermelhos em doentes com PV ao limitar a disponibilidade de ferro. O estudo utilizou uma proteína sintética semelhante à hepcidina, que é normalmente produzida pelo fígado e regula o transporte de ferro, para tratar a eritrocitose associada à PV (produção excessiva de glóbulos vermelhos). A fase de retirada aleatória de 12 semanas do estudo cumpriu o objetivo primário e demonstrou a elevada eficácia do rusfertide no controlo da eritrocitose – uma caraterística fundamental da PV que aumenta o risco de complicações tromboembólicas e cardiovasculares.
O estudo de fase II incluiu doentes diagnosticados com PV de acordo com os critérios da OMS de 2016 e que necessitaram de um número excessivo de flebotomias terapêuticas (TP) em doentes tratados apenas com TP ou com agentes de citorredução (CYTO). O rusfertide, administrado por via subcutânea uma vez por semana, foi adicionado à terapia PV anterior. Durante a fase de retirada, os doentes foram aleatorizados para continuar a terapêutica com rusfertide durante 12 semanas ou para receber um placebo. Os dados da fase de retirada aleatória mostraram a eficácia superior do rusfertide em comparação com o placebo. Os doentes apresentaram uma taxa de resposta estatisticamente significativa (sem TP) de 69,2% contra 18,5% no grupo do placebo. Além disso, a terapêutica com rusfertide foi associada a um controlo sustentado do hematócrito (HCT) em comparação com o placebo. A taxa de ausência de TP nos doentes atingiu 92,3%. O tratamento foi geralmente bem tolerado, sendo a maioria dos acontecimentos adversos reacções no local da injeção de gravidade ligeira a moderada que diminuíram com a continuação do tratamento.
Os resultados positivos demonstram a eficácia e a tolerabilidade do rusfertide como uma terapia altamente eficaz para a eritrocitose não controlada e sintomas associados na PV e representam um avanço significativo no tratamento desta neoplasia mieloproliferativa maligna. O composto oferece uma nova abordagem baseada num mimético hormonal que visa seletivamente a eritrocitose não controlada, proporcionando um controlo sustentado e duradouro do HCT e uma melhoria dos sintomas relacionados com a PV.
Tratamento da anemia na LR-MDS
O ensaio de fase III COMMANDS mostrou resultados promissores no tratamento da anemia associada a síndromes mielodisplásicas de baixo risco (LR-MDS) [5]. Numa análise provisória pré-planeada, o luspatercept mostrou benefícios clínicos significativos em doentes com LR-MDS sem ESA, em comparação com o tratamento padrão com epoetina alfa. Estes resultados têm o potencial de alterar o panorama do tratamento de doentes com LR-MDS que dependem de transfusões. Os doentes com LR-MDS que sofrem de anemia crónica sofrem de morbilidade acrescida, sobrecarga de ferro e sobrevivência reduzida. O padrão atual de tratamento, os agentes estimuladores da eritropoiese (ESAs), obtêm apenas resultados subótimos nestes doentes. A análise intermédia avaliou a eficácia e a segurança do luspatercept e da epoetina alfa em 356 doentes com LR-MDS sem ESA e dependentes de transfusão. O endpoint primário do estudo foi a obtenção de independência da transfusão de glóbulos vermelhos (RBC-TI) durante ≥12 semanas com um aumento simultâneo da hemoglobina média de pelo menos 1,5 g/dL durante as primeiras 24 semanas. 59% dos doentes tratados com luspatercept obtiveram RBC-TI e aumento concomitante da hemoglobina, em comparação com 31% no grupo da epoetina-alfa. O benefício clínico foi observado em todos os subgrupos. O cumprimento dos objectivos secundários foi também favorável ao luspatercept, incluindo a melhoria hematológica. Os doentes com mutações genéticas específicas associadas à MDS, tais como SF3B1, SF3B1a, ASXL1 e TET2, responderam melhor do que a média ao luspatercept, independentemente da sua carga global de mutações. O luspatercept teve um perfil de segurança favorável, com acontecimentos adversos ligeiros a moderados relacionados com o tratamento. A taxa de mortalidade global foi semelhante nos grupos do luspatercept e da epoetina alfa.
Tratar a LLC de forma eficaz
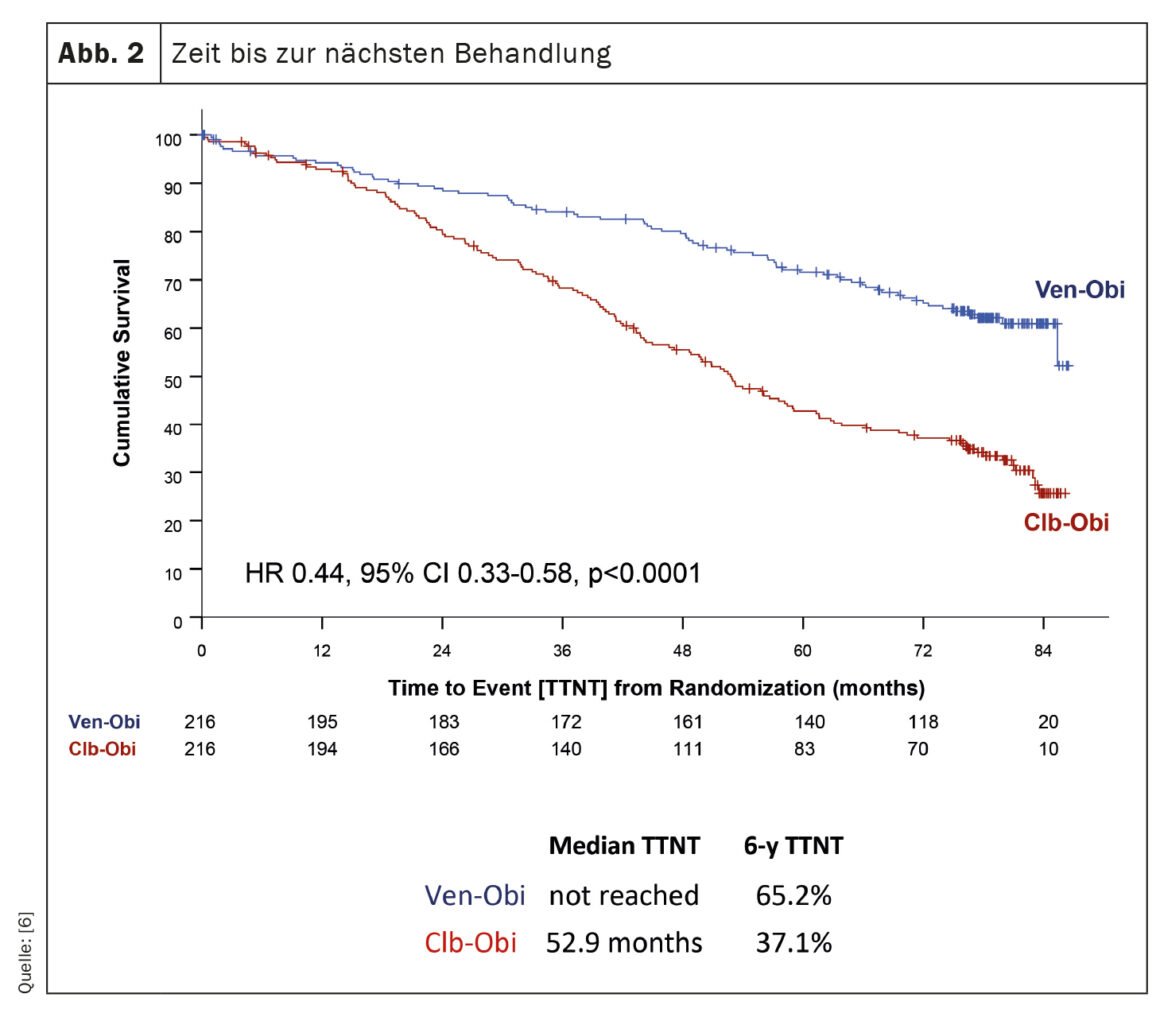
O estudo CLL14, uma investigação sobre o tratamento da leucemia linfocítica crónica (LLC), forneceu resultados recentes sobre os resultados a longo prazo dos doentes tratados com venetoclax-obinutuzumab (Ven-Obi) [6]. Os resultados demonstram uma eficácia e segurança sustentadas e poderão estabelecer o Ven-Obi como a opção de tratamento preferida para os doentes com LLC, incluindo aqueles com doença concomitante. Neste estudo em curso, 432 doentes com LLC não tratados previamente foram aleatoriamente seleccionados para tratamento com Ven-Obi ou clorambucil-obinutuzumab (Clb-Obi). Após um seguimento mediano de 76,4 meses, o Ven-Obi apresentou uma melhor sobrevivência livre de progressão (PFS) do que o Clb-Obi (PFS mediana 76,2 vs. 36,4 meses). É importante salientar que, mesmo após seis anos, a taxa de PFS estimada para o Ven-Obi foi de 53,1% em comparação com 21,7% para o Clb-Obi. O estudo também demonstrou que o Ven-Obi resultou num tempo significativamente mais longo até ao próximo tratamento (TTNT) em comparação com o Clb-Obi (TTNT a 6 anos 65,2% vs. 37,1%) (Fig. 2). Estes resultados positivos foram observados em todos os grupos de risco, incluindo doentes com características de CLL de alto risco. Além disso, o Ven-Obi demonstrou uma excelente resposta à doença residual mínima (DRM), com 7,9% dos doentes sem níveis detectáveis de DRM cinco anos após o tratamento, em comparação com 1,9% com o Clb-Obi. Não foram detectados novos sinais de segurança.
O Ven-Obi oferece uma remissão sustentada, taxas elevadas de doença residual mínima indetetável e um tempo alargado até ao próximo tratamento. Mais de metade dos doentes continuam em remissão cinco anos após o fim do tratamento e a maioria não necessita de tratamento de segunda linha.
Hemocromatose hereditária
A homozigotia para a variante C282Y do HFE causa hemocromatose hereditária, que pode potencialmente levar a diabetes, doenças hepáticas e cardíacas. Um estudo testou agora se a homozigotia C282Y aumenta o risco de diabetes, doença hepática e doença cardíaca, mesmo em pessoas com ferro plasmático, saturação de transferrina ou ferritina normais [7]. Também investigou se os homozigotos C282Y com diabetes, doença hepática ou doença cardíaca têm um risco acrescido de morte em comparação com os não portadores destas doenças. Um total de 132 542 indivíduos consecutivos de uma coorte da população geral foram submetidos a genotipagem para a variante HFE C282Y e foram encontrados 422 homozigotos. Os indivíduos foram seguidos prospectivamente durante um período máximo de 27 anos. A informação sobre os contactos hospitalares provém do registo nacional de doentes, que regista todos os hospitais dinamarqueses.
Durante o período de acompanhamento, 17 688 pessoas morreram por qualquer causa, enquanto 7702, 2804 e 21 769 pessoas foram hospitalizadas por diabetes, doença hepática e doença cardíaca, respetivamente. Ao comparar os homozigotos C282Y com os não portadores, os rácios de risco foram de 1,66 para a diabetes, 2,16 para a doença hepática e 0,98 para a doença cardíaca. O risco de diabetes estava aumentado mesmo nos homozigotos C282Y com ferro, saturação de transferrina ou ferritina normais (4,35; 1,81-10,48). Os homozigotos C282Y com diabetes apresentaram um rácio de risco de morte por qualquer causa de 1,94 em comparação com os não portadores com diabetes. A percentagem de todas as mortes nos homozigotos C282Y que poderiam teoricamente ser evitadas se uma única doença fosse eliminada foi de 27,3% para a diabetes e de 14,4% para a doença hepática. Os resultados sugerem que a atual estratégia de tratamento da hemocromatose, que se centra na redução da ferritina, é insuficiente para reduzir o risco de diabetes e o risco de morte por diabetes.
Congresso da Associação Europeia de Hematologia (EHA) 2023
Literatura:
- Hauber S, et al.: Novel CAR Therapy for Acute Myeloid Leukemia Targeting ADGRE2 and CLEC12A Shows Favorable Pre-Clinical Outcomes. S104. 10.06.2023. EHA 2023.
- Voso MT, et al.: ATRA-ATO Regimen Provides Significant Survival Advantage for Patients with Acute Promyelocytic Leukemia. S136. 11.06.2023. EHA 2023.
- Locatelli F, et al.: Exagamglogene Autotemcel: A Potential One-Time Functional Cure for Patients with Transfusion-Dependent β-Thalassemia. S270. 11.06.2023. EHA 2023.
- Hoffman R, et al.: Rusfertide Therapy Serves as a Novel Effective Treatment for Uncontrolled Erythrocytosis in Polycythemia Vera. LB2710. 11.06.2023. EHA 2023
- Della Porta MG, et al.: Luspatercept Is Superior to Epoetin Alfa in Treating Anemia in Lower-Risk Myelodysplastic Syndromes. S102. 10.06.2023. EHA 2023.
- Al-Sawaf O, et al.: Long-Term CLL14 Study Confirms Venetoclax-Obinutuzumab as Effective Treatment for Chronic Lymphocytic Leukemia. S145. 09.06.2023. EHA 2023.
- Mottelson M, et al.: Individuals with HFE C282Y Homozygosity and Diabetes habe almost two-fold risk of death compared to non-carriers with diabetes: A prospective study of a 132,542-individual general population cohort. S280. EHA 2023.
InFo ONKOLOGIE & HÄMATOLOGIE 2023; 11(3): 26–28