O angiossarcoma associado à radiação é mais comum do que intuitivamente se esperava. O diagnóstico inicial deve ser feito o mais cedo possível. Paradoxalmente, mesmo com este tumor induzido por radiação, a radiação é uma boa opção terapêutica.
O angiossarcoma associado à radiação (RAAS) é tão raro que não há estudos prospectivos. Portanto, todas as conclusões anteriores são baseadas em séries de casos retrospectivos e relatórios de casos. Devido à publicação selectiva dos casos, as recomendações terapêuticas baseadas nos mesmos só podem ser feitas com cautela. Por outro lado, é preciso contentar-se com isto até que um maior número de casos e observações a longo prazo de registos de tumores, alguns dos quais apenas estão a ser estabelecidos, estejam disponíveis.
Os angiossarcomas são tumores altamente malignos das células endoteliais, que representam apenas cerca de 1-2% de todos os sarcomas de tecido mole [1]. O angiossarcoma da mama pode ser primário ou secundário a um linfedema crónico após mastectomia (síndrome de Stewart-Treves) [2] ou dentro de um RAAS dentro de um campo de radiação anterior [3]. Os angiossarcomas primários parecem ter um prognóstico melhor do que o RAAS [4–6]. Os critérios modificados de Cahan são normalmente utilizados para diferenciação [7,8]. Estes incluem:
- histologia diferente do tumor primário inicial e do tumor secundário
- Desenvolvimento do tumor secundário no campo de irradiação anterior
- Latência entre o tumor primário e o secundário de mais de três anos.
Geralmente, é relatada uma latência média de seis anos entre a radioterapia (RT) do tumor primário e o início da RAAS [1,9]. Este período de tempo é significativamente mais curto em comparação com outros sarcomas associados à radiação, que normalmente só aparecem após 10-20 anos [10,11]. Uma certa disposição genética pode ser assumida, embora não tenha sido provada [12].
Uma análise da base de dados SEER de quase 275.000 doentes com cancro da mama mostrou uma incidência acumulada de RAAS de 0,09% após 15 anos [9]. Isto parece estar a aumentar devido à RT adjuvante realizada rotineiramente após terapia de conservação da mama (BET) para o carcinoma da mama ou DCIS [1]. A medida em que as terapias sistémicas intensificadas contribuem para a génese permanece pouco clara.
A taxa de sobrevivência de 5 anos é baixa e é reportada como sendo de 27-35% com base na base de dados SEER [9]. As razões para este mau prognóstico são múltiplas. As descolorações vermelho-lívidas, parcialmente bidimensionais que aparecem no antigo campo de irradiação, atraem a atenção do paciente demasiado tarde. Para além da infestação macroscópica, uma metástase microscópica oculta em forma de “salto de pulga” na pele ocorre cedo. Isto dificilmente pode ser contrariado cirurgicamente, uma vez que se pode manifestar rapidamente de novo noutro local após a excisão dos resultados macroscópicos [10,13,14].
As recomendações terapêuticas uniformes não existem. O foco é o procedimento cirúrgico. A maior revisão até à data baseada em 222 pacientes com um RAAS mostra um intervalo de 5 anos sem recorrência local de 32% e uma taxa de sobrevivência de 5 anos de 43% [1], que é mais elevada em comparação com a base de dados SEER (27-35%). Isto deve-se provavelmente ao facto de os pacientes analisados terem vindo de relatórios de casos e séries de casos com respostas predominantemente excepcionais e terapias combinadas, e o prognóstico é assim sobrestimado devido ao enviesamento da publicação. Pelo contrário, isto pode indicar uma possível melhoria no prognóstico através de terapias combinadas.
Relatório de caso
Relatamos um paciente que tem agora 79 anos de idade e tem um RAAS. 11/2006 foi diagnosticado um carcinoma ductal invasivo da mama à esquerda. BET foi realizada com tumorectomia e linfadenectomia axilar sentinela com uma fase de pT1c pN0 (0/1 sn) cMO ER/PR positivo, HER2 negativo. Postoperativamente, a RT normofraccionada adjuvante de todo o peito foi realizada com campos tangenciais até 50 Gy e um impulso local de 16 Gy seguido de terapia hormonal.
08/2011 a paciente notou uma grande descoloração amarelo-lívida em toda a mama esquerda, com flare-ups de grumos e exulcerações incipientes. O mamilo já não era reconhecível (Fig. 1). Histologicamente, um hemangiossarcoma mal diferenciado (G3) foi detectado e confirmado por uma segunda avaliação.
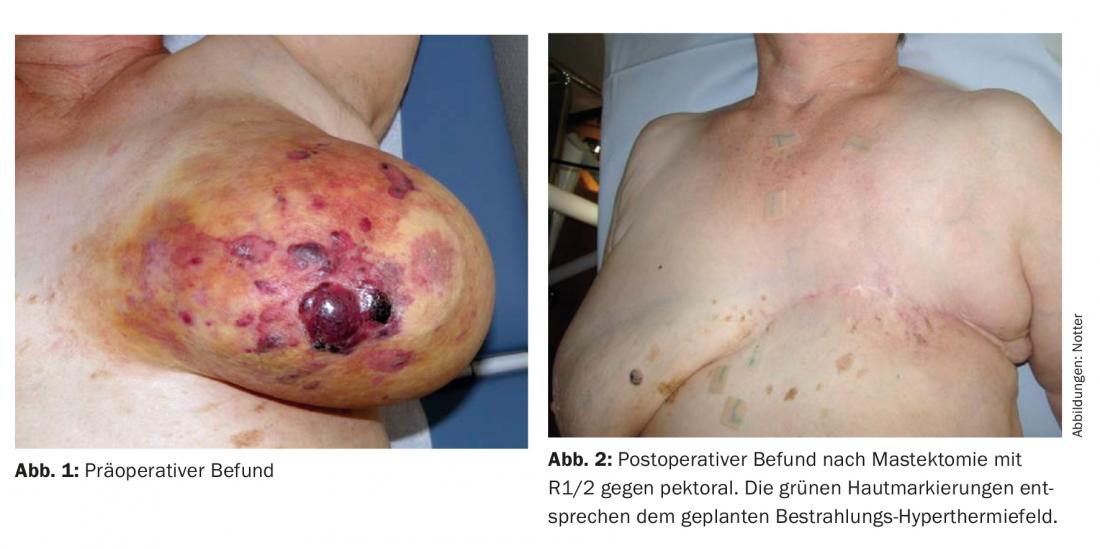
A discussão pré-operatória teve lugar no conselho tumoral em relação à estratégia terapêutica, tendo sido recomendada uma mastectomia seguida de reirradiação (re-RT) combinada com hipertermia em grande escala (HT). No pós-operatório, foi observada uma ressecção R1/R2 na zona da cicatriz e em direcção ao peitoral (Fig. 2) . Não foi realizada uma ressecção. Posteriormente, foi realizada uma re-RT hipofracção com 5× 4 Gy, 1×/semana, concomitante com HT de superfície, em analogia com um esquema terapêutico estabelecido de recorrências de mama e parede torácica [15] (Fig. 3) .
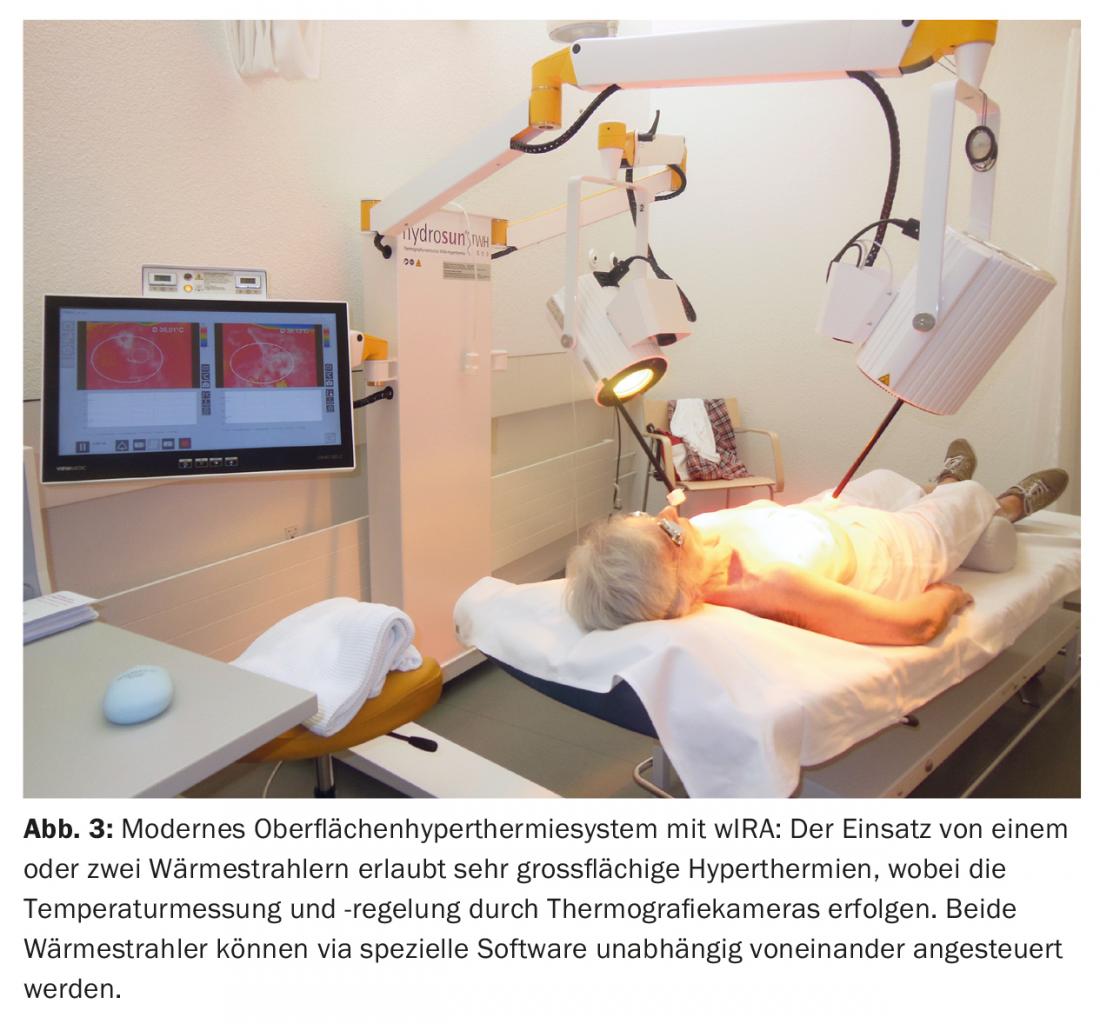
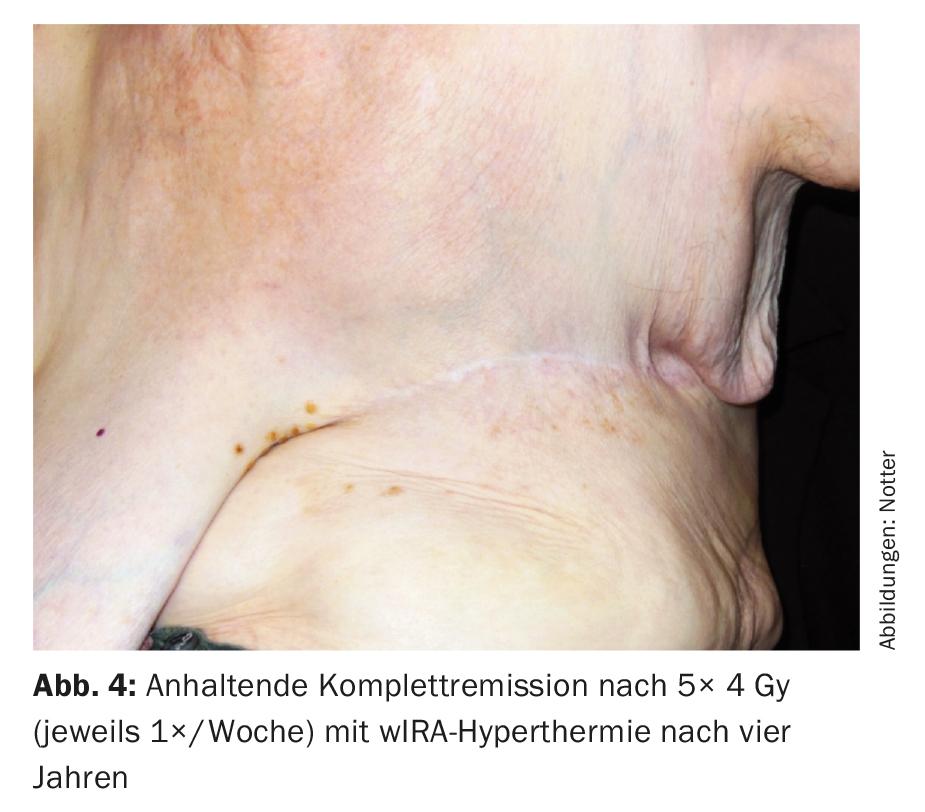
Isto foi sempre administrado no mesmo dia antes da RT com termografia controlada por infravermelhos de infravermelhos A (wIRA) durante 45 minutos. RT foi realizado dentro de dois minutos após a conclusão do HT com 4 Gy (9 MeV electrões) cada um e uma dose total de 20 Gy. O alvo principal era a região R1/R2, com a intenção profiláctica de irradiar toda a parede torácica esquerda sobre uma grande área para tratar metástases ocultas. Este tratamento foi bem tolerado, com apenas uma ligeira vermelhidão cutânea transitória (CTCAE grau 1) como efeito secundário. Mesmo quatro anos mais tarde, houve uma remissão completa (Fig. 4), que durou até seis anos mais tarde (08/2017). Isto é invulgar na medida em que parâmetros relevantes (ressecção R1/2, tumor >10 cm, multifocalidade, G3) indicariam um risco muito elevado de recorrência local.
Discussão
Devido à sua raridade, o RAAS da mama é geralmente diagnosticado demasiado tarde e muitas vezes não é discutido inicialmente/preoperatoriamente de uma forma interdisciplinar. O padrão é a ressecção cirúrgica R0 como parte de uma mastectomia ou ressecção da parede torácica local com margens de segurança generosas, embora apesar da radicalidade R0 o risco de recidiva local seja considerável, até 66% [13]. Várias abordagens para reduzir o risco de recorrência local foram descritas com ressecções ainda mais extensas (“superradicais”/”wide-margins”) e correspondentes défices funcionais e mutilações. Foi demonstrado que a ressecção R0 é prognóstica tanto na cirurgia inicial como em caso de recidiva, mas que as recidivas podem surgir de células disseminadas microscopicamente, apesar da ressecção R0 [13,14,16]. A medida em que a distância de ressecção em indivíduos saudáveis é um factor determinante permanece pouco clara. Há relatórios que não conseguiram demonstrar uma diferença prognóstica entre uma margem de ressecção livre <1 cm e >1 cm [14]. Um recente estudo cirúrgico retrospectivo de 76 pacientes mostra que a cirurgia “radical”, com pelo menos toda a pele previamente irradiada, tem um prognóstico significativamente melhor do que a “conservadora” (taxa de recidiva local de 5 anos de 23% vs. 76%) [16]. No entanto, ocorreram mais complicações com feridas. Deve também mencionar-se que foram administradas significativamente mais quimioterapias (ChT) concomitantemente nas operações “radicais”, o que poderia ter funcionado como um confundidor.
Em última análise, o controlo de metástases microscópicas ocultas na “área em risco” parece ser o principal factor de prognóstico para a subsequente recorrência. Isto levanta a questão de saber se o controlo da grande “área em risco” deve necessariamente ser efectuado cirurgicamente e se poderá haver menos opções de mutilação. As opções seriam portanto tanto a quimioterapia neoadjuvante como a quimioterapia adjuvante (ChT). Na maior análise com RAAS e ChT com 95 pacientes, só a cirurgia foi retrospectivamente comparada com o ChT adicional (neo)adjuvante. O Re-RT foi considerado contra-indicado. Com uma pequena hipótese pré-operatória de ressecção R0/R1, foi realizada a neoadjuvant ChT. O ChT adjuvante pós-operatório foi realizado para grandes lesões tumorais, G3 ou distâncias de ressecção <1 cm. Surpreendentemente, o grupo com pior prognóstico com cirurgia e ChT mostrou uma sobrevida local de 5 anos sem recorrência significativamente melhorada de 62,8% em comparação com 36,9% apenas com cirurgia, mas sem um impacto significativo nas taxas de sobrevida de 5 anos [10]. Com base nestes dados, infelizmente não é possível fazer uma recomendação segura para a TBC, uma vez que, por um lado, não foi utilizado um regime uniforme de TBC e, por outro lado, não é possível uma análise de subgrupos devido ao número demasiado pequeno de casos. Um factor limitativo adicional a ser considerado é que muitos titulares de patentes do sexo feminino dificilmente seriam capazes de tolerar um ChT agressivo devido à sua idade e condição geral.
Pode ser oferecido um re-RT apesar de uma condição pré-existente significativa? Para várias clínicas e quadros tumorais, uma exposição anterior ainda é considerada, erradamente, uma contra-indicação devido a possíveis toxicidades [10,14,16]. Como mostra o exemplo de re-RT (com HT) de recidivas de mama e parede torácica, isto não se justifica [15,17–20]. O perfil do efeito secundário depende do fraccionamento, da dose total e da latência entre a RT primária e o re-RT planeado. Os dados até à data parecem apoiar a utilização do re-RT no RAAS [21]. Analógico às clássicas recidivas da parede torácica, a combinação de re-RT com hipertermia de superfície (HT) é interessante.
No carcinoma mamário recorrente, uma meta-análise de 2110 pacientes mostrou uma taxa de remissão completa de 60% com uma baixa taxa de efeitos secundários quando se combina re-RT e HT [19]. A hipertermo/readioterapia (HTreRT) para a recorrência de mama ou parede torácica está incluída nas directrizes NCCN como “prova de categoria 3”. HT é definido como um aquecimento controlado do tecido a uma temperatura de 39-43°C e actua principalmente como um rádio-sensibilizador através
- Inibição da reparação de danos no ADN induzidos por radiação
- Melhoria da microperfusão tumoral com sensibilização das células hipóxicas e, portanto, radioresistentes [19].
Este último é particularmente útil numa parede torácica radiogénica pré-carregada e, portanto, capilarmente mal fornecida [15].
Numa revisão de 222 pacientes com RAAS, a cirurgia com re-RT adjuvante conseguiu um melhor controlo local do que a cirurgia isolada. No entanto, o HT foi dado para além do re-RT em 30% dos casos [1].
No RAAS, é descrita uma boa resposta ao HTreRT combinado acima mencionado, utilizando outros regimes de RT e uma aplicação HT diferente do que no nosso caso [22,23]. Foram incluídos pacientes após múltiplas recidivas, resultando numa baixa taxa de sobrevivência de 5 anos de 11% com uma idade média de 70 anos, mas um bom efeito paliativo com taxas de controlo de 3 anos de 46% (pós-operatório) e 22% (só HTreRT).
Conclusão
Em resumo, uma comparação directa de diferentes opções terapêuticas não é fiável devido ao baixo número de casos e à recolha de dados retrospectivos. Numa entidade como a RAAS da mama, onde a cirurgia “persegue” frequentemente a doença, deve procurar-se uma terapia interdisciplinar pró-activa bem coordenada. Seria vantajoso se o HTreRT pós-operatório fosse discutido no momento do diagnóstico, a fim de cobrir a “área em risco” numa fase inicial. O RAAS pertence a um quadro especializado em tumores.
Mensagens Take-Home
- O angiossarcoma associado à radiação (RAAS), com uma incidência de aproximadamente 0,1%, é mais comum em doentes com cancro da mama irradiado do que intuitivo.
- esperado e ocorre muito mais cedo do que outros sarcomas associados à radiação.
- O diagnóstico inicial deve ser feito o mais cedo possível e a terapia combinada deve ser inicialmente planeada de forma interdisciplinar num quadro de tumores experientes.
- Paradoxalmente, mesmo com este tumor induzido por radiação, a radiação é uma boa opção de tratamento com um perfil de baixo efeito secundário.
- No caso da RAAS da parede do tórax/pescoço, há muito a dizer sobre a terapia interdisciplinar com cirurgia e hipertermo-radioterapia semi-profiláctica adjuvante de grande campo.
- O valor da terapia sistémica adicional neo- ou adjuvante precisa de ser mais bem avaliado.
Literatura:
- Depla AL, et al: Tratamento e factores prognósticos do angiossarcoma associado à radiação (RAAS) após o cancro primário da mama: uma revisão sistemática. Eur J Cancer 2014; 50: 1779-1788.
- Stewart FW, Treves N: Linfangiossarcoma em linfedema pós-mastectomia; um relatório de seis casos em elefantíase cirúrgica. Cancro 1948; 1: 64-81.
- Huang J, Mackillop WJ: Aumento do risco de sarcoma de tecidos moles após radioterapia em mulheres com carcinoma da mama. Cancro 2001; 92: 172-180.
- Fraga-Guedes C, et al: Angiossarcomas primários e secundários da mama: uma única experiência institucional. Tratamento de Res Resistência ao Cancro da Mama 2012; 132: 1081-1088.
- Fury MG, et al: Uma revisão retrospectiva de 14 anos de angiossarcoma: características clínicas, factores prognósticos, e resultados do tratamento com cirurgia e quimioterapia. Cancro J 2005; 11: 241-247.
- Vorburger SA, et al: Angiossarcoma do peito. Cancro 2005; 104: 2682-2688.
- Cahan WG, et al: Sarcoma que surge no osso irradiado; relatório de 11 casos. Cancro 1948; 1: 3-29.
- Arlen M, et al: Sarcoma de osso induzido por radiação. Cancro 1971; 28: 1087-1099.
- Yap J, et al: Sarcoma como segunda malignidade após tratamento do cancro da mama. Int J Radiat Oncol Biol Phys 2002; 52: 1231-1237.
- Torres KE, et al: Resultados a longo prazo em pacientes com angiossarcomas associados à radiação da mama após cirurgia e radioterapia para o cancro da mama. Ann Surg Oncol 2013; 20: 1267-1274.
- Manner J, et al: A amplificação genética de alto nível MYC é uma característica distintiva dos angiossarcomas após a irradiação ou linfedema crónico. Am J Pathol 2010; 176: 34-39.
- Nestle-Kramling C, et al.: [Hemangiossarcoma após terapia de conservação do cancro da mama: relatório de quatro casos com diagnóstico genético molecular e revisão da literatura]. Strahlenther Onkol 2011; 187: 656-664.
- Seinen JM, et al: Angiossarcoma associado à radiação após cancro da mama: alta taxa de recorrência e má sobrevivência apesar do tratamento cirúrgico com ressecção R0. Ann Surg Oncol 2012; 19: 2700-2706.
- Lehnhardt M, et al: [Radiation-induced angiosarcoma of the breast]. Handchir Microchir Plast Chir 2017; 49: 103-110.
- Notter M, Piazena H, Vaupel P: Re-irradiação hipofractiva de cancro da mama recorrente de grande tamanho com hipertermografia controlada, sem contacto com água, filtrada por infravermelhos-A: um estudo retrospectivo de 73 pacientes. Int J Hyperthermia 2016; 1-10.
- Li GZ, et al: Cutaneous Radiation-associated Breast Angiosarcoma: Radicality of Surgery Impacts Survival. Ann Surg 2017; 265: 814-820.
- Wahl AO, et al: Revisão multi-institucional da irradiação repetida da parede torácica e da mama para cancro da mama recorrente. Int J Radiat Oncol Biol Phys 2008; 70: 477-484.
- Vernon CC, et al: Radioterapia com ou sem hipertermia no tratamento do cancro da mama localizado superficial: resultados de cinco ensaios controlados aleatorizados. Grupo Internacional de Hipertermias Colaborativas. Int J Radiat Oncol Biol Phys 1996; 35: 731-744.
- Datta NR, et al: Hyperthermia and Radiation Therapy in Locoregional Recurrent Breast Cancers: A Systematic Review and Meta-analysis. Int J Radiat Oncol Biol Phys 2016; 94: 1073-1087.
- Datta NR, et al: Hipertermia e reirradiação para recidivas locorregionais em cancros mamários pré-irradiados: uma única experiência institucional. Swiss Med Wkly 2015; 145: w14133.
- Ghareeb ER, et al: Primary and Radiation-induced Breast Angiosarcoma: Clinicopathologic Predictors of Outcomes and the Impact of Adjuvant Radiation Therapy. Am J Clin Oncol 2016; 39: 463-467.
- Linthorst M, et al.: Efeito de uma cirurgia combinada, reirradiação e terapia de hipertermia na taxa de controlo local em angiossarcoma induzido por rádio da parede torácica. Strahlenther Onkol 2013; 189: 387-393.
- de Jong MA, et al: Reirradiação e hipertermia para o sarcoma associado à radiação. Cancro 2012; 118: 180-187.
InFo ONCOLOGy & HEMATOLOGy 2017; 5(4): 28-32