As dermatoses auto-imunes (BAIDs) são um grupo de doenças raras, potencialmente fatais, que se manifestam clinicamente como lesões na pele ou nas mucosas, mas que, ao contrário da intuição, nem sempre têm de ser acompanhadas de bolhas. As alterações da pele e das mucosas são desencadeadas por uma reacção auto-mediada por anticorpos do sistema imunitário às proteínas estruturais da pele.
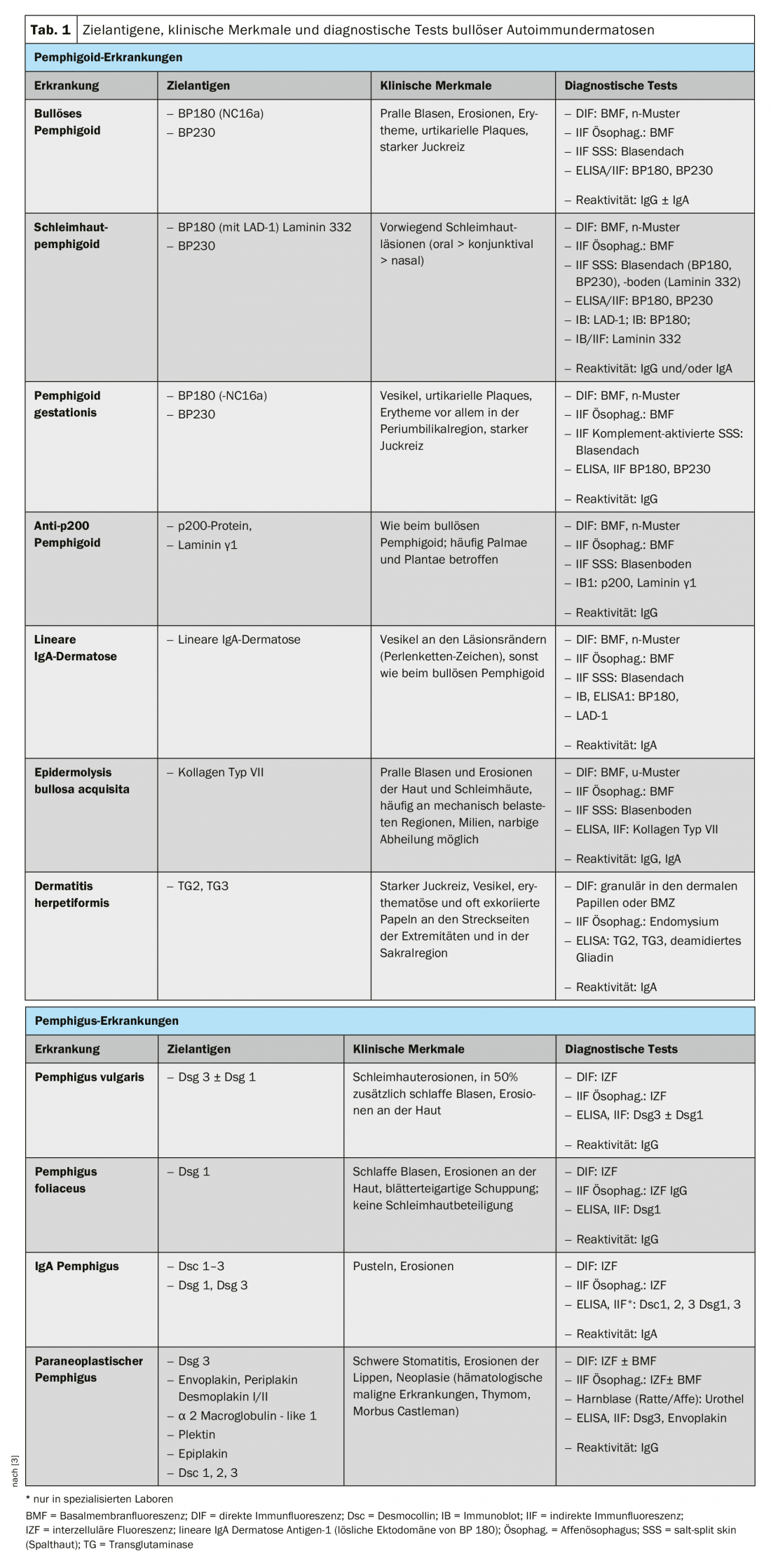
As dermatoses auto-imunes (BAIDs) são um grupo de doenças raras, potencialmente fatais, que se manifestam clinicamente como lesões na pele ou nas mucosas, mas que, ao contrário da intuição, nem sempre têm de ser acompanhadas de bolhas. As alterações da pele e da mucosa são desencadeadas por uma reacção autoanticorpo (AAK)-mediada do sistema imunitário às proteínas estruturais da pele que causam a integridade do próprio epitélio (desmosomas) ou da ancoragem epitelial ao tecido conjuntivo subjacente da pele ou mucosa. As primeiras estão agrupadas como doenças de pênfigo e as segundas como doenças pemfigoides (Tab. 1) [1,2]. A dermatite herpetiforme, na qual se formam anticorpos contra a transglutaminase 2 e 3 e que é sempre acompanhada pela doença celíaca, deve ser distinguida desta [3].
O antigénio alvo dos auto-anticorpos tem uma influência decisiva na patogénese e, portanto, no aspecto clínico da BAID, serve pela sua determinação em estabelecer um diagnóstico exacto e tem uma influência decisiva no prognóstico e na terapia a ser aplicada. A seguir, o reconhecimento e a diferenciação das doenças pemphigus e pemphigoides, bem como as etapas de diagnóstico, serão considerados em particular. As actuais directrizes [4,5] (EADV guideline pemphigus e DH), bem como os artigos e revisões de investigação científica regularmente publicados, fornecem informações mais aprofundadas.
Epidemiologia: Com excepção da gestação de pemfigoides, todos os BAIDs podem, em princípio, ocorrer em qualquer idade, mas existe uma distribuição etária típica das doenças individuais. Enquanto a dermatose linear IgA é mais comum em crianças e adolescentes, as pessoas com pemfigoide bolhoso geralmente desenvolvem a doença após os 75 anos de idade, e os doentes com pemfigo são em média uma a duas décadas mais novos. [6,7]. Geograficamente, o pemfigoide bolhoso domina na Europa do Norte e Central e na América do Norte, com uma incidência de cerca de 20/milhões de população/ano. Na Europa do Sul, Israel e Irão, o pênfigo é o BAID mais comum, com uma incidência anual de 5-15 milhões/habitante [1]. Na Suíça, a incidência de pemphigoid bullous foi de 12,1/milhões/ano e pemphigus vulgaris e foliaceus 0,6/milhões/ano em 2001/2002 [8]. Todas as outras BAIDs ocorrem ainda com menos frequência do que o pênfigo.
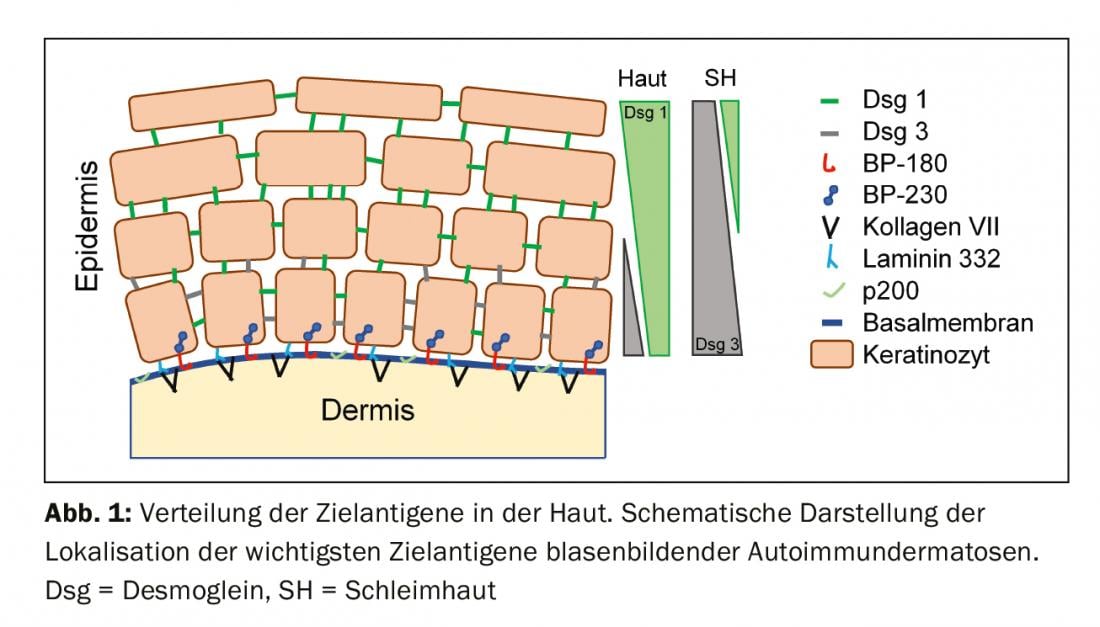
Autoantigénios e apresentação clínica
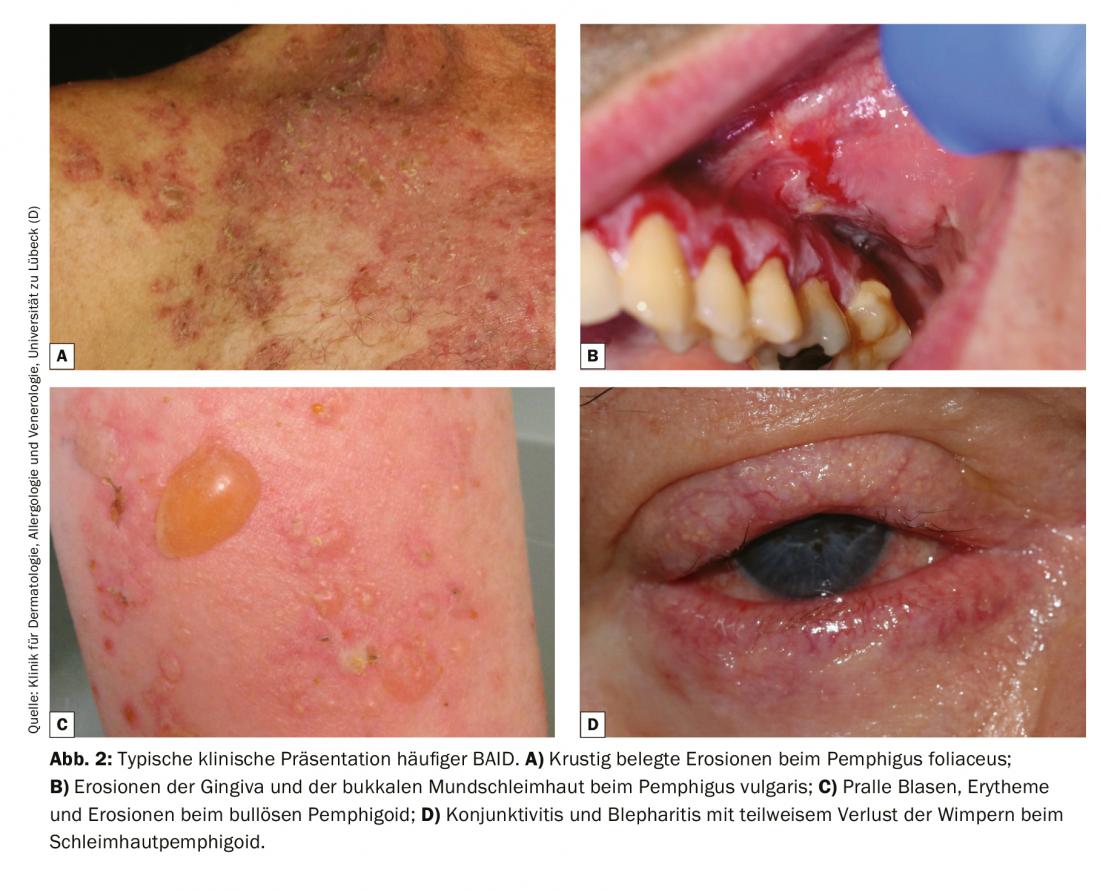
Para compreender o quadro clínico da BAID, vale a pena observar primeiro a distribuição dos antigénios alvo dentro da pele e da mucosa (Fig. 1) . Os antigénios alvo do grupo do pemfigoide asseguram a ancoragem do epitélio à membrana do porão e ao tecido conjuntivo subjacente. Esta área é também chamada zona de junção dermo-epidérmica. Quando os auto-anticorpos se ligam a estas proteínas estruturais, ocorre uma complexa reacção inflamatória com activação local do sistema complemento, infiltração de eosinófilos, neutrófilos, macrófagos e linfócitos na derme superior e subsequente libertação de espécies reactivas de oxigénio e proteases por estas células, acabando por destruir a zona de junção dermo-epidérmica [9]. Isto resulta na formação de fendas subepidérmicas e bolhas clinicamente típicas (serous/haemorrágicas) (Fig. 2C). A irritação mecânica leva à erosão da pele e por vezes das membranas mucosas. Os auto-anticorpos do pemfigoide bolhoso ligam-se à BP180 (colagénio tipo XVII), e em particular ao domínio BP180 NC16A, e em metade dos doentes também à BP230 (Quadro 1) . 20% dos casos de pemfigoides bolhosos progridem sem bolhas e apresentam uma variedade de quadros clínicos, incluindo eritema urticário, pápulas escoriadas e eczema [10]. Há praticamente sempre uma prurido pronunciado. De grande importância clínica é a associação da PA com várias doenças neurológicas em 30-50% dos doentes, bem como com diabetes mellitus e malignidades hematológicas [2,11]. Tornou-se recentemente claro que certos medicamentos antidiabéticos orais, os inibidores da peptidase IV dipeptidyl, em particular a vildagliptin, podem desencadear a PA, pelo que estes medicamentos não devem ser utilizados na PA [12].
O domínio NC16A de BP180 é também a região imunodominante em gestação pemfigoide, um BAID que ocorre predominantemente na segunda metade da gravidez e que normalmente resolve 5-6 meses após o parto. No entanto, as recidivas são comuns com novas gravidezes. A dermatose linear de IgA tem anticorpos IgA contra mais epitopos C-terminais de BP180.
No pemphigoid de mucosa, as membranas mucosas são principalmente afectadas, incluindo a cavidade oral e a conjuntiva, bem como as membranas mucosas do nariz, garganta, faringe , traqueia, esófago e genitais (Fig. 2D) . Excepto na boca, as cicatrizes ocorrem regularmente. As complicações desta cicatrização incluem a possível cegueira e obstrução das vias respiratórias. No pemphigoid da mucosa, os auto-anticorpos são dirigidos contra epitopos C-terminais de BP180 ou lamina 332 (Tab. 1) . O anti-p200 pemfigoide é clinicamente semelhante à BP, mas os auto-anticorpos são dirigidos contra uma proteína de 200 kDa da junção dermo-epidérmica. Na grande maioria dos doentes, os auto-anticorpos também reagem com a lamina γ1 [13]. A epidermólise bolhosa acquisita é definida por anticorpos contra o colagénio tipo VII e manifesta-se clinicamente sob duas formas principais, a variante inflamatória que se assemelha a uma PA ou a um pemfigoide de membrana mucosa, ou a variante mecanobolhosa clássica com bolhas, erosões e cicatrizes em locais do corpo expostos, tais como a palma da mão [14].
Os antigénios alvo do grupo pemphigus, os cadherins desmosomais desmoglein 1 e 3 (Dsg 1, 3), são formados pelas células epiteliais a fim de se ligarem firmemente umas às outras (Fig. 1). Se forem atacados, a associação de células epiteliais dissolve-se (acantólise). Clinicamente, isto pode ser demonstrado pelo uso de forças de cisalhamento para destacar superficialmente a pele perilesional e saudável (fenómeno Nikolski). Contudo, como a estabilidade de uma bolha depende do grau de integridade intra-epitelial e esta é directamente danificada, em pênfigo observam-se bolhas flácidas que se rompem rapidamente, de modo que as erosões se formam normalmente. Dsg 1, o antigénio alvo em pênfigo foliáceo (PF), é produzido principalmente nas camadas epidérmicas superiores da pele e da mucosa, embora Dsg 3 não seja aí expresso na pele, de modo que o PF se manifesta por erosões, crostas e uma fina escamação lamelar na pele, mas as membranas mucosas estão sempre livres (hipótese de compensação de Dsg, Fig. 2A) [1,15]. Dsg 3, o antigénio alvo em pemphigus vulgaris (PV), é principalmente expresso nas camadas inferiores do epitélio; contudo, nestes sítios, Dsg1 só se encontra na mucosa epitelial, mas não na pele. Assim, na presença de anticorpos exclusivamente anti-Dsg3, a PV desenvolve exclusivamente erosões da mucosa (Fig. 2B), que são frequentemente dolorosas, impedem a ingestão de alimentos e podem levar à perda de peso. Na PV mucocutânea com anticorpos contra Dsg3 e Dsg1, ocorrem erosões e bolhas flácidas na pele para além das lesões mucosas. Ao contrário das doenças pemfigoides, não é necessária qualquer reacção inflamatória para a formação de bolhas; a ligação de anticorpos anti-Dsg apenas às células epiteliais é suficiente para desencadear a acantólise. O impedimento estéreo da interacção desmosomal pela ligação dos auto-anticorpos, uma expressão alterada das moléculas de Dsg na superfície celular, bem como uma remodelação complexa do citoesqueleto das células epiteliais mediada pela transdução de sinal, desempenham aqui um papel decisivo [15]. O pênfigo paraneoplástico está sempre associado a uma neoplasia, geralmente um timoma ou uma malignidade hematológica, e caracteriza-se clinicamente por uma estomatite marcada e um envolvimento frequente dos lábios. Além de Dsg 3, os auto-anticorpos são dirigidos contra proteínas da família das plaquetas (incluindo envoplakin, periplakin, BP230) e contra α2-macroglobulin-like 1 [1].
Diagnósticos
Como a apresentação clínica da BAID é tão variada e nem sempre claramente atribuível a uma BAID específica, o diagnóstico diferencial deve excluir causas infecciosas (impetigo, erisipela bolhosa, síndrome da pele escaldada estafilocócica, infecções pelo vírus do herpes), doenças hereditárias (porfíria, epidermólise bolhosa hereditária), bem como exantema medicamentoso e noxae química e física [4]. No caso de envolvimento da cavidade oral, o diagnóstico diferencial deve ser principalmente um líquen ruber mucosae, e no caso de envolvimento ocular, deve ser considerada uma génese infecciosa, alérgica ou irritante. Especialmente no caso de envolvimento ocular, um pemfigóide de membrana mucosa deve ser considerado precocemente, uma vez que esta é a única forma de prevenir terapeuticamente cicatrizes irreversíveis. Figura 2 e quadro 1 resumem as características clínicas.
Para além dos resultados clínicos, a imunofluorescência directa (FI) de uma biópsia perilesional e a detecção de auto-anticorpos circulantes por FI indirecta, ensaio de imunofluorescência enzimática (ELISA) e immunoblots são essenciais no diagnóstico de BAID [4].
O diagnóstico exacto de cada BAID é tanto de importância prognóstica como relevante para a terapia. Assim, o pênfigo paraneoplástico está praticamente sempre associado à malignidade e o pênfigo mucinoso anti-laminina-32 está associado à malignidade em 25-30% dos casos, sendo indicada uma pesquisa tumoral nestes pacientes [1,16,17]. As doenças de pênfigo, epidermólise bullosa acquisita e pemfigóide mucoso com envolvimento ocular, laríngeo ou traqueal só podem ser tratadas com terapia imunossupressora intensiva, enquanto que os anti-p200 pemfigóides, dermatoses IgA lineares e dermatites herpetiformes requerem normalmente apenas imunossupressão ligeira ou uma dieta sem glúten.
Imunofluorescência directa
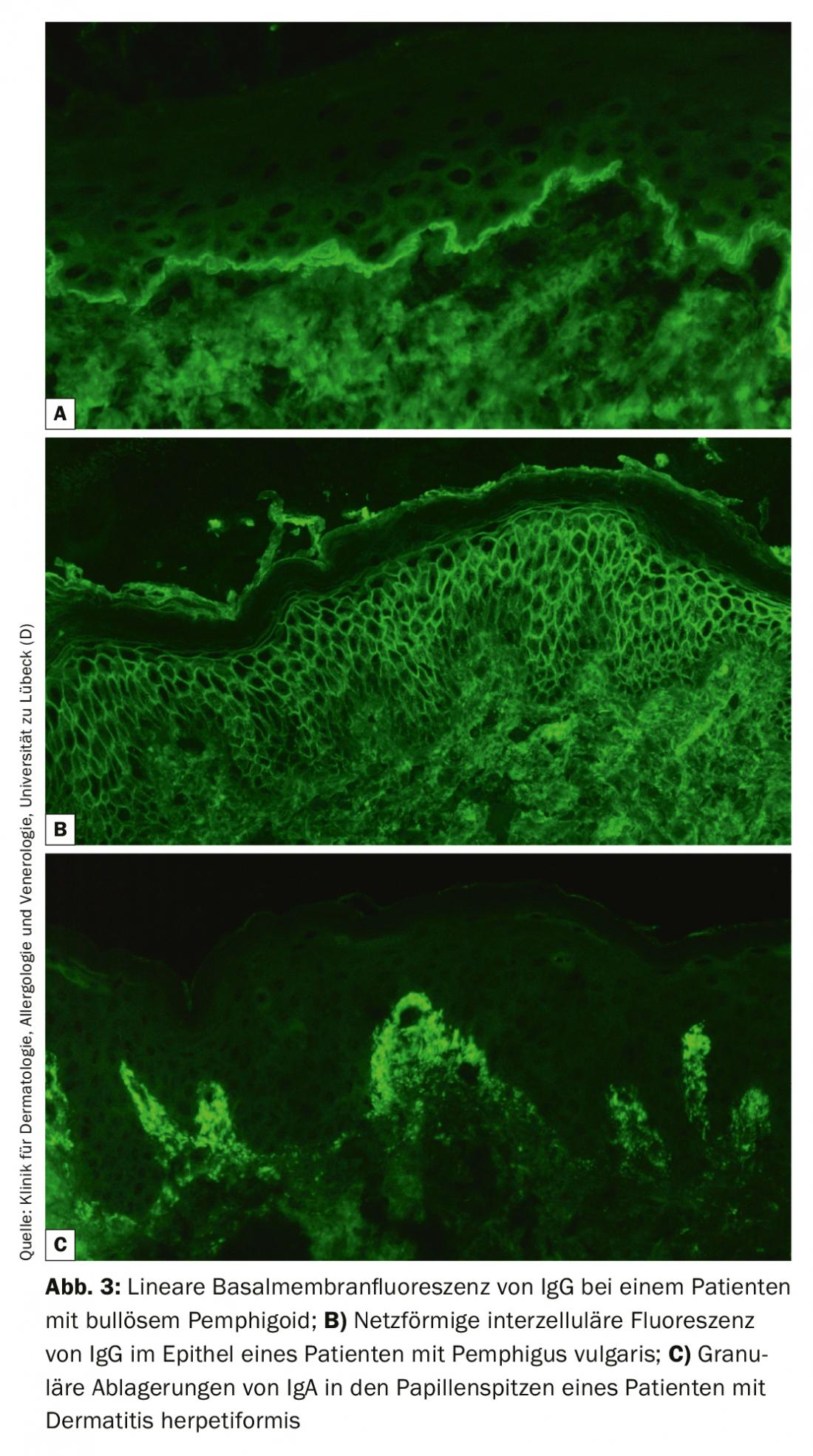
IF directo de uma biópsia de perilesional continua a ser o padrão de ouro diagnóstico da BAID com uma especificidade de 98% e uma sensibilidade de 80-90% [4]. A biópsia da amostra deve ser congelada imediatamente após a recolha ou armazenada em meio NaCl ou Michels 0,9% e processada no prazo de 72 horas. Depois, os auto-anticorpos ligados aos tecidos (imunoglobulina [Ig] G, A e M) e o factor complementar C3 são visualizados em secções congeladas com um anticorpo marcado com fluorescência. O reconhecimento de um padrão típico de fluorescência permite basicamente o diagnóstico fiável de pênfigo (padrão de fluorescência intercelular epitelial/net), pemfigóide (fluorescência linear ao longo da membrana do porão) e dermatite herpetiforme (depósitos granulares de IgA nas pontas papilares ou ao longo da membrana do porão, Fig. 3). Além disso, deve ser feita uma biopsia lesional para realizar um exame histológico; isto serve para diagnosticar outras doenças, especialmente no caso de IF directo negativo e serologia.
Imunofluorescência indirecta em substratos de órgãos
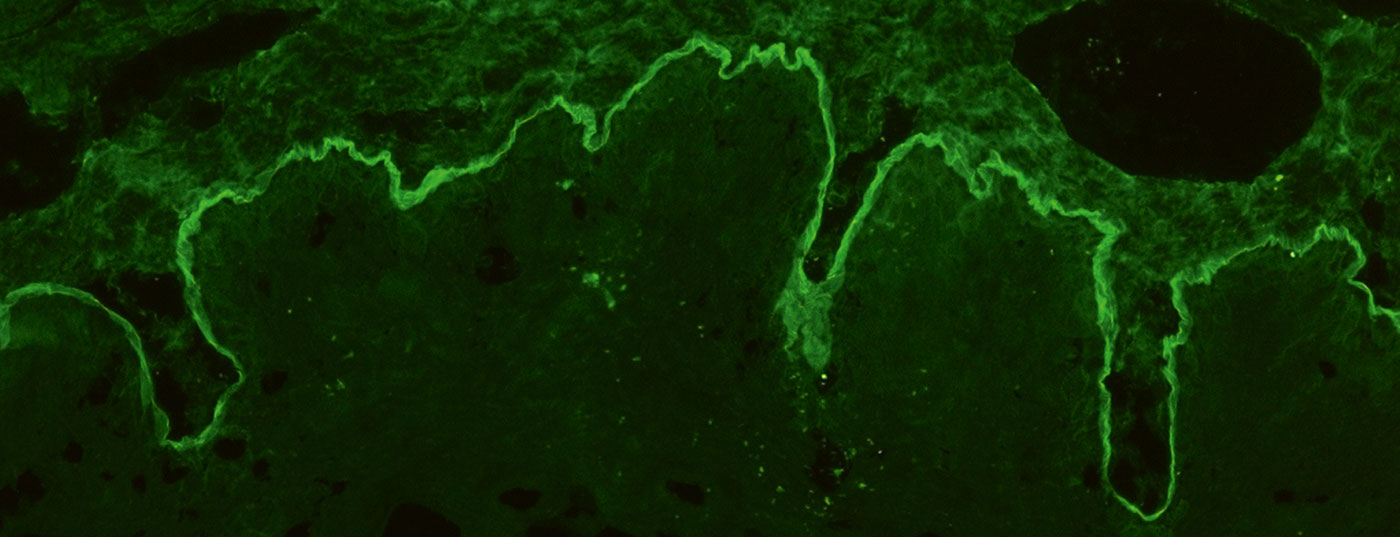
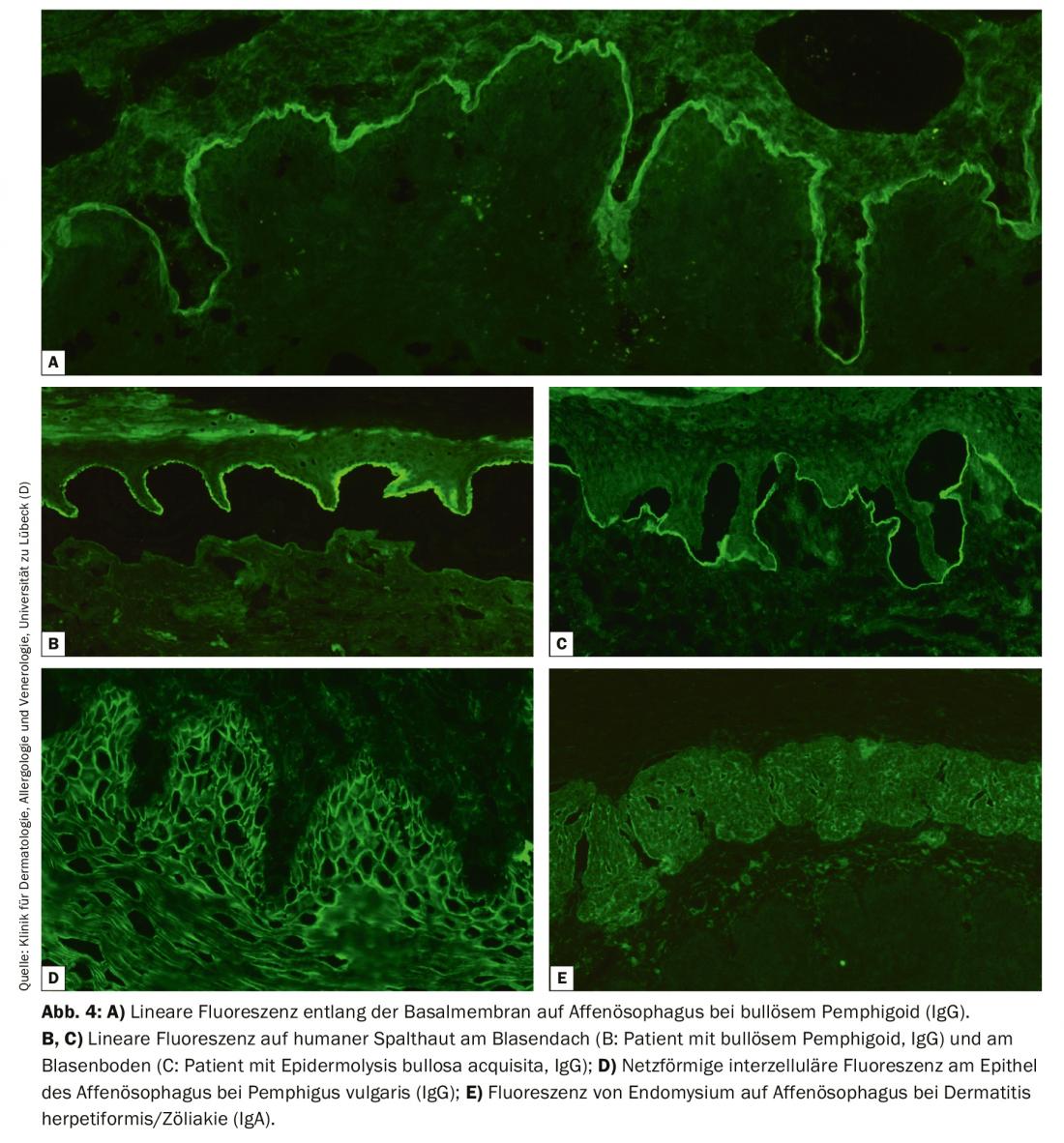
Para o IF indirecto, utiliza-se sobretudo esófago de primatas e com solução de NaCl. A pele humana dividida na membrana do porão, a chamada pele dividida, é utilizada para a detecção de auto-anticorpos de soro na BAID. Na secção do esófago, os auto-anticorpos podem ser detectados ao longo da membrana do porão em doenças pemfigoides. (Fig. 4A), nas doenças de pênfigo intercelularmente sobre o epitélio (Fig. 4D) e na dermatite herpetiforme e doença celíaca contra o endomísio (apenas IgA), Fig. 4E). Na pele fendida, os autoanticorpos séricos das doenças pemfigoides ligam-se quer no telhado da bolha criada artificialmente (em PB, anti-BP180 pemfigoide da mucosa, gestação pemfigoide, dermatose IgA linear, Fig. 4B) ou no chão da bolha (em anti-p200 pemphigoid, anti-laminina 332 pemphigoid, epidermolysis bullosa acquisita, Fig. 4C). Também aqui procuramos depósitos de IgG e IgA, sendo este último típico da dermatose linear de IgA, por exemplo. Menos frequentemente indicado é o exame da bexiga de macaco/rato em pênfigo paraneoplásico ou o teste de fixação do complemento em pele fendida em gestação suspeita de pênfigoide.
O FI indirecto nos substratos dos órgãos acima mencionados são utilizados como testes de rastreio e depois, dependendo do resultado, são realizados testes específicos de antigénios, ELISA, FI indirecto, immunoblots ou imunoprecipitação, se necessário, tendo em conta o FI directo. Com o desenvolvimento de testes específicos de antigénios, utilizando principalmente as formas imunodominantes recombinantes dos auto-antigénios, o diagnóstico pode agora ser feito serologicamente em 80-90% dos doentes com BAID [18–20].
ELISA
Estão disponíveis ELISAs comerciais muito sensíveis e específicos para os principais antigénios alvo, Dsg1, Dsg3, Envoplakin, BP180 NC16A, BP230 e colagénio tipo VII [3]. Para anticorpos contra Dsg1, BP180 NC16A, colagénio tipo VII e, um pouco menos pronunciado, para Dsg3, foi demonstrado que os níveis séricos se correlacionam bem com a actividade clínica na pele e membranas mucosas de doentes com pênfigo, pênfigo bolhoso e epidermólise bullosa acquisita, de modo que os ELISAs também podem ser utilizados no decurso da doença para monitorizar a actividade da doença. Isto é particularmente relevante para pacientes em remissão clínica, para os quais deve ser decidido até que ponto a terapia imunossupressora pode ser ainda mais reduzida.
Sistemas de teste multivariados: Sistemas de teste multivariados foram desenvolvidos para investigar diferentes especificidades de autoanticorpos numa só etapa e para poupar tempo em comparação com o procedimento de várias etapas descrito acima. Um é um ELISA em que as proteínas recombinantes foram colocadas numa única placa ELISA [18], o outro é baseado na tecnologia Biochip®. Aqui, até 12 substratos medindo apenas cerca de 1×1 mm são compilados num campo de incubação numa lâmina de laboratório normal e a ligação de autoanticorpos é tornada visível utilizando o IF indirecto. Para além de substratos de órgãos como o esófago de primatas e a pele humana dividida, estão também disponíveis os recombinantes BP180 NC16A e Dsg1, Dsg3, BP230, laminina 332, colagénio tipo VII expresso na superfície celular das células HEK293 [19].
Imunoblot e imunoprecipitação
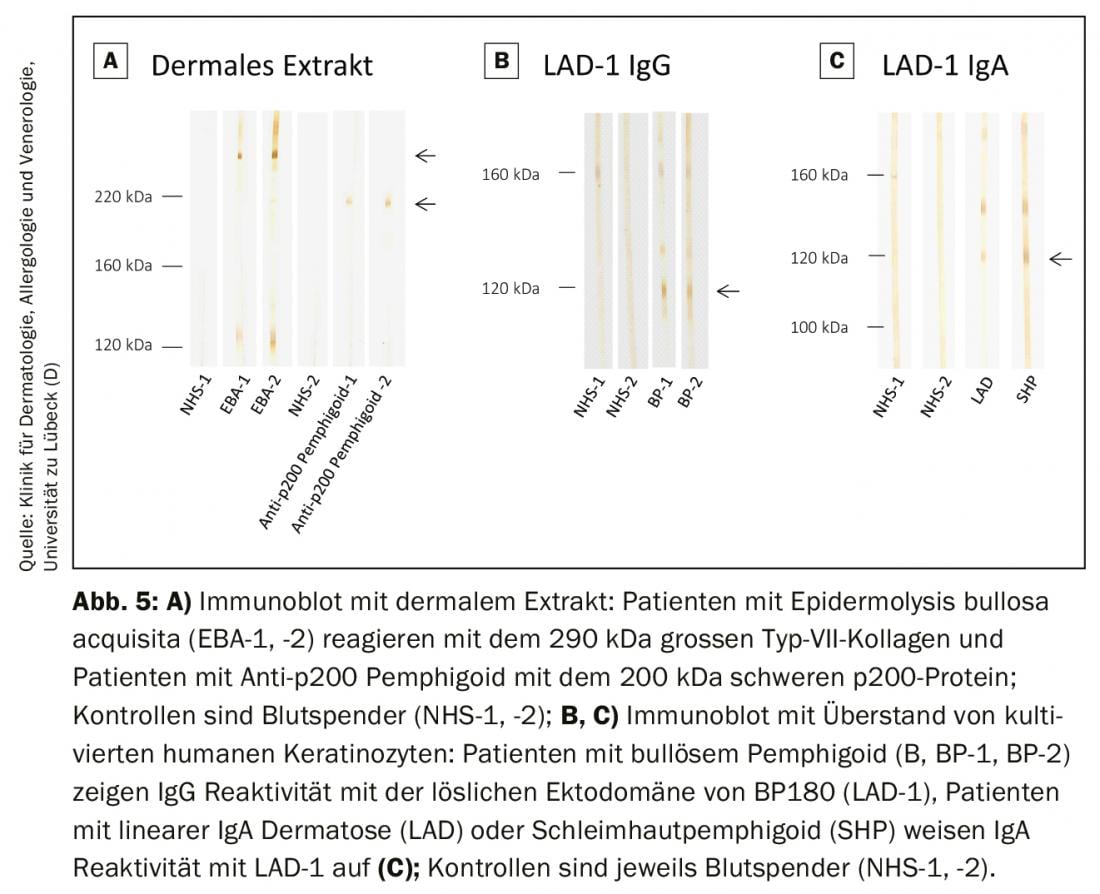
Em laboratórios especializados, estes métodos são oferecidos como procedimentos internos para detectar as especificidades dos autoanticorpos que ainda não estão cobertos por sistemas de teste comerciais. Isto inclui a detecção de auto-anticorpos contra a molécula de colagénio tipo VII completa, bem como a proteína p200. (Fig. 5A) e a detecção de anticorpos IgG e IgA contra o ectodomínio da BP180, que é a região imunodominante no pemfigoide da mucosa e nas dermatoses lineares de IgA. (Fig. 5B e C). Os anticorpos contra a periplakina, desmoplakina I/II, plectina, epiplakina, desmocollinas e α2-macroglobulina tipo 1 em pênfigo paraneoplásico podem ser visualizados em várias análises de immunoblot e imunoprecipitação. Na Alemanha, o Organismo Alemão de Acreditação (DAkkS) oferece a possibilidade de auditar estes procedimentos internos externamente para assegurar o mais alto padrão de diagnóstico possível. O laboratório auto-imune da Clínica da Pele da Universidade de Lübeck oferece estes procedimentos (DAkkS D-ML-13069-06-00; www.uksh.de/dermatologie-luebeck).
Constelações especiais de descobertas
No caso de constelações pouco claras de descobertas, recomenda-se a realização de uma nova biópsia de amostra perilesional para IF directo [4]. No pemphigoid de membrana mucosa, foi demonstrado que em 16% dos doentes o diagnóstico só pôde ser confirmado por um segundo IF directo [21]. O IF directo é particularmente importante no pemphigoid de membrana mucosa e epidermólise bullosa acquisita, uma vez que nenhum autoanticorpo em circulação pode ser detectado em 50% dos casos.
Na grande maioria dos doentes com BAID, o diagnóstico já pode hoje em dia ser feito serologicamente com a ajuda de sistemas de teste comerciais, se o quadro clínico for compatível [18,19]. Também recomendamos testes serológicos como exame de rastreio inicial se se pretende dispensar inicialmente uma biopsia de amostra, por exemplo, em crianças ou doentes >75 anos com >6 semanas de prurido existente que não pode ser explicado por outra doença.
A actual directriz AWMF [5] recomenda o diagnóstico de pemphigus vulgaris/foliaceus no caso de
- Quadro clínico adequado e imunofluorescência directa positiva
- Corresponder o quadro clínico e a reactividade com desmoglein 1 ou 3 em células ELISA/in transfectadas.
- correspondência entre o quadro clínico e a histopatologia e a imunofluorescência indirecta positiva nas secções de esófago de macacos.
Diagnóstico de pemphigoid bullous no caso de
- quadro clínico adequado e IF directo positivo e reactividade com BP180 e/ou BP 230
- Quadro clínico adequado e ligação directa positiva de IgG e epidérmica no FI indirecto sobre pele fendida.
- Quadro clínico com bolhas salientes e ligação epidérmica de IgG em IF indirecta em secções de pele dividida ou esófago de macaco e reactividade com BP180 e/ou BP230.
- Imagem clínica com bolhas salientes e correspondência histopatológica e ligação epidérmica de IgG em FI indirecto em pele fendida.
- correspondência entre quadro clínico e histopatologia (formação de fendas subepidérmicas) e reactividade com BP180
- Imagem clínica com bolhas salientes e clara reactividade com BP180 (por exemplo >3 vezes o limite inferior de detecção em ELISA comercial).
Resumo
As dermatoses auto-imunes (BAIDs) são um grupo de doenças raras e potencialmente fatais que se manifestam clinicamente como lesões na pele ou nas mucosas e não têm de estar sempre associadas à formação de bolhas. As alterações da pele e da mucosa são desencadeadas por uma reacção auto-mediada do sistema imunitário às proteínas estruturais da pele que causam a integridade do próprio epitélio (desmosomas) ou da ancoragem epitelial ao tecido conjuntivo subjacente da pele ou da mucosa. As primeiras estão agrupadas como doenças pemfigoides e as segundas como doenças pemfigoides. A dermatite herpetiforme, na qual se formam anticorpos contra a transglutaminase 2 e 3 e que é sempre acompanhada pela doença celíaca, deve ser distinguida desta. O antigénio alvo dos auto-anticorpos tem uma influência decisiva na patogénese e, portanto, no aspecto clínico da BAID, e a sua determinação não só serve para estabelecer um diagnóstico exacto, como também tem uma influência decisiva no prognóstico e na terapia a ser aplicada. O diagnóstico de BAID baseia-se na detecção de auto-anticorpos ligados aos tecidos na imunofluorescência directa de uma biópsia de amostra perilesional e na detecção de auto-anticorpos circulantes. Conhecendo o quadro clínico, o ELISA moderno e os testes de imunofluorescência indirecta baseados nas regiões imundominantes dos antigénios alvo podem já diagnosticar serologicamente 80-90% dos doentes com BAID. O desenvolvimento de sistemas de teste adicionais normalizados sensíveis e específicos simplificará ainda mais o diagnóstico do BAID.
Mensagens Take-Home
- As dermatoses auto-imunes bolhosas são doenças raras desencadeadas por auto-anticorpos contra proteínas estruturais da pele.
- A dermatose bolhosa auto-imune mais comum no norte e centro da Europa é de longe a pemfigoide bolhosa, que se caracteriza clinicamente por idade avançada, prurido grave, bolhas salientes e associação com doença neurológica.
- O diagnóstico exacto é de relevância prognóstica e terapêutica.
- Estão disponíveis testes ELISA normalizados altamente sensíveis e específicos e testes de imunofluorescência indirecta utilizando a região imunodominante dos antigénios alvo.
- Conhecendo o quadro clínico, os testes serológicos permitem um diagnóstico fiável na grande maioria dos doentes; a biópsia da amostra perilesional para exame directo de imunofluorescência continua a ser o padrão de ouro do diagnóstico.
Agradecimentos
Gostaríamos de agradecer a Ingeborg Atefi e Marina Kongsbak-Reim pelo seu apoio com as imagens fluorescentes e Vanessa Krull pela sua ajuda com os immunoblots. O trabalho foi apoiado por fundos estruturais do Cluster of Excellence 2167/1 Precision Medicine in Chronic Inflammation.
Literatura:
- Schmidt E, Kasperkiewicz M, Joly P: Pemphigus. Lancet 2019; 394: 882-894.
- Schmidt E, Zillikens D: Doenças pemfigoideas. Lancet 2013; 381: 320-332.
- van Beek N, Zillikens D, Schmidt E: Diagnóstico de doenças auto-imunes bolhosas. J Dtsch Dermatol Ges 2018; 16: 1077-1091.
- Schmidt E, Goebeler M, Hertl M, et al: Directriz S2k para o diagnóstico de pemphigus vulgaris/foliaceus e pemphigoid bullous. J Dtsch Dermatol Ges 2015; 13: 713-727.
- Schmidt E, Sticherling M, Sardy M, et al: S2k guidelines for the treatment of pemphigus vulgaris/foliaceus and bullous pemphigoid: actualização de 2019. J Dtsch Dermatol Ges 2020; 18: 516-526.
- Hübner F, Recke A, Zillikens D, et al.: Prevalência e Distribuição etária das Doenças de Pênfigo e Penfigóide na Alemanha. The Journal of investigative dermatology (JEADV) 2016: 136(12): 2495-2498; doi: 10.1016/j.jid.2016.07.013.
- Hübner F, König IR, Holtsche MM, et al.: Prevalência e distribuição etária das doenças pênfigoides e pemfigoides entre os doentes pediátricos na Alemanha. Em: JEADV 2020; doi: 10.1111/jdv.16467.
- Marazza G, Pham HC, Scharer L, et al: Incidência de pênfigoide bolhoso e pênfigo na Suíça: um estudo prospectivo de 2 anos. Br J Dermatol 2009; 161: 861-868.
- Sadik CD, Schmidt E: Resolução em pemfigoide bolhoso. Seminários em imunopatologia 2019; 41: 645-654.
- della Torre R, Combescure C, Cortes B, et al: Apresentação clínica e atraso de diagnóstico em pemfigoide bolhoso: uma futura coorte nacional. Br J Dermatol 2012; 167: 1111-1117.
- Schulze F, Neumann K, Recke A, et al: Malignidades em pemphigus e doenças pemphigoidais. J Invest Dermatol 2015; 135: 1445-1447.
- Kridin K, Cohen AD: Dipeptidyl-peptidase IV inibidor associado ao pemphigoid bullous: Uma revisão sistemática e meta-análise. J Am Acad Dermatol 2018.
- Goletz S, Hashimoto T, Zillikens D, Schmidt E: Anti-p200 pemphigoid. J Am Acad Dermatol 2014; 71: 185-191.
- Vorobyev A, Ludwig RJ, Schmidt E: Características clínicas e diagnóstico de epidermólise bullosa acquisita. Perito Rev Clin Immunol 2017; 13: 157-169.
- Kasperkiewicz M, Ellebrecht CT, Takahashi H, et al: Pemphigus. Nature reviews Disease primers 2017; 3: 17026.
- Egan CA, Lazarova Z, Darling TN, et al: pemphigoid antiepiligrina cicatricial e risco relativo de cancro. Lancet 2001; 357: 1850-1851.
- Goletz S, Probst C, Komorowski L, et al: Um ensaio sensível e específico para o diagnóstico serológico de antilaminina 332 pemphigoid de membrana mucosa. Br J Dermatol 2019; 180: 149-156.
- van Beek N, Dahnrich C, Johannsen N, et al: Estudos prospectivos sobre o uso rotineiro de um novo ensaio de imunoabsorção enzimática multivariante para o diagnóstico de doenças bolhosas auto-imunes. J Am Acad Dermatol 2017; 76: 889-894 e5.
- van Beek N, Kruger S, Fuhrmann T, et al: Estudo prospectivo multicêntrico sobre o diagnóstico multivariante de dermatoses bulosas auto-imunes utilizando a tecnologia BIOCHIP(TM). J Am Acad Dermatol 2020.
- van Beek N, Rentzsch K, Probst C, et al: Diagnóstico serológico de doenças de pele bolhosas auto-imunes: Comparação prospectiva da técnica de imunofluorescência indirecta baseada em mosaico BIOCHIP com a estratégia convencional de teste único em múltiplas etapas. Orphanet J Rare Dis 2012; 7: 49.
- Shimanovich I, Nitz JM, Zillikens D: A amostragem múltipla e repetida aumenta a sensibilidade dos testes de imunofluorescência directa para o diagnóstico de pemfigoide de membrana mucosa. J Am Acad Dermatol 2017; 77: 700-705 e3.
PRÁTICA DA DERMATOLOGIA 2020; 30(5): 12-19