A cirurgia é a primeira escolha para o cancro gástrico localizado. A terapia do sistema peri- ou pós-operatória pode melhorar as taxas de cura. Paliativamente, prolonga a sobrevivência e melhora a qualidade de vida.
As declarações neste artigo aplicam-se tanto ao carcinoma gástrico clássico como aos carcinomas de transição gastroesofágica (tumores GEJ), porque estas duas entidades foram geralmente investigadas em conjunto nos estudos mais recentes.
Terapia curativa do sistema pretendido
A taxa de cura do cancro gástrico de fase 1 é de cerca de 70% com uma ressecção R0. Cai para uns bons 35% para a doença de fase 2 apenas com cirurgia. Para aumentar as taxas de cura, a utilização de terapias do sistema pré- e/ou pós-cirúrgico foi testada em ensaios clínicos. Para a terapia curativa do sistema, existe o modelo americano (pós-operatório [adjuvante] radiochemoterapia) [1] e o modelo europeu (perioperatório [neoadjuvante und adjuvante] quimioterapia) [2].
No ensaio americano INT0116, os pacientes após ressecção do cancro gástrico foram tratados com cinco semanas de radiochemoterapia com 5FU e duas doses de 5FU a intervalos mensais [1]. A sobrevida média foi de 36 meses no grupo de radiochemoterapia adjuvante e 27 meses apenas com terapia cirúrgica (embora o estudo tenha sido criticado por estadiamento cirúrgico inadequado das enfermarias de gânglios linfáticos e a consequente potencial sobrestimação do benefício do tratamento). Independentemente da discussão sobre a extensão adequada da ressecção dos gânglios linfáticos, a radiochemoterapia adjuvante por analogia com o estudo INT0116 continua a ser amplamente utilizada na região americana – especialmente quando a discussão interdisciplinar só tem lugar após a cirurgia. Como alternativa à radiochemoterapia adjuvante, os ensaios ARTIST e CLÁSSICA demonstraram que a quimioterapia por si só com cisplatina/capecitabina e cisplatina/capecitabina por si só é a melhor opção. Oxaliplatina/capecitabina estabelecida [3,4]. Ambos os estudos têm certos inconvenientes, de modo que as estratégias neles seguidas não são amplamente aplicadas na Europa. O ensaio ARTIST comparou a quimioterapia apenas com a radiochemoterapia (em vez da observação apenas) e o ensaio CLÁSSICO foi realizado apenas em pacientes asiáticos.
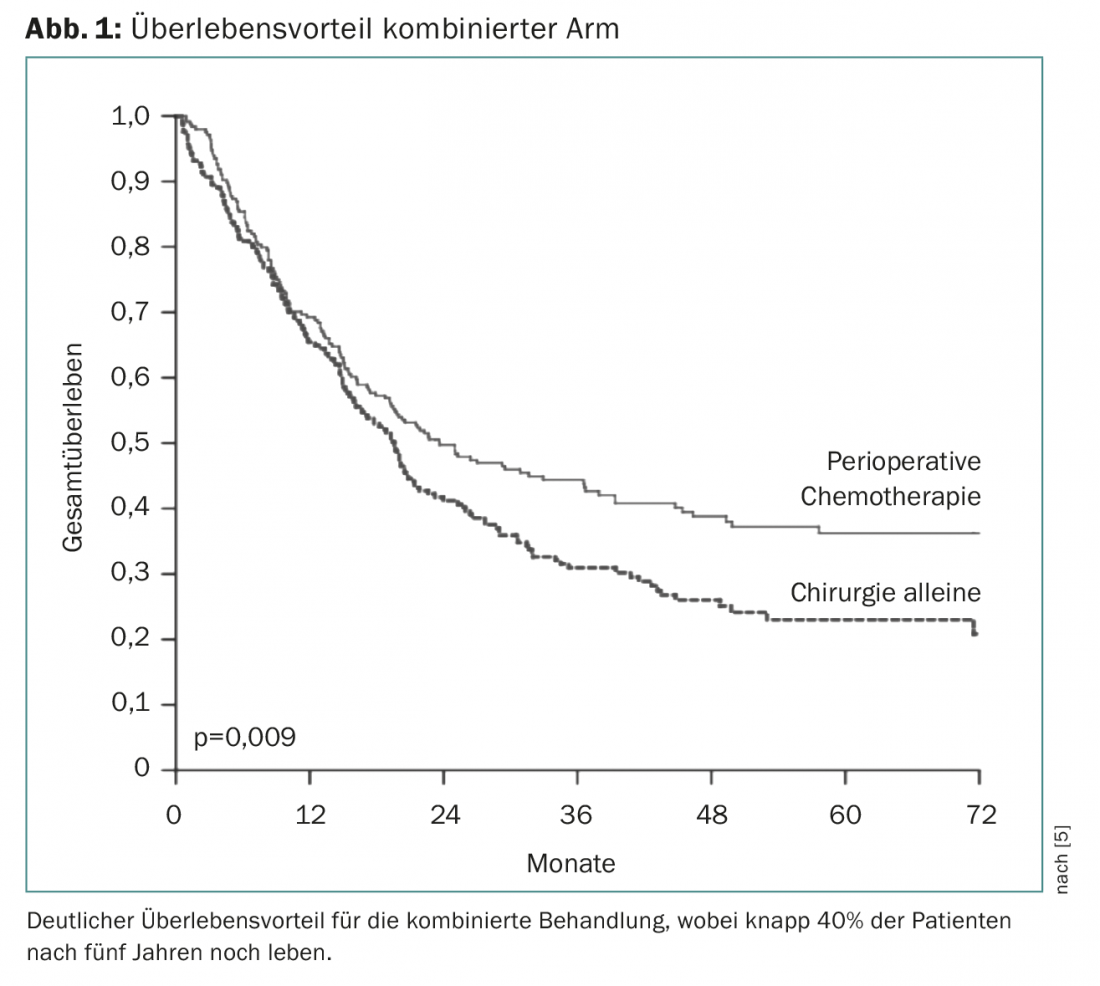
A quimioterapia peri-operatória estabeleceu-se pela primeira vez com o ensaio europeu MAGIC. Esta quimioterapia investigada com três ciclos de epirubicina, cisplatina e 5FU (ECF) antes da cirurgia e três ciclos de ECF após a cirurgia vs. cirurgia sozinha [5]. Isto mostrou uma clara vantagem de sobrevivência para o braço combinado, de modo que este tratamento se tornou o padrão a partir de 2006 (Fig. 1) . A terapia peri-operatória foi ainda mais confirmada como o princípio (apenas em relação à quimioterapia) no ensaio FNLCC/FFCD ou no ensaio EORTC-40954. Estes estudos diferem quanto à duração da quimioterapia perioperatória e quanto à composição das substâncias. O tipo de quimioterapia perioperatória foi mais desenvolvido principalmente no estudo AIO-FLOT4, no qual três substâncias eficazes (5FU, oxaliplatina, docetaxel) foram comparadas ao longo de quatro ciclos antes e depois da cirurgia contra o padrão anterior do estudo Magic (ECF/ECX) antes e depois da cirurgia. Isto mostrou uma clara vantagem de sobrevivência de 35 a 50 meses com uma tolerância surpreendentemente boa da quimioterapia perioperatória FLOT, de modo que este regime se tornou um padrão indiscutível até à data [6].
O modelo americano surgiu historicamente do facto de que os pacientes só eram apresentados à equipa interdisciplinar após a cirurgia. Hoje em dia, os casos são normalmente discutidos pré-operatoriamente no conselho interdisciplinar de tumores. Com base nos dados disponíveis, a terapia perioperatória do sistema deve ser considerada hoje já a partir da fase cT2cN0. As seguintes razões falam a favor desta abordagem:
- A fase não raro é mais avançada do que a determinada pelos exames de encenação
- O prognóstico é normalmente determinado por metástases distantes e muito menos frequentemente por recidivas locais
- As quimioterapias pós-operatórias podem por vezes não ser aplicadas de todo ou apenas parcialmente (recuperação pós-operatória atrasada).
- Os principais ensaios que testaram quimioterapias perioperatórias incluíram pacientes da fase cT2cN0.
Um grande ensaio de fase III (ensaio FLOT5) está actualmente a investigar se os pacientes com tumor gástrico/GEJ e metástases limitadas devem beneficiar de cirurgia (quimioterapia perioperatória) ou ser tratados apenas com quimioterapia FLOT [7]. Considerando as técnicas cirúrgicas melhoradas e o muito promissor estudo precursor FLOT4 [8], a questão deste estudo é muito interessante. Infelizmente, os resultados do primeiro estudo não são esperados até 2022.
Terapia do sistema paliativo
O compromisso entre os benefícios da terapia e os efeitos secundários associados à terapia é, como sempre, crucial na situação paliativa. A terapia do sistema paliativo leva, em princípio, a um prolongamento da sobrevivência e a uma melhoria da qualidade de vida. Não existe um padrão claro para o tratamento de primeira linha. Como regra, uma combinação de duas drogas (por exemplo, 5FU/oxaliplatina) ou, se o paciente estiver em bom estado geral e altamente motivado para a terapia, é utilizada uma combinação de três drogas tal como a terapia FLOT acima mencionada. Nos estudos, a terapia era geralmente realizada sem interrupção até à progressão, efeitos secundários graves ou interrupção da terapia pelo paciente. Na prática, a terapia é muito raramente realizada durante mais de doze meses, mas normalmente apenas durante seis meses.
Aproximadamente 20-25% dos carcinomas gástricos são HER2-positivos. Após o estudo TOGA, estes pacientes ainda recebem terapia padrão de primeira linha com cisplatina, 5FU (ou capecitabina) e trastuzumab [9]. O grau de amplificação do HER2 tem algum valor preditivo para a resposta ao tratamento e sobrevivência. Trastuzumab prolonga a sobrevivência por quase três meses em comparação com cisplatina e 5FU/capecitabina mais placebo. Infelizmente, em contraste com o carcinoma da mama, as novas terapias com HER2 (como o lapatinibe ou o T-DM1) não foram bem sucedidas, provavelmente devido à expressão fundamentalmente menor do HER2 no carcinoma gástrico em comparação com o carcinoma da mama.
Na segunda linha, a quimioterapia também é importante, uma vez que tanto os taxanos como os irinotecanos demonstraram um benefício global de sobrevivência em ensaios de fase III (embora com um número insuficiente de doentes). O anticorpo anti-VEGFR2 ramucirumab também prolonga a sobrevivência em doentes com progressão após terapia de primeira linha quando usado como monoterapia versus placebo [10]. Este resultado foi surpreendente porque outros anticorpos VEGF não mostraram qualquer efeito como monoterapia. Ramucirumab também prolongou a sobrevivência global em combinação com paclitaxel (versus paclitaxel mais placebo) num ensaio de fase III (de 7,4 a 9,6 meses, HR=0,807), pelo que este composto é agora aprovado sozinho e em combinação com paclitaxel na Suíça após pré-tratamento [11].
Imunoterapia
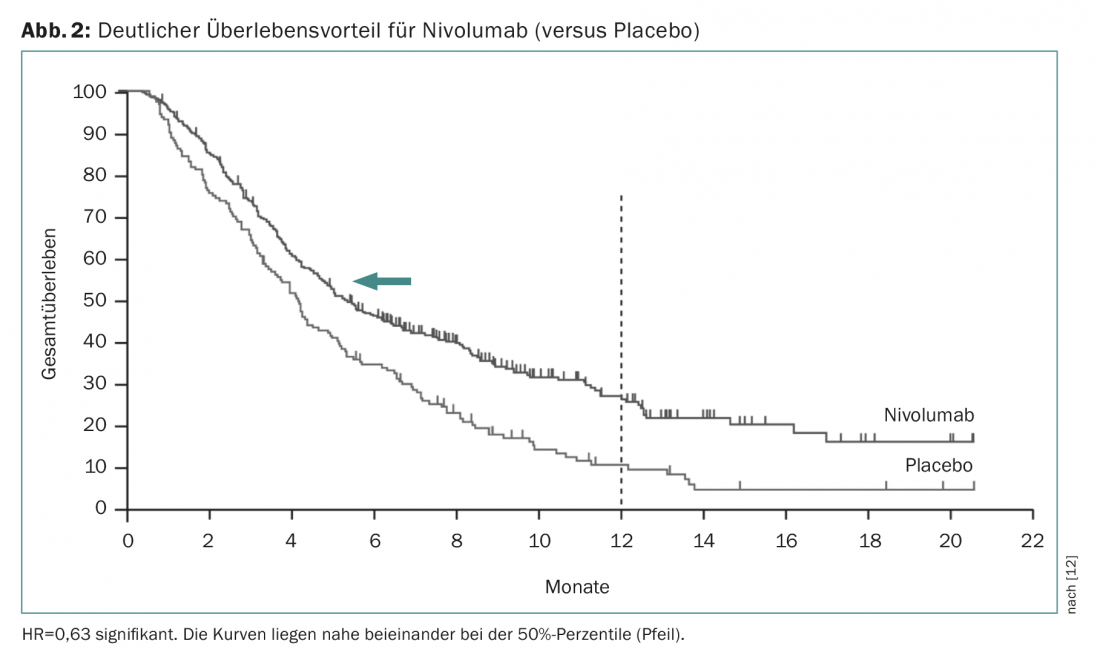
Nivolumab é um anticorpo monoclonal humano (inibidor do ponto de controlo) que se liga especificamente ao receptor PD1 em células T activadas. Num ensaio de fase III (ensaio de atracção), este tratamento demonstrou um benefício de sobrevivência de 4,1 a 5,3 meses em doentes pré-tratados em comparação com o placebo [12]. A razão de perigo foi muito mais significativa (0,63, significativa), o que mostra que os tempos médios de sobrevivência dependem fortemente do curso das curvas de sobrevivência (Fig. 2) . O Nivolumab já está aprovado no Japão para esta indicação. Uma vez que os estudos foram realizados com doentes asiáticos e porque o efeito se baseia essencialmente em alguns doentes que respondem bem, ainda não se sabe se a aprovação será também concedida na Suíça. O Prembrolizumab é outro inibidor do ponto de controlo que já é amplamente utilizado clinicamente. Isto recebeu agora a correspondente aprovação nos EUA com base num ensaio de fase II mais amplo (ensaio KEYNOTE-059), se a expressão PD-L1 puder ser detectada no tecido tumoral (pelo menos em 1% das células tumorais ou do estroma). Como regra geral, pode esperar-se uma resposta em 20% dos pacientes com inibição do ponto de controlo. Embora ocorram efeitos secundários fatais, estas imunoterapias são geralmente muito bem toleradas e produzem uma melhoria clínica sustentada notável nos cerca de 20% dos pacientes que conseguem uma resposta.
Testes moleculares
Na era das terapias específicas, coloca-se a questão de saber quais os testes específicos actualmente úteis para os tumores gástricos/GEJ. Para além dos testes HER2, o teste de instabilidade dos microssatélites no que diz respeito à inibição dos pontos de controlo deve certamente ser mencionado aqui. Embora menos adequado como marcador preditivo do que a instabilidade por microsatélite, como mencionado acima, testar a expressão PD-L1 é útil em relação à inibição do ponto de controlo, especialmente no que diz respeito ao tratamento com pembrolizumab. Apesar da investigação intensiva, outras alterações moleculares são demasiado raras ou não têm actualmente consequências terapêuticas para a prática clínica.
Resumo
A cirurgia é a primeira escolha para o cancro gástrico localizado. A utilização da terapia de sistema peri- ou pós-operatória pode melhorar as taxas de cura. A terapia sistémica paliativa pode prolongar a vida e também melhorar a qualidade de vida.
Mensagens Take-Home
- Na situação curativa, a terapia perioperatória com docetaxel, oxaliplatina e fluorouracil/leucovorin (FLOT) deve ser discutida com o doente da fase cT2.
- Terapia do sistema paliativo: Nos últimos anos, apenas o ramucirumab recebeu aprovação como monoterapia ou em combinação. A inibição do ponto de controlo é claramente eficaz numa pequena proporção de pacientes. A instabilidade dos microssatélites é de longe o melhor factor preditivo do que a expressão PD-L1.
Literatura:
- Macdonald JS, et al: Quimioradioterapia após cirurgia comparada com cirurgia apenas para adenocarcinoma da junção estomacal ou gastroesofágica. N Engl J Med 2001; 345: 725-730.
- Al-Batran SE, et al: Effect of Neoadjuvant Chemotherapy Followed by Surgical Resection on Survival in Patients With Limited Metastatic Gastric or Gastroesophageal Junction Cancer. O Julgamento AIO-FLOT3. JAMAOncologia 2017; 3: 1237-1244.
- Noh SH, et al: capecitabina adjuvante mais oxaliplatina para cancro gástrico após gastrectomia D2 (CLÁSSICA): seguimento de 5 anos de um ensaio de fase 3 aberto e aleatorizado. Lancet Oncol 2014; 15: 1389-1396.
- Lee J, et al: Ensaio Fase III comparando capecitabina mais cisplatina versus capecitabina mais cisplatina com radioterapia simultânea de capecitabina em cancro gástrico completamente ressecado com dissecção de gânglios linfáticos D2: o ensaio ARTIST. J Clin Oncol 2012; 30: 268-273.
- Cunningham D, et al: Quimioterapia peri-operatória versus cirurgia apenas para o cancro gastroesofágico ressecável. N Engl J Med 2006; 355: 11-20.
- Al-Batran SE, et al: Quimioterapia perioperatória com docetaxel, oxaliplatina, e fluorouracil/leucovorina (FLOT) versus epirubicina, cisplatina, e fluorouracil ou capecitabina (ECF/ECX) para a junção gástrica ou gastroesofágica ressecável (GEJ) adenocarcinoma (FLOT4-AIO): Um ensaio multicêntrico, fase 3 aleatorizado. Reunião Anual da ASCO de 2017; Sessão Oral Resumida 1.
- Al-Batran SE, et al.: O ensaio RENAISSANCE (AIO-FLOT5): efeito da quimioterapia sozinha vs. quimioterapia seguido de ressecção cirúrgica na sobrevivência e qualidade de vida em pacientes com adenocarcinoma metastático limitado do estômago ou junção esofagogástrica – um ensaio fase III da AIO/CAO-V/CAOGI alemã. BMC Cancer 2017; 17: 893.
- Al-Batran SE, et al: regressão histopatológica após docetaxel neoadjuvante, oxaliplatina, fluorouracil, e leucovorina versus epirubicina, cisplatina, e fluorouracil ou capecitabina em doentes com adenocarcinoma de junção gástrico ou gastro-esofágico ressecável (FLOT4-AIO): resulta da parte da fase 2 de um ensaio multicêntrico, aberto, fase 2/3 aleatorizado. Lancet Oncology 2016; 17: 1697-1708.
- Bang YJ, et al: Trastuzumab em combinação com quimioterapia versus quimioterapia apenas para o tratamento do cancro de junção gástrico ou gastro-esofágico avançado HER2-positivo (ToGA): uma fase 3, rótulo aberto, ensaio controlado aleatório. Lancet 2010; 376: 687-697.
- Fuchs CS, et al: monoterapia Ramucirumab para adenocarcinoma de junção gástrico ou gastro-esofágico avançado previamente tratado (REGARD): um ensaio internacional, randomizado, multicêntrico, controlado por placebo, fase 3. Lancet 2014 Jan 4; 383(9911): 31-39.
- Wilke H, et al: Ramucirumab plus paclitaxel versus placebo plus paclitaxel em doentes com adenocarcinoma de junção gástrica ou gastro-esofágica avançada previamente tratada (RAINBOW): um ensaio duplo-cego, fase 3 aleatorizada. Lanceta 2014; 15: 1224-1235.
- Kang YK, et al: Nivolumab em doentes com cancro de junção gástrico ou gastro-esofágico avançado refractário ou intolerante a, pelo menos, dois regimes de quimioterapia anteriores (ONO-4538-12, ATTRACTION-2): um ensaio aleatório, duplo-cego, controlado por placebo, fase 3. Lancet 2017; 390: 2461-2471.
InFo ONcOLOGy & HaEMATOLOGy 2018; 6(3): 14-17.