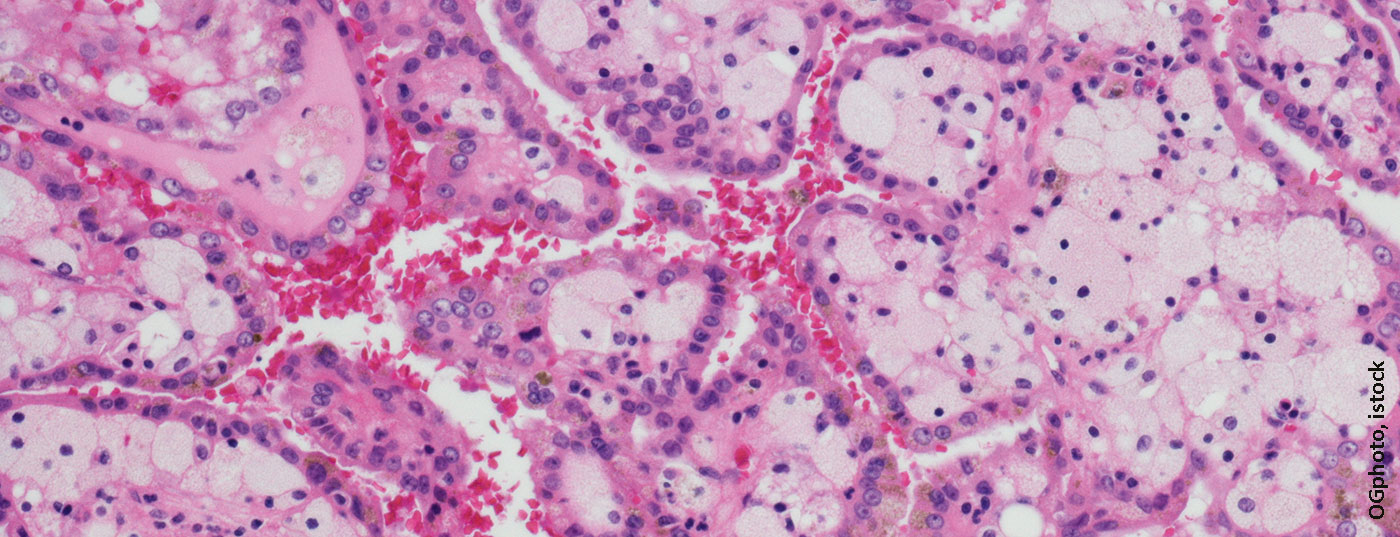
O carcinoma das células renais é uma das entidades tumorais bastante raras. Portanto, as opções de tratamento foram muito limitadas durante anos e a terapia foi difícil. Entretanto, as opções poderiam ser expandidas por inibidores de tirosina cinase. A terapia com inibidores de pontos de controlo também é concebível.
Com uma quota de 2,4% de novos casos de cancro por ano na Suíça, o carcinoma das células renais é uma das entidades tumorais mais raras [1]. O carcinoma de células ligeiras de células renais é o maior subgrupo de todos os carcinomas de células renais, sendo responsável por aproximadamente 75% [2]. Os factores de risco importantes para o desenvolvimento de tumores renais são o consumo de nicotina, obesidade, exposição profissional a solventes, petrolatos e herbicidas [3,4]. Aproximadamente 2% de todos os carcinomas de células renais estão associados a síndromes de predisposição tumoral, como a doença de von Hippel-Lindau [5].
Aproximadamente 12% dos novos diagnósticos são tumores metastáticos primários devido à presença de metástases distantes [6]. Durante muitos anos, as opções de tratamento para o carcinoma metastático de células renais foram muito limitadas e o tratamento foi difícil. Em 2007, pela primeira vez, o sunitinib como terapia de primeira linha no cenário metastático, uma substância do grupo dos inibidores da tirosina quinase (TKIs), demonstrou prolongar a sobrevivência sem progressão (PFS) e aumentar a taxa de resposta em comparação com o interferon-alfa [7]. Pouco mais de 10 anos depois, o ensaio de fase III CheckMate-214 mostrou superioridade do inibidor de ponto de controlo (CPI) nivolumab em combinação com o inibidor CTLA-4 ipilimumab sobre o sunitinib de terapia padrão que tinha sido utilizado até então [8]. Esta investigação foi seguida de outros estudos – alguns apenas com CPI ou também com terapias combinadas com CPI e TKI (Fig. 1). Este artigo da CME trata exclusivamente do tratamento do carcinoma das células renais ligeiras na situação metastásica.
Classificação de risco
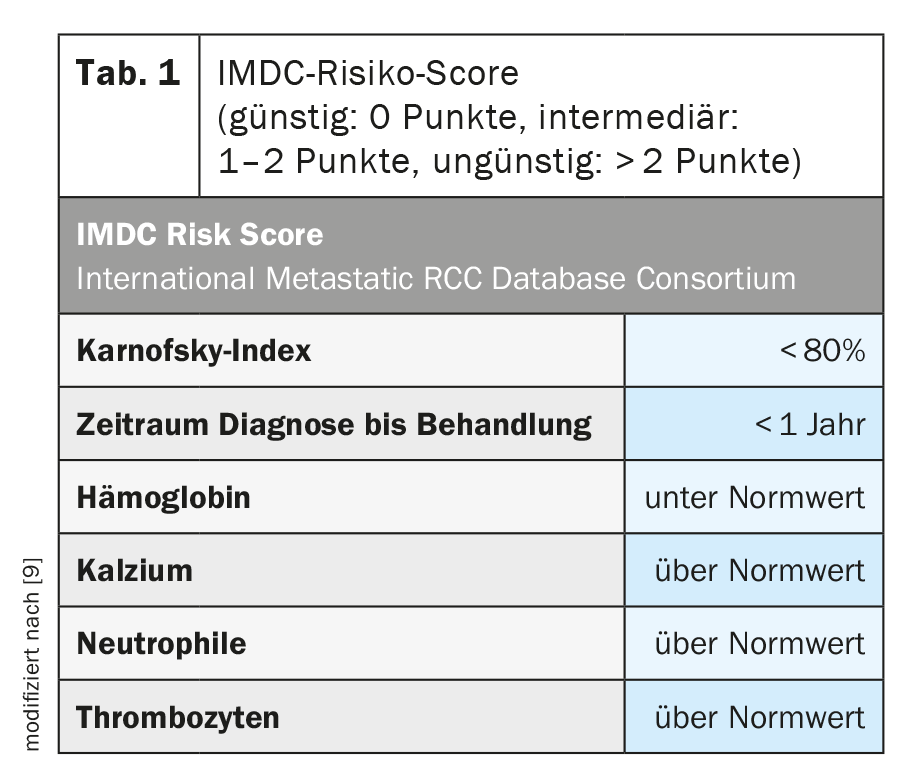
Para uma melhor avaliação da situação tumoral, bem como do seu prognóstico, foi desenvolvida uma classificação de risco (Tab. 1) . Dependendo da pontuação obtida na pontuação de risco do IMDC, a doença pode ser classificada nos seguintes grupos de risco: favorável, intermédio ou desfavorável. Esta classificação não só é importante para estimar o prognóstico, como também foi e está incluída em estudos clínicos de estratificação e provou ser preditiva para intervenções terapêuticas [10].
Terapia de primeira linha
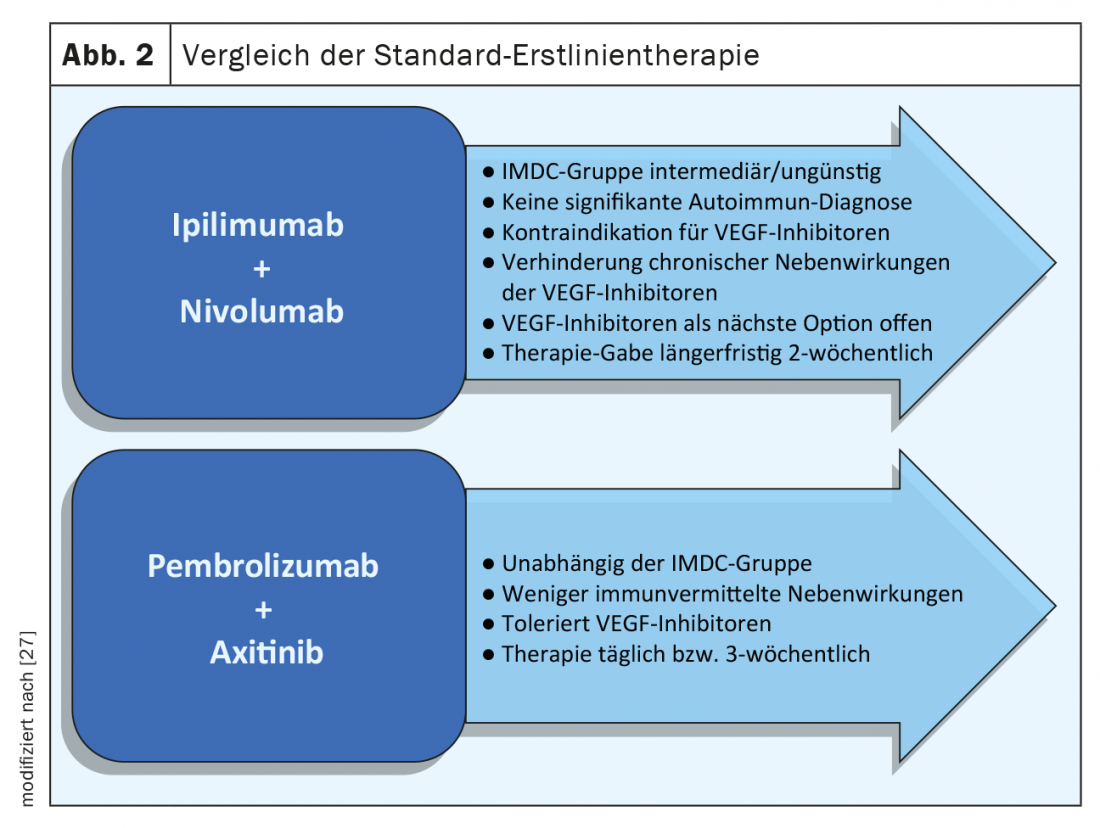
O tratamento do carcinoma metastático de células renais mudou significativamente nos últimos anos devido ao uso de novos medicamentos de grupos de substâncias conhecidas (por exemplo, TKIs), mas também devido à aplicação de novas opções terapêuticas, tais como a imunoterapia. Em 2018, o ensaio CheckMate-214 demonstrou uma melhoria na taxa de resposta objectiva e sobrevivência global (OS) com ipilimumab em combinação com nivolumab em comparação com o sunitinib. O OS tinha 47 meses no braço ipilimumab/nivolumab em comparação com 26,6 meses no braço sunitinib com uma razão de perigo (HR) de 0,66 (p<0,0001) [11]. Este efeito de tratamento é limitado nas análises a doentes com um risco IMDC intermédio ou desfavorável. Numa constelação de risco favorável, o sunitinib mostra uma melhor taxa de resposta global e também uma melhor OS em comparação com a imunoterapia.
Seguiram-se outros estudos na terapia de primeira linha do carcinoma metastático das células renais. O ensaio Keynote 426 comparou a combinação do inibidor PD-1 pembrolizumab e o axitinibe TKI apenas com o sunitinib. A combinação terapêutica melhorou significativamente tanto o SO como o PFS em comparação com o sunitinib (p<0,001) [12]. Estes resultados foram observados nos três grupos de risco do IMDC – favoráveis, intermédios e desfavoráveis .
Nos ensaios Checkmate-214 e Keynote-426, a remissão completa (CR) foi observada em aproximadamente 9% para as abordagens de imunoterapia.
No congresso da ESMO deste ano, foram apresentados dados do ensaio CheckMate 9ER, comparando a terapia combinada nivolumab e cabozantinibe versus sunitinibe, também na terapia de primeira linha [13]. No processo, Choueiri et al. mostrou que esta terapia combinada alcançou uma melhoria significativa em PFS de 8,3 meses (monoterapia de sunitinibe) para 16,6 meses (nivolumab + cabozantinibe). Foi também encontrado um SO prolongado com um HR de 0,60. A taxa de resposta objectiva (ORR) foi particularmente impressionante, com 55,7% no braço combinado vs. 27,1% com sunitinib. O período de observação de 18 meses até à data é ainda relativamente curto, de modo que ainda não é claro, neste momento, até que ponto a resposta terapêutica é a longo prazo.
As comparações entre estes três estudos são difíceis porque foram incluídos diferentes grupos prognósticos e a distribuição dos doentes no mesmo foi diferente. Os tempos de observação também diferem consideravelmente. Os regimes de combinação CPI com TKI (Keynote-426 e CheckMate 9ER) já mostraram uma diferença na sobrevivência global após um mês, enquanto que a combinação ipilimumab e nivolumab só mostrou uma diferença após 6 meses. Consequentemente, a decisão terapêutica poderia recair sobre uma terapia de combinação TKI em vez de uma imunoterapia apenas no caso de alta pressão terapêutica.
Para o tratamento de primeira linha no carcinoma metastático de células renais, existem também dados de ensaios sobre o tratamento com avelumab em combinação com axitinibe (ensaio JAVELIN-Renal-101) [14]. Isto demonstrou um PFS prolongado em comparação com o sunitinib, mas não mostrou este benefício nos dados do SO. Não está a ser solicitada aprovação na Suíça para a combinação avelumab + axitinibe.
A terapia com um inibidor de tirosina cinase por si só continua a ser uma opção na ausência de disponibilidade ou contra-indicações a uma das novas terapias de combinação padrão, especialmente para pacientes com risco favorável e dinâmica de doença muito lenta.
A vigilância activa também é possível em doentes bem seleccionados, como se pode ver numa publicação de Rini et al. A mediana do tempo que os pacientes puderam ser observados até ao início da terapia sistémica foi de 14,9 meses [15].
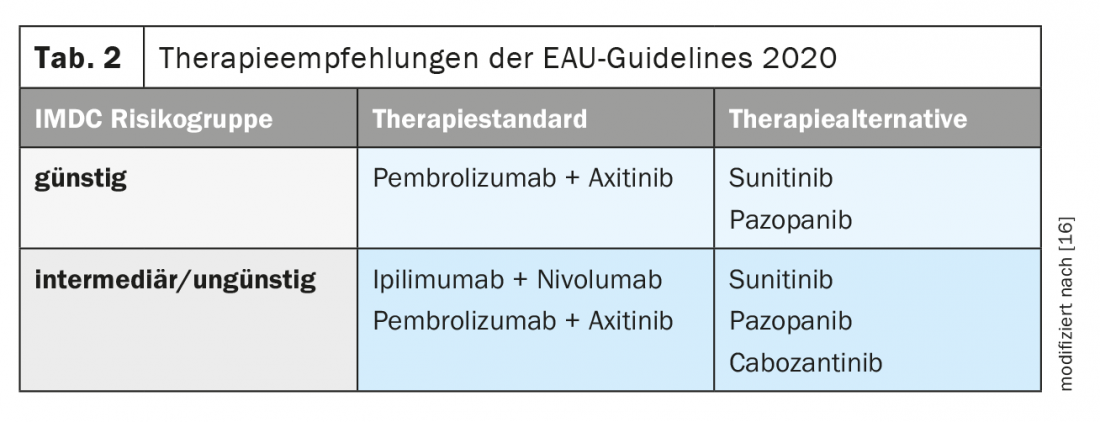
Na actual directriz sobre carcinoma de células renais da Associação Europeia de Urologia (EAU), foram registadas recomendações de tratamento (Tab. 2) [16].
Os resultados estão ainda pendentes do ensaio CLEAR fase III, que compara a combinação de lenvatinib + everolimus ou lenvatinib + pembrolizumab com o sunitinib sozinho como terapia de primeira linha no carcinoma metastático das células renais com um desenho de 3 braços. Lenvatinib e o inibidor PD-1 mostraram resultados promissores no cancro endometrial avançado, num estudo publicado este ano [17].
Terapia de segunda linha
A escolha da classe de substância para a terapia de duas linhas depende directamente da terapia de primeira linha já administrada. No estudo Checkmate-025 da fase III, o nivolumab foi comparado com o everolimus depois de 1-2 terapias VEGF previamente orientadas. A imunoterapia melhorou tanto o SO como a qualidade de vida. A toxicidade de grau 3/4 era também menos frequente com o nivolumab em comparação com o everolimus (19% vs. 37%). Não se observaram melhorias no PFS [18]. Uma melhoria comparável no OS, ou seja, em cerca de 5 meses, também poderia ser demonstrada com cabozantinib em comparação com a terapia com everolimus (estudo Meteorológico) [19].
A influência da terapia de primeira linha com inibidores de pontos de controlo nas terapias de sistema subsequentes não é clara, uma vez que até à data não estão disponíveis dados de ensaios aleatórios. Contudo, está actualmente a ser recrutado na Suíça um ensaio de fase II (CaboPoint), no qual o cabozantinib está a ser investigado como terapia de segunda linha – na coorte A após terapia de primeira linha com ipiliumumab e nivolumab e na coorte B em caso de progressão para uma terapia combinada CPI e terapia orientada para VEGF.
Também, num ensaio de fase III também disponível na Suíça, a molécula MK-6482 PN011 – um inibidor HIF-2α – está a ser comparada ao cabozantinib em combinação com lenvatinib como uma terapia de duas linhas. HIF como um factor induzido pela hipoxia está envolvido na expressão dos factores de crescimento VEGF.
Os dados de um ensaio fase II de lenvatinib + pembrolizumb após a progressão da terapia PD-1/PD-L1 CPI foram apresentados na ASCO 2020. O ORR após 24 semanas foi de 55% (irRECIST segundo a Avaliação do Investigador), o PFS 11,7 meses. Este tratamento parece assim promissor mesmo após imunoterapia prévia [20].
Perfil de efeito colateral
Devido aos diferentes mecanismos de acção das classes de substâncias utilizadas no carcinoma metastático das células renais, existem também diferentes perfis de efeitos secundários. No caso das imunoterapias, estes são os chamados efeitos secundários imuno-mediados, em que são possíveis reacções nos mais diversos órgãos e os efeitos secundários podem por vezes ser também graves. É crucial conhecê-los, reconhecê-los e tratá-los numa fase precoce. Os efeitos secundários especialmente raros, como a miocardite e a neurotoxicidade, têm de ser considerados [21,22]. A administração de imunoterapias, bem como a prestação de mais cuidados aos doentes, deve, portanto, ser levada a cabo por uma equipa de médicos experientes, sendo geralmente expedita uma abordagem interdisciplinar. O estudo CheckMate-214 mostrou que a qualidade de vida relacionada com a saúde era melhor nos doentes tratados com ipilimumab + nivolumab em comparação com o sunitinib sozinho [23]. Consequentemente, a incidência de eventos adversos de grau 3/4 foi maior com o sunitinib. Os efeitos secundários mais comuns das TKIs incluem diarreia, toxicidade cutânea, fadiga e possíveis alterações hematológicas e cardíacas.
Para além das diferentes classes de substâncias, existem também diferenças nos intervalos de aplicação e terapia. Enquanto o ipilimumabe/nivolumabe é mudado para nivolumabe sozinho após três meses, as terapias combinadas CPI e TKI envolvem a ingestão contínua de comprimidos com terapia de infusão adicional, cujas toxicidade a longo prazo devem ser consideradas. A terapia com comprimidos é facilmente controlável e os efeitos secundários são normalmente reversíveis rapidamente após a descontinuação (Fig. 2) . Para apoiar os doentes e melhorar a adesão e a segurança, podem ser utilizados folhetos da Sociedade Suíça de Oncologia Médica (SGMO) e da Oncology Care Switzerland (OPS) [24].
Marcadores moleculares
Os marcadores moleculares poderiam ajudar a fazer a melhor escolha de tratamento entre as muitas opções de tratamento. No entanto, para além da pontuação de risco IMDC, não existe um marcador preditivo reconhecido que possa ser utilizado na tomada de decisões.
De acordo com dados da Checkmate-214, a expressão PD-L1 parece ser importante para responder à terapia com ipilimumab/nivolumab (expressão PD-L1 <1%: ORR 37%; expressão PD-L1 ≥1%: ORR 54%) e para PFS (expressão PD-L1 <1%: PFS 11 meses; expressão PD-L1 ≥1%: PFS 22,8 meses preditivos [10]. No entanto, não houve diferença em termos de OS. Assim, o significado de -PD-L1 continua a ser controverso. No estudo Keynote-426, bem como no estudo CheckMate-9ER, não foi observada até agora nenhuma correlação entre o nível de expressão PD-L1 e a resposta à terapia.
O ensaio IMmotion151 comparou o atezolizumab/bevacizumab com o sunitinib [25]. Além disso, foram efectuadas várias análises de biomarcadores, não tendo sido possível demonstrar qualquer correlação entre o PFS e a “carga mutacional tumoral” (TMB). No entanto, foi demonstrado que assinaturas de expressão genética específicas estão associadas a efeitos de tratamento. Por exemplo, a detecção de uma assinatura de angiogénese correlacionada com a resposta ao sunitinibe. Em contraste, uma assinatura em T mostrou um benefício de imunoterapia com atezolizumab [26]. No estudo BIONIKK, um estudo prospectivo randomizado da fase II apresentado na OMPE deste ano, foram investigados diferentes grupos moleculares relativamente à resposta terapêutica às diferentes substâncias terapêuticas. Isto mostrou uma melhor resposta dos tumores “imuno-elevados” à imunoterapia com nivolumab e dos tumores “angioelevados” à terapia com TKI. Estas investigações moleculares parecem promissoras e estarão provavelmente disponíveis no futuro para ajudar na escolha da terapia.
Para além destes marcadores moleculares do tumor, factores relacionados com o doente, tais como idade, comorbilidades e preferências, são actualmente também tidos em conta na decisão de tratamento.
Mensagens Take-Home
- O padrão terapêutico actual na terapia de primeira linha do carcinoma das células ligeiras metástáticas é o pembrolizumab/auxinibe para todos os grupos de risco e o ipilimumab/nivolumab para doentes com risco intermédio ou desfavorável (IMDC).
- A vigilância activa pode ser realizada em pacientes seleccionados e a monoterapia com um inibidor de tirosina quinase pode ser considerada se o risco for favorável.
- Existem novos dados para nivolumab em combinação com cabozantinibe, embora ainda falte aprovação para tal na Suíça.
- O perfil dos efeitos secundários dos vários medicamentos difere e pode ser decisivo para a escolha da terapia.
- Os estudos sobre assinaturas de expressão genética mostram diferentes respostas terapêuticas e são promissores.
Literatura:
- Krebsliga Schweiz: Cancro na Suíça: figuras importantes. Situação em Março de 2020. www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- Linehan WM, et al. Clin Cancer Res. 2007;13: 671s-679s.
- Gelfond J, et al: Modifiable risk factors to reduce renal cell canceroma incidence: Insight from the PLCO trial. Urol Oncol, 2018. 36(7): 340.e1-340.e6.
- McLaughlin JK, Lipworth L: Aspectos epidemiológicos do cancro de células renais. Semin Oncol, 2000. 27(2): 115-123.
- Shuch B, Zhang J: Genetic Predisposition to Renal Cell Carcinoma: Implications for Counselling, Testing, Screening, and Management. J Clin Oncol, 2018: Jco2018792523.
- Siegel RL, Miller KD, Jemal A: Estatísticas do cancro, 2020. CA Cancer J Clin, 2020. 70(1): 7-30.
- Motzer RJ, et al: Sunitinib versus interferon alfa em carcinoma metastático de células renais. N Engl J Med, 2007. 356(2): 115-124.
- Motzer RJ, et al: Nivolumab mais ipilimumab versus sunitinib em carcinoma avançado de células renais. N Engl J Med, 2018. 378(14): 1277-1290.
- Heng DY, et al: Factores prognósticos para a sobrevivência global em doentes com carcinoma metastático de células renais tratados com agentes-alvo do factor de crescimento endotelial vascular: resultados de um estudo grande e multicêntrico. J Clin Oncol, 2009. 27(34): 5794-5799.
- Méjean A, et al: Sunitinib Sozinho ou após Nefrectomia no Carcinoma Renal-Celular Metástático. N Engl J Med, 2018. 379(5): 417-427.
- Motzer RJ, et al: Nivolumab plus ipilimumab versus sunitinib em tratamento de primeira linha para o carcinoma avançado de células renais: acompanhamento alargado da eficácia e segurança resulta de um ensaio aleatório, controlado, fase 3. Lancet Oncol, 2019. 20(10): 1370-1385.
- Rini BI, et al: Pembrolizumab mais axitinibe versus sunitinibe para carcinoma avançado de células renais. N Engl J Med, 2019. 380(12): 1116-1127.
- Choueiri TK: 696O_PR- Nivolumab + cabozantinibe vs sunitinibe em tratamento de primeira linha para carcinoma avançado de células renais: primeiros resultados do ensaio CheckMate 9ER fase 3 aleatorizado. 2020: OMPE.
- Motzer RJ, et al: Avelumab mais axitinibe versus sunitinibe para carcinoma avançado de células renais. N Engl J Med, 2019. 380(12): 1103-1115.
- Rini BI, et al: Vigilância activa no carcinoma metastático de células renais: um ensaio prospectivo, fase 2. Lancet Oncol, 2016. 17(9): 1317-1324.
- Ljungberg, Orientações da UAE sobre Carcinoma Renal de Células. 2020: https://uroweb.org/guideline/renal-cell-carcinoma.
- Makker V, et al: Lenvatinib Plus Pembrolizumab em Pacientes com Cancro Endometrial Avançado. J Clin Oncol, 2020. 38(26): 2981-2992.
- Motzer RJ, et al: Nivolumab versus everolimus em carcinoma avançado de células renais. N Engl J Med, 2015. 373(19): 1803-1813.
- Choueiri TK, et al: Cabozantinib versus everolimus em carcinoma avançado de células renais. N Engl J Med, 2015. 373(19): 1814-1823.
- Chung-Han L: ensaio de fase II de lenvatinib (LEN) mais pembrolizumab (PEMBRO) para a progressão da doença após inibidor do ponto de controlo imunitário PD-1/PD-L1 (ICI) no carcinoma das células renais metástáticas claras (mccRCC). 2020: Journal of Clinical Oncology.
- Bonaca MP, et al: Myocarditis in the Setting of Cancer Therapeutics: Proposed Case Definitions for Emerging Clinical Syndromes in Cardio-Oncology. Circulação, 2019. 140(2): 80-91.
- Astaras C, et al: Eventos Neurológicos Adversos Associados a Inibidores de Pontos de Controlo Imune: Diagnóstico e Gestão. Curr Neurol Neurosci Rep, 2018. 18(1): 3.
- Cella D, et al: Resultados relatados por doentes com carcinoma renal avançado tratados com nivolumab mais ipilimumab versus sunitinib (CheckMate 214): um ensaio aleatório, fase 3. Lancet Oncol, 2019. 20(2): 297-310.
- https://oraletumortherapie.ch.
- Rini BI, et al: Atezolizumab mais bevacizumab versus sunitinib em doentes com carcinoma de células renais metastático (IMmotion151) previamente não tratado: um ensaio controlado multicêntrico, aberto, fase 3, aleatorizado. Lancet, 2019. 393(10189): 2404-2415.
- McDermott DF, et al: Actividade clínica e correlatos moleculares de resposta ao atezolizumabe sozinho ou em combinação com o bevacizumabe versus sunitinib em carcinoma de células renais. Nat Med, 2018. 24(6): 749-757.
- Heng DY: ASCO 2020.
InFo ONCOLOGY & HEMATOLOGY 2020; 8(6): 6-9