Os tumores da cabeça e pescoço foram o sétimo cancro mais comum a nível mundial em 2018. Os factores de risco mais importantes incluem o consumo de nicotina e álcool. O prognóstico e as opções de tratamento multimodalidade para pacientes com tumores de cabeça e pescoço variam em função de factores epidemiológicos, localização anatómica e estádio do tumor. Uma visão geral.
Os tumores da cabeça e pescoço foram o sétimo cancro mais comum a nível mundial em 2018 (890.000 novos casos) [1]. Nos EUA, os tumores da cabeça e do pescoço foram responsáveis por 3% de todos os cancros (51 540 novos casos) e por pouco mais de 1,5% de todas as mortes por cancro (10 030 mortes) [2]. Estas malignidades estão sobretudo associadas ao consumo de nicotina e álcool como os factores de risco mais importantes. Nas últimas décadas, observou-se um declínio global na incidência, em particular devido à diminuição do consumo de nicotina [3,4]. Em contraste, foi demonstrado um aumento do cancro orofaríngeo em pessoas mais jovens na América do Norte e no norte da Europa, principalmente devido a uma incidência crescente de tumores associados a subtipos de papilomavírus humano de alto risco (HPV) (especialmente HPV tipo 16)[4,5].
O prognóstico e as opções de tratamento multimodal para os doentes com tumores da cabeça e do pescoço variam em função de factores epidemiológicos, da localização anatómica e do estádio do tumor. Os tumores na cabeça e pescoço representam um grupo heterogéneo de doenças. O foco deste artigo de revisão está nas opções de tratamento para carcinomas escamosos recorrentes e metastáticos, bem como carcinomas escamosos localmente avançados com origem nas mucosas (predominantemente cavidade oral, faringe e laringe). O tratamento nas fases iniciais destes tumores não será aqui discutido, uma vez que não houve alterações relevantes na terapia nos últimos anos.
O tratamento de pacientes com tumores de cabeça e pescoço é complexo e inclui não só o tratamento médico do tumor e os efeitos agudos da cirurgia, quimioterapia e radioterapia, mas também orientação e aconselhamento no tratamento de deficiências permanentes e das consequências psicossociais resultantes. Felizmente, descobertas recentes levaram a melhorias significativas nos resultados do tratamento. Os avanços na cirurgia e radioterapia melhoraram a preservação funcional dos órgãos correspondentes e reduziram a morbilidade e mortalidade em geral. Por exemplo, as técnicas mais recentes de cirurgia assistida por robot para o carcinoma orofaríngeo [6] e as de microcirurgia laser minimamente invasiva para o carcinoma laríngeo e hipofaríngeo [7] podem aumentar de forma relevante a probabilidade de preservação da função. Os avanços na radioterapia isolada, tais como a radioterapia modulada por intensidade (IMRT) e a radioterapia guiada por imagem, podem também reduzir a morbilidade [8]. Em particular, a introdução de inibidores do ponto de controlo imunitário para o tratamento do cancro recorrente ou metastático da cabeça e pescoço melhorou significativamente o prognóstico de muitos pacientes, que será discutido em primeiro lugar a seguir.
Tumores recorrentes e/ou metástaseados na cabeça e pescoço
Os tumores recorrentes e/ou metastáticos da cabeça e do pescoço estão associados a um mau prognóstico. A maioria dos pacientes com recidiva primária localizada – como os pacientes com tumores metastáticos da cabeça e pescoço – recebem terapia sistémica paliativa, uma vez que apenas pacientes seleccionados com recidiva loco-regional podem ser tratados com cirurgia ou radioterapia renovada [9]. Assim, é sempre necessária uma avaliação interdisciplinar da situação da doença, de quaisquer tratamentos anteriores e da situação individual para a escolha individual da melhor estratégia terapêutica. Durante muitos anos, a terapia padrão para tumores recidivantes e/ou metastáticos foi o chamado “regime EXTREME”, que inclui quimioterapia à base de platina (cisplatina ou carboplatina) em combinação com fluorouracil (5-FU) e cetuximab, um anticorpo contra o receptor do factor de crescimento epidérmico (EGFR), seguido de terapia de manutenção com cetuximab [10]. O tratamento com o regime EXTREME mostrou uma sobrevivência global mediana de cerca de dez meses no estudo pivotal. Para pacientes que não eram elegíveis para o regime EXTREME, os taxanos e o metotrexato eram algumas das poucas opções de tratamento disponíveis. Com estas substâncias, a mediana de sobrevivência global cai para seis meses [11]. Estes dados mostram que são urgentemente necessárias novas opções de tratamento para os doentes com tumores recorrentes/metastáticos da cabeça e do pescoço.
Nos últimos anos, as terapias com inibidores de pontos de controlo têm-se estabelecido como um novo padrão em muitas entidades tumorais. Os tumores da cabeça e do pescoço estão associados a défices imunitários, tais como a alteração da função natural das células mortíferas e a diminuição dos linfócitos T infiltrantes do tumor, que é a razão para investigar os inibidores do ponto de controlo imunitário nestes tumores [11]. Nivolumab e pembrolizumab, ambos anticorpos monoclonais IgG4 anti-PD-1, foram estudados em ensaios de fase III em doentes com carcinoma espinocelular da cabeça e pescoço (cavidade oral, orofaringe, laringe ou hipofaringe) após falha da quimioterapia à base de platina e comparados com anticorpos ou quimioterapia da escolha do médico responsável pelo estudo (docetaxel, cetuximab ou metotrexato). A “falha da platina” foi definida como a progressão da doença dentro de seis meses após a quimioterapia contendo platina que tinha sido utilizada com intenção curativa (combinação com radioterapia) ou paliativa. O estudo CheckMate-141 é o primeiro estudo de fase III a demonstrar a eficácia do nivolumab em comparação com a quimioterapia (hazard ratio [HR] para morte 0,70; p=0,01). Além disso, o nivolumabe provou ser melhor tolerado (G3/4 efeitos secundários 13,1% vs. 35,1% para o nivolumabe e quimioterapia, respectivamente) e levou a uma melhoria na qualidade de vida [12,13]. Nivolumab foi a primeira opção de tratamento a melhorar significativamente a sobrevivência global em doentes com cancro recorrente/metastático da cabeça e pescoço que tinham falhado a quimioterapia à base de platina [12]. No estudo KEYNOTE-040, que foi concebido de forma semelhante ao estudo CheckMate 141, o pembrolizumab também aumentou a sobrevivência global em comparação com a quimioterapia [14]. Vale a pena mencionar que, em ambos os estudos, não foi exigida qualquer evidência da expressão PD-L1 como critério de inclusão e o parâmetro primário não dependia do estatuto PD-L1. Nenhum dos estudos mostrou uma diferença significativa na sobrevivência sem progressão. Semelhante a outros tumores sólidos, o aumento da sobrevivência global deveu-se assim principalmente ao facto de a imunoterapia ter levado ao controlo de doenças a longo prazo em alguns pacientes. Por exemplo, embora apenas 13% dos pacientes tenham apresentado uma resposta radiológica ao nivolumabe, a duração média da resposta foi de 9,7 meses – o dobro do tempo que com a quimioterapia [15]. Os anticorpos contra PD-L1 foram investigados tanto como monoterapia como em combinação com anticorpos contra CTLA-4 após falha da terapia baseada em platina. Na sequência dos estudos iniciais de Fase II com durvalumab (anticorpo anti-PD-L1) em doentes com elevada expressão de PD-L1 (≥25%) no estudo HAWK [16] e durvalumab, durvalumab mais tremelimumab (anticorpo anti-CTLA-4) ou tremelimumab isolado em doentes com baixa expressão de PD-L1 (<25%) no estudo CONDOR [17], foi iniciado o estudo de Fase III EAGLE [18]. Neste ensaio, os pacientes com recaídas/cancer de cabeça e pescoço com cancro da cabeça e pescoço que tinham falhado a terapia baseada em platina foram randomizados entre durvalumab mais tremelimumab, monoterapia de durvalumab ou quimioterapia padrão à escolha do médico do ensaio. O estudo não mostrou nenhum benefício de sobrevivência com durvalumab (HR 0,88; p=0,20) ou durvalumab mais tremelimumab (HR 1,04; p=0,76) em comparação com a quimioterapia. Considerando o poder limitado das comparações entre estudos, é de notar que a sobrevivência global mediana no braço durvalumab foi semelhante à nivolumab no ensaio CheckMate-141 (7,6 e 7,5 meses, respectivamente), mas a sobrevivência global mediana no braço de controlo foi numericamente mais longa no ensaio EAGLE em comparação com CheckMate-141 (8,3 meses e 5,1 meses, respectivamente). Uma análise exploratória do estudo EAGLE sugere que esta sobrevivência global superior à esperada no grupo de controlo pode dever-se a características desequilibradas aquando da inclusão no estudo (maior percentagem de doentes com ECOG PS 0 e metástases à distância sem recidiva local/regional no grupo de controlo), à maior utilização de paclitaxel no grupo de controlo e ao tratamento subsequente com anticorpos anti-PD-1 [18]. Até que ponto a diferença entre os anticorpos PD-1 e PD-L1 tem relevância clínica não é actualmente clara.
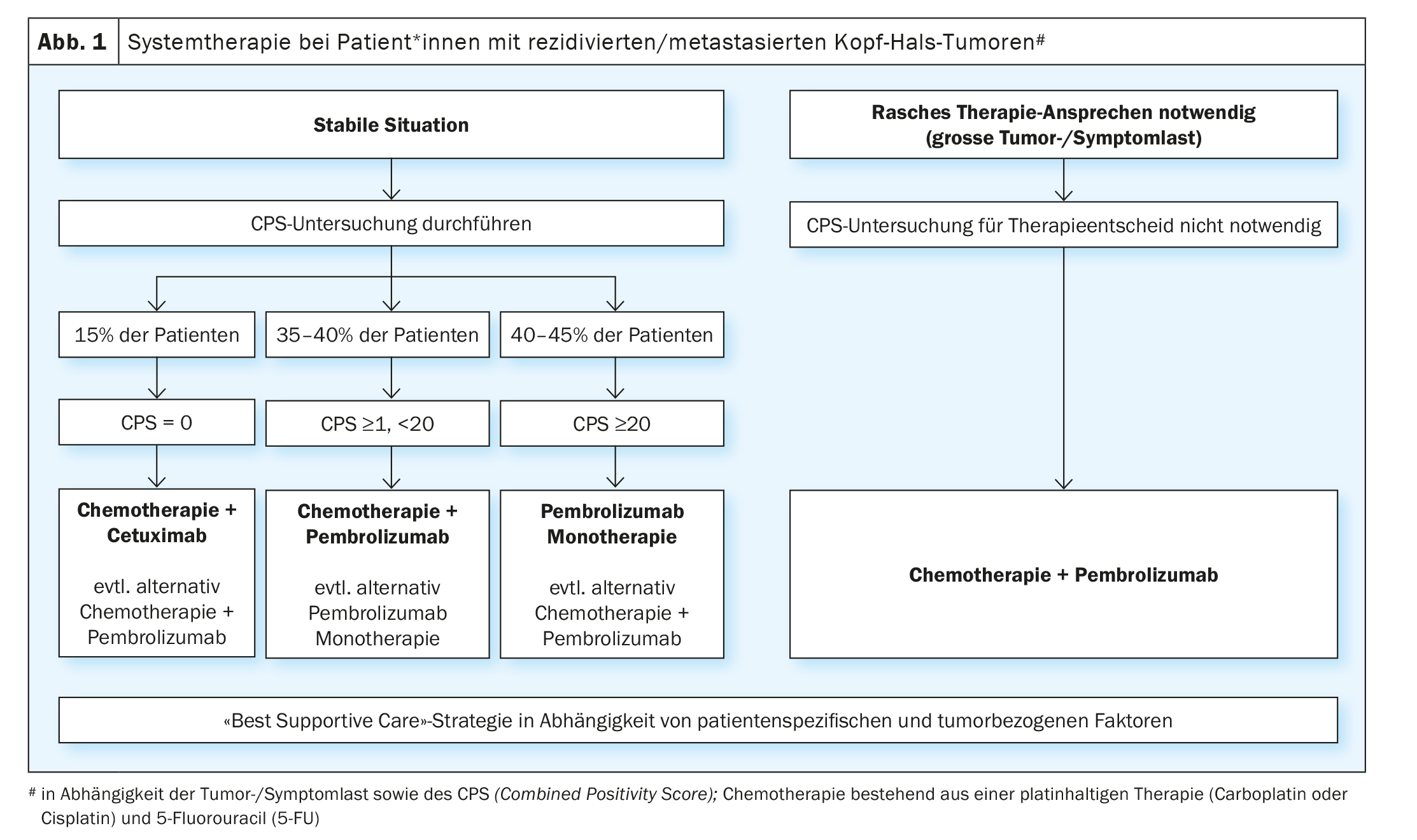
O benefício comprovado da terapia com inibidores do ponto de controlo imunitário em doentes com cancro da cabeça e pescoço recidivado/metastásico após falha da terapia à base de platina levou à avaliação destas substâncias na terapia paliativa de primeira linha. O ensaio aleatório fase III KEYNOTE-048 comparou a monoterapia com pembrolizumab e um tratamento combinado com platina/5-FU e pembrolizumab com o regime EXTREME (platina/5-FU/ cetuximab) [19]. Foram realizadas análises estatísticas para a sobrevivência global na população total e em subgrupos definidos, dependendo da expressão PD-L1. A expressão de PD-L1 foi categorizada de acordo com a chamada “pontuação de positividade combinada ” (CPS) (CPS ≥1 e ≥20). A SPCC é definida como o número de células PD-L1 positivas (células tumorais, linfócitos, macrófagos) dividido pelo número total de células tumorais e multiplicado por um factor de 100. A monoterapia com pembrolizumab melhorou significativamente a sobrevivência global em doentes com CPS ≥1 e ≥20. Embora a taxa de resposta fosse inferior à da quimioterapia (19-21% vs. 36%), a duração mediana da resposta foi multiplicada por cinco com monoterapia pembrolizumab (20,9 vs. 4,5 meses). A quimioterapia mais pembrolizumab melhorou significativamente a sobrevivência global nas três populações. Não houve diferença significativa na taxa de resposta e no tempo sem progressão entre o tratamento combinado de quimioterapia mais pembrolizumab e o regime EXTREME. Como esperado, a monoterapia pembrolizumab foi associada a uma menor toxicidade, enquanto a platina/5-FU mais pembrolizumab teve uma taxa de eventos adversos semelhante à do regime EXTREME. O ensaio fase III KESTREL randomizou pacientes 2:1:1 só para durvalumab, durvalumab mais tremelimumab ou para o regime EXTREME (NCT02551159). O ponto final primário é a sobrevivência global com durvalumab em monoterapia em comparação com EXTREME em doentes com elevada expressão de PD-L1 (definida como expressão de >50% nas células tumorais ou > 25% nos linfócitos infiltrantes do tumor). O ponto final secundário é a sobrevivência global com durvalumab mais tremelimumab em comparação com EXTREME para todos os pacientes. Ainda não foram publicados quaisquer dados. No entanto, foi anunciado através de comunicado de imprensa que o estudo não atingiu os seus pontos finais.
Para a terapia de primeira linha, pode resumir-se que o estudo KEYNOTE-048 é o primeiro estudo positivo desde a publicação do estudo EXTREME em 2009 e alterou o padrão de cuidados. No entanto, existem ainda algumas questões em aberto relativamente à prática diária. Uma delas é saber se os doentes com um CPS ≥20, que representaram 44% dos doentes com expressão PD-L1 comprovada no estudo KEYNOTE-048, foram a razão do benefício da monoterapia com pembrolizumab no grupo CPS ≥ 1. A questão de saber se a monoterapia com pembrolizumab é suficiente para pacientes com CPS 1-19 não pode ser respondida de forma inequívoca. Uma análise de subgrupo do ensaio KEYNOTE-048 mostrou que o pembrolizumab ainda tinha um benefício em comparação com o EXTREME na CPS 1-19 (HR 0,86), embora menor que nos pacientes* com CPS ≥20 (HR 0,58) [20]. Na prática clínica, a decisão a favor da monoterapia com pembrolizumab em vez da terapia combinada com platina/5-FU mais pembrolizumab para pacientes com CPS 1-19 depende principalmente do tumor e da carga dos sintomas. Além disso, as comorbidades e o estado geral das pessoas afectadas também devem ser tidos em conta. Em pacientes com CPS 1-19 e elevada carga tumoral e/ou sintomas significativos relacionados com tumores, a quimioterapia combinada é frequentemente preferida para maximizar a resposta potencial. Outra questão é sobre a sequência de tratamento dos doentes PD-L1-negativos, que constituem cerca de 15% dos afectados. Uma análise de subgrupo para pacientes PD-L1 negativos no estudo KEYNOTE 048 mostrou um benefício para o regime EXTREME em comparação com o tratamento combinado com pembrolizumab (HR 1.22) [20]. Contudo, dado o pequeno número de pacientes desta coorte e o facto de se tratar de uma análise não planeada de subgrupo, não se pode concluir que os pacientes PD-L1 negativos não devam ser tratados com a combinação de platina/5-FU e pembrolizumab. Em resumo, a monoterapia com pembrolizumabe em doentes com alta expressão de PD-L1 (CPS ≥20) e a terapia combinada de platina/5-FU e pembrolizumabe, independentemente da expressão de PD-L1, mas especialmente em tumores PD-L1 positivos, representam um novo padrão terapêutico (Fig. 1). Para pacientes que mostram progressão tumoral sob ou após esta terapia de primeira linha, as quimioterapias acima mencionadas (docetaxel, metotrexato) ou tratamento com cetuximab são opções de tratamento disponíveis. Novas abordagens imunoterapêuticas estão actualmente a ser investigadas em numerosos estudos. Por exemplo, o estudo INTERLINK-1 está aberto para recrutamento em vários centros na Suíça. Este ensaio aleatório compara o cetuximab com a combinação de cetuximab e o inibidor imunitário monalizumab dirigido contra o NKG2A (NCT04590963).
Além da expressão PD-L1, o estado HPV poderia também servir como biomarcador clínico para prever a resposta à terapia inibidora do ponto de controlo imunitário. A infecção por HPV leva à produção de proteínas relacionadas com o vírus que podem desencadear uma resposta celular T de novo e uma maior infiltração do tumor com células T CD8+ [21]. Na fase II do ensaio KEYNOTE-055, a taxa de resposta ao pembrolizumabe foi de 22% em doentes com tumores p16 positivos e de 16% em tumores p16 negativos [22]. Uma meta-análise também mostrou que o estado HPV parece estar correlacionado com a taxa de resposta ao tratamento anti-PD-1 independentemente da expressão da PD-L1 e da carga de mutação tumoral [23]. Outra meta-análise concluiu que os pacientes com tumores HPV positivos tiveram resultados significativamente melhores quando tratados com inibidores do ponto de controlo imunitário [24]. Se estes resultados são relevantes na prática clínica diária ainda não podem ser definitivamente avaliados. As actuais directrizes sobre imunoterapia para tumores de cabeça e pescoço ainda não recomendam a utilização do estado HPV para tomar decisões de tratamento [25].
Tumores de cabeça e pescoço localmente avançados
Mais de 60% dos doentes com carcinoma espinocelular da cabeça e pescoço têm estado III ou IV, que se caracteriza por grandes tumores com invasão local marcada, provas de metástases nos gânglios linfáticos regionais, ou ambos. As doenças localmente avançadas comportam um elevado risco de recorrência local (15% a 40%) e de metástases distantes [26]. As abordagens multimodais melhoraram as taxas de cura ao mesmo tempo que pretendiam preservar a função e a qualidade de vida [27]. As decisões terapêuticas nestas fases requerem um complexo equilíbrio de morbilidade, possíveis efeitos secundários e preservação da função. Dependem também fortemente do tamanho e localização anatómica do tumor primário, do estádio da doença, da idade da pessoa afectada, das suas preferências, bem como do seu estado geral e das doenças concomitantes. Por conseguinte, estas decisões terapêuticas devem ser sempre tomadas numa base interdisciplinar no âmbito de uma tábua tumoral.
No caso de tumores localmente avançados e ressecáveis, a terapia adjuvante, que consiste em radioterapia ou radio-quimioterapia combinada (RCT), segue-se à ressecção com a intenção de tratamento curativo. Isto depende dos factores de risco e das comorbilidades das pessoas afectadas. As provas microscópicas de células tumorais no ressecado (R1) e as provas de crescimento extracapsular nos gânglios linfáticos são consideradas factores de risco de “alto risco”. Se estes estiverem presentes, recomenda-se a utilização de um RCT adjuvante combinado. Cisplatin estabeleceu-se como o agente quimioterápico aqui [28,29].
Quando a ressecção cirúrgica é tecnicamente ou comorbidamente inviável ou conduziria a resultados funcionais potencialmente pobres a longo prazo, o RCT definitivo é o padrão curativo estabelecido. Quase 20 000 doentes com tumores da cabeça e do pescoço localmente avançados foram incluídos numa grande meta-análise (Meta-analysis of Chemotherapy in Head and Neck Cancer [MACH-NC]). O RCT combinado demonstrou reduzir a mortalidade de 5 anos em 6,5 pontos percentuais em comparação com a radioterapia apenas (HR 0,83; p<0,001). A indução adicional ou quimioterapia adjuvante não melhorou significativamente a sobrevivência global em comparação apenas com o RCT [30]. A cisplatina em dose elevada (100 mg/m2de área de superfície corporal , administrada por via intravenosa de 21 em 21 dias durante três ciclos) administrada em simultâneo com radioterapia como parte de um RCT definitivo é o atual padrão de tratamento. No entanto, devido às toxicidade significativas a curto e longo prazo associadas à cisplatina, a sua utilização é principalmente reservada aos doentes mais jovens, que não têm comorbilidades graves [30–32]. Isto resultou em várias modificações e variações do regime originalmente utilizado de cisplatina (uma vez de três em três semanas). Nas revisões sistemáticas, os dados foram comparados entre a cisplatina uma vez por semana e a cisplatina de três em três semanas (critério de inclusão: dose cumulativa de cisplatina ≥180 mg/m2). Isto mostrou resultados semelhantes e taxas mais baixas de efeitos secundários graves, especialmente nefro- e ototoxicidade [33]. Também pudemos confirmar este facto na nossa própria análise, embora a dose cumulativa de cisplatina fosse mais baixa nos doentestratados em intervalos semanais [34]. A terapia semanal de cisplatina pode portanto ser utilizada como uma alternativa aceitável, uma vez que a dosagem é mais controlável e a nefro- e ototoxicidade são geralmente menos severas. Além disso, em pacientes que não são elegíveis para cisplatina (por exemplo, pacientes com doença renal crónica, perda auditiva crónica, idade avançada ou estado limite de desempenho ECOG), a carboplatina é frequentemente utilizada em combinação com um taxano, embora não haja comparação directa em ensaios controlados aleatorizados. Cetuximab dado em simultâneo com a radioterapia já foi aprovado como terapia padrão em 2006, após dados mostrarem que este tratamento levou a uma melhoria no controlo loco-regional e na sobrevivência global em comparação com a radioterapia apenas [35]. No entanto, estudos aleatórios recentes sugerem que a radioterapia combinada com cetuximab em doentescom carcinoma orofaríngeo HPV-positivo obtém piores resultados, incluindo uma taxa de sobrevivência mais baixa, em comparação direta com a cisplatina em dose elevada em combinação com radioterapia [36,37]. Assim, o RCT combinado com cisplatina continua a ser a terapia padrão preferida.
Outra abordagem promissora para melhorar o prognóstico é combinar o RCT baseado em cisplatina com xevinapante. O Xevinapante é um antagonista dos inibidores da apoptose. Num ensaio aleatório da fase II, a adição de xevinapante ao RCT melhorou significativamente a taxa de controlo do tumor loco-regional como parâmetro primário no período de 18 meses em 21% em comparação com o placebo em combinação com o RCT (54% vs. 33%; p=0,026) [38]. Além disso, foi observado um benefício significativo em termos de sobrevivência sem progressão após um seguimento de dois anos em comparação com o braço de controlo (HR 0,37; p=0,0069). Após um período de seguimento de três anos, Xevinapant mais RCT mostrou uma redução estatisticamente significativa de 51% do risco de morte em comparação com placebo mais RCT (HR 0,49; p=0,0261). Para confirmar estes resultados, o ensaio aleatório da fase III TrilynX (NCT04459715) está actualmente em curso.
Devido aos dados encorajadores no cancro da cabeça e pescoço recidivado/metastásico, numerosos estudos estão actualmente a investigar a utilização de inibidores do ponto de controlo imunitário em fases iniciais, especialmente em tumores localmente avançados em combinação com a TCR. Por exemplo, o estudo multinacional fase III JAVELIN Head and Neck 100 [39] já investigou a eficácia do avelumab, um inibidor PD-L1, em combinação com o RCT com cisplatina em comparação com o placebo em combinação com o RCT. O ensaio foi interrompido cedo após uma análise provisória porque não mostrou qualquer melhoria no tempo sem progressão [40]. Um ensaio em curso está a investigar o valor da terapia de manutenção com atezolizumab após a conclusão do RCT (IMvoke010; NCT03452137). Outros estudos são testes combinados de RCT com inibidores de pontos de controlo imunitário seguidos de terapia de manutenção. A maior destas provas é KEYNOTE-412 (pembrolizumab vs. placebo; NCT03040999).
Outra abordagem interessante que tem sido investigada em vários tumores e tem levado a resultados promissores é a utilização neoadjuvante de inibidores do ponto de controlo imunitário [41,42]. Considerando a situação de tratamento ingénuo e a falta de células resistentes ao tratamento em comparação com a situação recidivante/metastática, a imunoterapia neoadjuvante pode ser capaz de alcançar um efeito terapêutico mais forte e duradouro. Por exemplo, o tratamento neoadjuvante anti-PD-1 num modelo de rato com tumores na cabeça e pescoço resultou numa conversão da imunodominância funcional e induziu respostas imunitárias robustas dirigidas contra o tumor [43]. Schoenfeld et al. nivolumab (N) neoadjuvante investigado num estudo de fase II e a combinação de nivolumab mais ipilimumab (N+I) numa segunda coorte de 29 pacientes não tratados com carcinoma da cavidade oral [44]. O nivolumabe (3 mg/kg) foi administrado nas semanas 1 e 3, enquanto o ipilimumabe (1 mg/kg) foi administrado apenas na semana 1. Embora um total de 21 pacientes tenham sofrido eventos adversos, incluindo pacientes de grau 3/4 em 2 (N) e 5 (N+I), não se registaram atrasos na cirurgia. Além disso, havia provas de resposta a estas terapias em ambos os coortes. Em particular, quatro pacientes (N, n=1; N+I, n=3) tiveram uma resposta completa ou quase completa (<10% de células tumorais vitais). Estes resultados falam da tolerabilidade clínica e da eficácia da imunoterapia neoadjuvante. O estudo CAIO [45], o estudo IMCISION [46], o estudo CheckMate 358 [47] assim como outros estudos [48–50], todos eles demonstraram a viabilidade e eficácia desta estratégia terapêutica. Consequentemente, foram iniciados estudos maiores nesta base (por exemplo, o estudo aleatório fase III KEYNOTE-689, NCT03765918). Além disso, é importante explorar possíveis preditores de resposta para permitir a selecção de pacientes adequados. Aqui, é importante uma análise detalhada das amostras tumorais, bem como de possíveis alterações no microambiente tumoral e das células imunitárias que infiltram os tumores.
Resumo/Conclusão
A introdução da imunoterapia no tratamento de tumores recorrentes e/ou metastáticos da cabeça e pescoço alterou fundamentalmente a terapia destes quadros clínicos e melhorou significativamente o seu prognóstico. O tratamento análogo ao estudo KEYNOTE-048 (quimioterapia contendo platina + 5-FU + pembrolizumab ou pembolizumab mono de acordo com CPS e carga tumoral/sintoma) estabeleceu-se como a nova terapia paliativa de primeira linha. Devido aos resultados encorajadores nas fases avançadas do tumor, a questão do benefício da imunoterapia também se coloca para as fases iniciais do tumor, em combinação ou sequência à radioterapia e quimioterapia. É muito provável que a sequência das diferentes modalidades de tratamento influencie significativamente os resultados. Tendo especialmente em conta que a resposta antitumoral das células T tem diferentes fases que podem ser alvo de diferentes imunoterapias, e que tanto a rádio como a quimioterapia podem modular o sistema imunitário ao mesmo tempo que têm efeitos citotóxicos contra as células T [51]. Outras novas abordagens de combinação estão a ser exploradas em ensaios clínicos que combinam imunoterapêutica com vacinas contra HPV, vacinas contra tumores específicos de pacientes, terapias orientadas para células T, vírus oncolíticos e outros imunomoduladores.
Conflitos de interesse
ED: Sem conflitos de interesses.
SR: Honorários por serviços de consultoria (pagamento ao Hospital Universitário de Basileia) da Astra-Zeneca, BMS, Boehringer-Ingelheim, Eisai, Eli Lilly, Merck Serono, MSD, Novartis, Pfizer, Roche, Takeda. Financiamento de investigação da AbbVie, Astra-Zeneca, BMS, Boehringer-Ingelheim, Merck. Apoio à participação no congresso por parte da Amgen, AstraZeneca, BMS, Boehringer-Ingelheim, MSD, Roche, Takeda. Membro da Comissão Federal de Drogas do Departamento Federal de Saúde Pública.
Mensagens para levar para casa
- A introdução da imunoterapia com inibidores do ponto de controlo imunitário no tratamento de tumores recidivantes/metastáticos da cabeça e do pescoço melhorou significativamente o prognóstico destes doentes.
- A monoterapia com o anticorpo anti-PD-1 pembrolizumab em doentes com elevada expressão de PD-L1 (CPS ≥20) e a terapia combinada de platina/5-FU e pembrolizumab (independentemente da expressão de PD-L1, mas especialmente no caso de um CPS ≥1) representam o novo padrão terapêutico para tumores recidivantes/metastáticos da cabeça e pescoço com base no estudo KEYNOTE-048.
- Para tumores localmente avançados e inoperáveis, a radioquimioterapia combinada definitiva (RCT) com cisplatina continua a ser a terapia padrão. As alternativas medicamentosas à cisplatina em combinação com radioterapia são a carboplatina combinada com um taxano e cetuximab. O Xevinapante (antagonista dos inibidores da apoptose) como coadjuvante do RCT parece promissor (ensaio aleatório da fase III actualmente em curso).
- A utilização da imunoterapia em fases iniciais do tumor em combinação com o RCT, como terapia de manutenção ou no ambiente neoadjuvante, é objecto de estudos em curso.
Literatura:
- Bray F, et al.: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68: 394–424.
- Siegel RL, et al.: An assessment of progress in cancer control. CA Cancer J Clin 2018; 68: 329–339.
- Mourad M, et al.: Epidemiological Trends of Head and Neck Cancer in the United States: A SEER Population Study. J Oral Maxillofac Surg 2017; 75: 2562–2572.
- Fitzmaurice C, et al.: Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: A Systematic Analysis for the Global Burden of Disease Study Global Burden of Disease Cancer Collaboration. JAMA Oncol. 2017; 3: 524–548.
- Gillison ML, et al.: Epidemiology of Human Papillomavirus–Positive Head and Neck Squamous Cell Carcinoma. J Clin Oncol 2015; 33: 3235–3242.
- Moore EJ, Janus J, Kasperbauer J: Transoral robotic surgery of the oropharynx: Clinical and anatomic considerations. Clin. Anat. 2012; 25: 135–141.
- Weiss BG, et al.: Transoral laser microsurgery for treatment for hypopharyngeal cancer in 211 patients. Head Neck 2017; 39: 1631–1638.
- pta T, et al.: Systematic review and meta-analyses of intensity-modulated radiation therapy versus conventional two-dimensional and/or or three-dimensional radiotherapy in curative-intent management of head and neck squamous cell carcinoma. PLoS One. 2018; 13. DOI:10.1371/journal.pone.0200137.
- Vermorken JB, Specenier P: Optimal treatment for recurrent/metastatic head and neck cancer. Anais de Oncologia. Oxford University Press, 2010. DOI:10.1093/annonc/mdq453.
- Vermorken JB, et al.: Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 2008; 359: 1116–1127.
- Saleh K, et al.: New developments in the management of head and neck cancer – Impact of pembrolizumab. Ther. Clin. Risk Manag. 2018; 14: 295–303.
- Ferris RL, et al.: Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med 2016; 375: 1856–1867.
- Harrington KJ, et al.: Nivolumab versus standard, single-agent therapy of investigator’s choice in recurrent or metastatic squamous cell carcinoma of the head and neck (CheckMate 141): health-related quality-of-life results from a randomised, phase 3 trial. Lancet Oncol 2017; 18: 1104–1115.
- Cohen EEW, et al.: Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label, phase 3 study. Lancet 2019; 393: 156–167.
- Ferris RL, et al.: Nivolumab vs investigator’s choice in recurrent or metastatic squamous cell carcinoma of the head and neck: 2-year long-term survival update of CheckMate 141 with analyses by tumor PD-L1 expression. Oral Oncol 2018; 81: 45–51.
- Zandberg DP, et al.: Durvalumab for recurrent or metastatic head and neck squamous cell carcinoma: Results from a single-arm, phase II study in patients with ≥25% tumour cell PD-L1 expression who have progressed on platinum-based chemotherapy. Eur J Cancer 2019; 107: 142–152.
- Siu LL, et al.: Safety and Efficacy of Durvalumab with or Without Tremelimumab in Patients with PD-L1-Low/Negative Recurrent or Metastatic HNSCC: The Phase 2 CONDOR Randomized Clinical Trial. JAMA Oncol 2019; 5: 195–203.
- Ferris RL, et al.: Durvalumab with or without tremelimumab in patients with recurrent or metastatic head and neck squamous cell carcinoma: EAGLE, a randomized, open-label phase III study. Ann Oncol 2020; 31: 942–950.
- Burtness B, et al.: Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 2019; 394: 1915–1928.
- Burtness B, et al.: Abstract LB-258: Efficacy of first-line (1L) pembrolizumab by PD-L1 combined positive score <1, 1-19, and ≥20 in recurrent and/or metastatic (R/M) head and neck squamous cell carcinoma (HNSCC): KEYNOTE-048 subgroup analysis. Cancer Research. American Association for Cancer Research (AACR), 2020.
- Matlung SE, et al.: Differences in T-cell infiltrates and survival between HPV+ and HPV- oropharyngeal squamous cell carcinoma. Futur. Sci. OA. 2016; 2. DOI:10.4155/fso.15.88.
- Bauml J, et al.: Pembrolizumab for Platinum- and Cetuximab-Refractory Head and Neck Cancer: Results From a Single-Arm, Phase II Study. J Clin Oncol 2017; 35: 1542–9.
- Wang J, et al.: HPV-positive status associated with inflamed immune microenvironment and improved response to anti-PD-1 therapy in head and neck squamous cell carcinoma. Sci Rep 2019; 9. DOI:10.1038/s41598-019-49771-0.
- Xu Y, et al.: Programmed Death-1/Programmed Death-Ligand 1-Axis Blockade in Recurrent or Metastatic Head and Neck Squamous Cell Carcinoma Stratified by Human Papillomavirus Status: A Systematic Review and Meta-Analysis. Front Immunol 2021; 12. DOI:10.3389/fimmu.2021.645170.
- Cohen EEW, et al.: The Society for Immunotherapy of Cancer consensus statement on immunotherapy for the treatment of squamous cell carcinoma of the head and neck (HNSCC). J Immunother Cancer 2019; 7. DOI:10.1186/s40425-019-0662-5.
- Braakhuis BJM, Brakenhoff RH, René Leemans C: Treatment choice for locally advanced head and neck cancers on the basis of risk factors: Biological risk factors. Ann Oncol 2012; 23.
DOI:10.1093/annonc/mds299. - Brana I, Siu LL: Locally advanced head and neck squamous cell cancer: Treatment choice based on risk factors and optimizing drug prescription. Ann Oncol 2012; 23. DOI:10.1093/annonc/mds322.
- Cooper JS, et al.: Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med 2004; 350: 1937–1944.
- Bernier J, et al.: Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer.
N Engl J Med 2004; 350: 1945–1952. - Pignon JP, et al.: Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17,346 patients. Radiother Oncol 2009; 92: 4–14.
- Adelstein D, et al.: NCCN guidelines® insights head and neck cancers, version 2.2017 featured updates to the NCCN guidelines. JNCCN J Natl Compr Cancer Netw 2017; 15: 761–770.
- Adelstein DJ, et al.: An intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer. J Clin Oncol 2003; 21: 92–98.
- Mohamed A, et al.: Concurrent chemoradiotherapy with weekly versus triweekly cisplatin in locally advanced squamous cell carcinoma of the head and neck: Comparative analysis. Head Neck. 2019; 41: 1490–1498.
- Helfenstein S, et al.: 3-weekly or weekly cisplatin concurrently with radiotherapy for patients with squamous cell carcinoma of the head and neck – A multicentre, retrospective analysis. Radiat Oncol 2019; 14. DOI:10.1186/s13014-019-1235-y.
- Bonner JA, et al.: Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival. Lancet Oncol 2010; 11: 21–28.
- Mehanna H, et al.: Radiotherapy plus cisplatin or cetuximab in low-risk human papillomavirus-positive oropharyngeal cancer (De-ESCALaTE HPV): an open-label randomised controlled phase 3 trial. Lancet 2019; 393: 51–60.
- Gillison ML, et al.: Radiotherapy plus cetuximab or cisplatin in human papillomavirus-positive oropharyngeal cancer (NRG Oncology RTOG 1016): a randomised, multicentre, non-inferiority trial. Lancet 2019; 393: 40–50.
- Bourhis J, et al.: TrilynX: A phase 3 trial of xevinapant and concurrent chemoradiation for locally advanced head and neck cancer. J Clin Oncol 2021; 39: TPS6091–TPS6091.
- Yu Y, Lee NY: JAVELIN Head and Neck 100: A Phase III trial of avelumab and chemoradiation for locally advanced head and neck cancer. Futur Oncol 2019; 15: 687–694.
- Cohen EE, et al.: Primary results of the phase III JAVELIN head & neck 100 trial: Avelumab plus chemoradiotherapy (CRT) followed by avelumab maintenance vs CRT in patients with locally advanced squamous cell carcinoma of the head and neck (LA SCCHN). ESMO Congress 2020: Annals of Oncology (2020) 31 (suppl_4): S599–S628.
- Topalian SL, Taube JM, Pardoll DM: Neoadjuvant checkpoint blockade for cancer immunotherapy. Science 2020; 367. DOI:10.1126/science.aax0182.
- Rothschild SI, et al.: SAKK 16/14: Durvalumab in Addition to Neoadjuvant Chemotherapy in Patients With Stage IIIA(N2) Non-Small-Cell Lung Cancer-A Multicenter Single-Arm Phase II Trial. J Clin Oncol 2021; 39: 2872–2880.
- Friedman J, et al.: Neoadjuvant PD-1 immune checkpoint blockade reverses functional immunodominance among tumor antigen–specific T cells. Clin Cancer Res 2020; 26: 679–689.
- Schoenfeld JD, et al.: Neoadjuvant Nivolumab or Nivolumab plus Ipilimumab in Untreated Oral Cavity Squamous Cell Carcinoma: A Phase 2 Open-Label Randomized Clinical Trial. JAMA Oncol 2020; 6: 1563–1570.
- Ferrarotto R, et al.: Impact of neoadjuvant durvalumab with or without tremelimumab on CD8+ tumor lymphocyte density, safety, and efficacy in patients with oropharynx cancer: CIAO trial results. Clin Cancer Res 2020; 26: 3211–3219.
- Vos JL, et al.: Neoadjuvant immunotherapy with nivolumab and ipilimumab induces major pathological responses in patients with head and neck squamous cell carcinoma. Nat Commun 2021; 12. DOI:10.1038/s41467-021-26472-9.
- Ferris RL, et al.: Neoadjuvant nivolumab for patients with resectable HPV-positive and HPV-negative squamous cell carcinomas of the head and neck in the CheckMate 358 trial. J Immunother Cancer 2021; 9. DOI:10.1136/jitc-2021-002568.
- Merlino DJ, et al.: Discordant Responses Between Primary Head and Neck Tumors and Nodal Metastases Treated With Neoadjuvant Nivolumab: Correlation of Radiographic and Pathologic Treatment Effect. Front Oncol 2020; 10. DOI:10.3389/fonc.2020.566315.
- Xiong Y, et al: Efeitos imunológicos da imunoterapia nivolumab em doentes com carcinoma espinocelular da cavidade oral. BMC Cancer 2020; 20. DOI: 10.1186/s12885-020-06726-3.
- Uppaluri R, et al.: Neoadjuvant and Adjuvant Pembrolizumab in Resectable Locally Advanced, Human Papillomavirus–Unrelated Head and Neck Cancer: A Multicenter, Phase II Trial. Clin Cancer Res 2020; 26: 5140–5152.
- Yan Y, et al.: Combining Immune Checkpoint Inhibitors With Conventional Cancer Therapy. Front. Immunol. 2018; 9. DOI:10.3389/fimmu.2018.01739.
DERMATOLOGIE PRAXIS 2023; 33(5): 6–12