A fibrilação atrial é a arritmia cardíaca mais comum no mundo ocidental. O tratamento intervencionista mostra resultados promissores. O isolamento das veias pulmonares (IVP) desempenha um papel fundamental. Além disso, existem inovações tais como o chamado “mapeamento de alta densidade” ou a localização e visualização de rotores.
A FA é a arritmia cardíaca mais comum no mundo ocidental com uma prevalência de 1,5-2%, afectando actualmente cerca de 34 milhões de pessoas em todo o mundo [1]. O Framingham Cohort foi estudado em relação ao risco de FA ao longo da vida e descobriu que 25% dos homens e mulheres >40 anos desenvolverão FA durante a sua vida [2]. Devido ao crescente envelhecimento da sociedade, espera-se que a prevalência da FA duplique nos próximos 50 anos. A FA está associada a um risco acrescido de AVC, insuficiência cardíaca, hospitalizações, mas também a um aumento da mortalidade, e por isso representa um desafio médico, económico e social particularmente importante. Para além da terapia farmacológica, que é frequentemente ineficaz e associada a efeitos secundários indesejáveis, o tratamento intervencionista com cateteres de FA tornou-se a terapia padrão para o controlo do ritmo nas directrizes actuais devido à sua eficácia [3]. Se a terapia intervencionista para a FA leva à redução da mortalidade para além de uma morbilidade melhorada é objecto de ensaios multicêntricos aleatórios em curso (CABANA, EAST) [3].
Ablação por fibrilação atrial
Após punções venosas inguinais e uma ou duas punções transseptares através do septo atrial da direita para o átrio esquerdo, é agora normalmente criada uma reconstrução electroanatómica tridimensional do átrio esquerdo para a ablação por radiofrequência mais utilizada (Fig. 1), o que pode reduzir significativamente o tempo de fluoroscopia. Em muitos centros, esta reconstrução é apoiada por uma tomografia computorizada ou ressonância magnética previamente realizada. Deve ser dada especial atenção à reconstrução das veias pulmonares (PV), do ouvido atrial esquerdo (LAA) e do anel mitral (MA). A angiografia selectiva do PV pode ser útil a este respeito. Os sistemas de cartografia tridimensional podem ser utilizados para gerar mapas de tensão eléctrica e de activação, fornecendo informações valiosas sobre a presença de um substrato patológico no átrio esquerdo e sobre os mecanismos e origem das arritmias atriais. Os cateteres de diagnóstico para derivação de sinais eléctricos e para estimulação são normalmente colocados no seio coronário e no PV. A ablação da FA é realizada sob heparinização terapêutica. As complicações da ablação da FA são raras em geral, as complicações mais comuns incluem complicações da virilha em cerca de 2-4% (hemorragia, fístula arteriovenosa/aneurisma), seguidas de derrames pericárdicos/ tamponamentos pericárdicos (cerca de 1-2%) e ataques/acidentes isquémicos transitórios (<1%). A complicação mais temida é uma fístula iatrogénica entre o esófago e o átrio esquerdo (fístula átrio-oesofágica), que geralmente se manifesta apenas algumas semanas após a ablação, é muito rara em geral (<0,5%), mas é frequentemente letal [3].
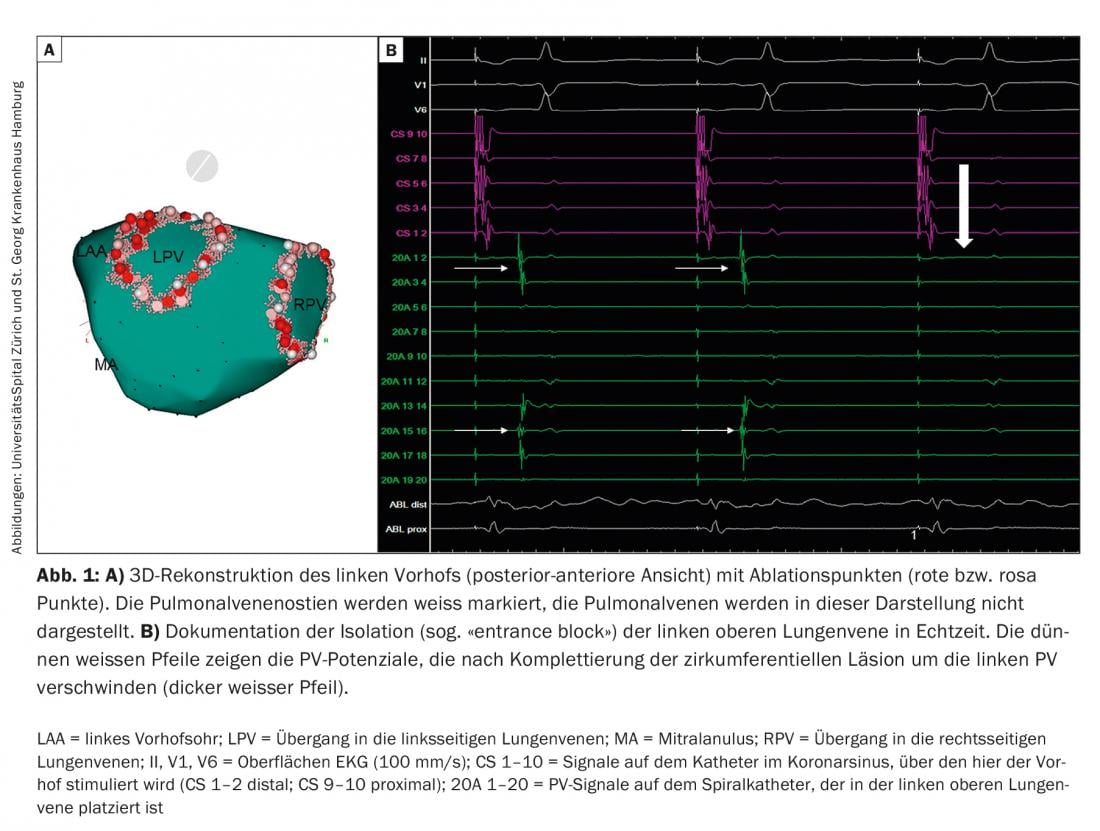
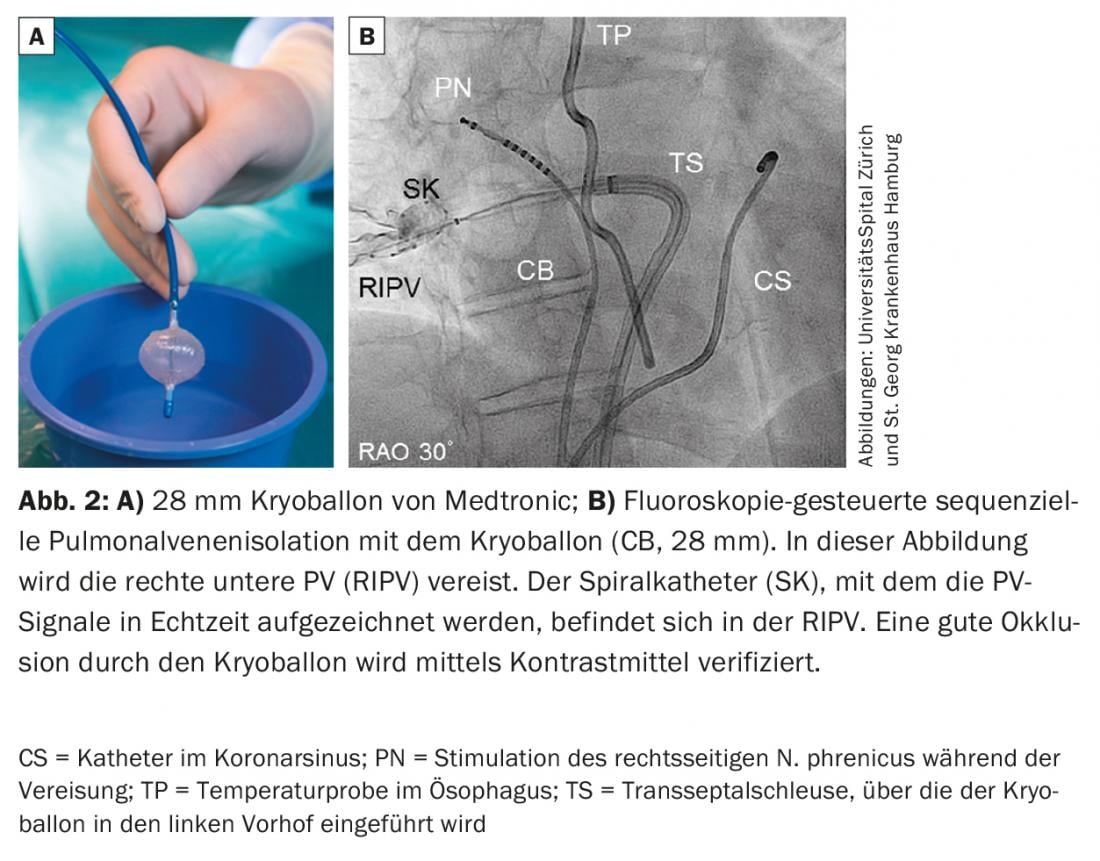
Fibrilação atrial paroxística (PAF): Focos ectópicos são responsáveis por desencadear a FA [4]. Como os FV estão ligados ao átrio esquerdo através de fibras musculares cardíacas, as acções eléctricas podem ser transmitidas para os átrios através destas fibras e desencadear aqui a AF. Esta realização mudou fundamentalmente a nossa compreensão e estratégias de tratamento da FA. Enquanto a terapia cirúrgica cardíaca para a FA no século XX visava eliminar ou reduzir o substrato da FA – ou seja, o tecido atrial que mantém a FA – as estratégias terapêuticas actuais, especialmente para a FAP, visam eliminar os estímulos. Como estes estímulos surgem mais frequentemente no PV, o isolamento das veias pulmonares (IVP) emergiu como a principal estratégia terapêutica invasiva da FA no presente. Actualmente, a PVI circunferencial eléctrica de “área ampla” por meio de corrente de radiofrequência (Fig. 1), alternativamente também o isolamento eléctrico da PVI com o balão frio (cryoballoon); Fig. 2) ou balão laser, é a pedra angular da terapia intervencionista para a FA. Especialmente em pacientes com PAF, a PVI pode conduzir a um ritmo sinusal estável na maioria dos pacientes durante vários anos. Isto aplica-se aos adultos mais jovens <45 anos [5], mas também aos doentes >80 anos. No entanto, para alguns pacientes são necessários vários procedimentos. A nossa experiência demonstrou que a liberdade a longo prazo da FA/ taquicardia atrial (AT) durante um período médio de seguimento de cinco anos após a cirurgia esteve presente em 47% dos pacientes. No entanto, após várias intervenções (mediana 1, intervalo 1-3), este número poderia ser aumentado para 80% [6]. Após um período de seguimento médio de dez anos, a liberdade de AF/AT após múltiplas ablações é de aproximadamente 63%. É importante notar que a principal causa de AF recorrente é a reconexão eléctrica do FV ao átrio esquerdo, mesmo quando apenas um FV renovou a condução eléctrica. Esta reconexão eléctrica do PV é encontrada em até 92% dos pacientes com FA que são afectados a uma IVP repetida. Nestes casos, o re-isolamento do PV pode levar ao controlo clínico da FA em 81% dos doentes. No entanto, em 14% destes pacientes foram identificados gatilhos adicionais de FA não-PV.
Actualmente, há poucos dados que sugiram outros alvos de ablação empírica para além da PV em doentes com PAF. O mesmo se aplica a reprocessamentos para o tratamento de PAF em que os PV foram reisolados. Ocasionalmente, contudo, a eliminação adicional de gatilhos fora da PV, tais como da veia cava superior, parede posterior do átrio esquerdo ou crista terminalis pode levar a um melhor resultado da IVP em PAF.
Fibrilação atrial persistente: Quanto mais tempo a AF persistir, mais pronunciadas serão as mudanças estruturais (“remodelação”) dos átrios. Isto leva a um círculo vicioso: a FA provoca a FA (“fibrilação atrial gera fibrilação atrial”) [7]. Excitação eléctrica caótica e contracções descoordenadas dos átrios resultam em alterações das propriedades eléctricas do miocárdio atrial, redução da contratilidade, dilatação e fibrose atrial. Isto favorece a manutenção da AF. Embora a actividade focal do PV seja de importância decisiva como gatilho no PAF, ela recua para segundo plano na AF persistente. Por conseguinte, as taxas de sucesso publicadas de PVI para FA persistente são geralmente inferiores às de PAF, mas ainda significativamente melhores do que a terapia apenas com medicamentos. Foram desenvolvidas novas estratégias terapêuticas para melhorar os resultados da ablação de cateteres de FA persistente. Estas baseiam-se em múltiplas teorias sobre os mecanismos de formação da AF (persistente). Uma das teorias mais antigas é a chamada hipótese de “onda múltipla”. Isto afirma que a AF é criada e mantida por múltiplas ondas de excitação independentes e caóticas que se movem em ambos os átrios. Uma vez que um número mínimo de ondas simultâneas e uma certa massa crítica de tecido atrial excitável deve estar presente para manter a FA, foram desenvolvidas várias técnicas cirúrgicas (por exemplo, operação de Cox-Maze) nas quais são feitas múltiplas incisões transmurais em ambos os átrios, impedindo assim a reentrada intra-atrial. Esta técnica foi adaptada décadas mais tarde para a ablação endocárdica do cateter de AF persistente.
Outra hipótese para o desenvolvimento de AF persistente baseia-se nos chamados CFAE (complexos electrogramas atriais fraccionados). CFAE representam regiões específicas dos átrios onde existe um atraso na excitação eléctrica (“condução lenta”), que pode levar a microreentrada local. Por conseguinte, estas regiões também se prestam à ablação de cateteres.
A abordagem gradual da ablação visa eliminar os gatilhos na PV e modificar o substrato na LA. Neste procedimento, as FV são primeiro isoladas utilizando energia de radiofrequência, seguindo-se a ablação CFAE. Posteriormente, as lesões lineares são aplicadas ao telhado do LA e ao MA até se atingir o ponto final da cessação da FA ou transição para uma TA e esta última é ablacionada e convertida para um ritmo sinusal. É importante notar que as lacunas nas lesões lineares podem levar a um atraso na condução da excitação nestas áreas e, por conseguinte, à reentrada e às TAs iatrogénicas. Por conseguinte, a prova de um bloco de linha eléctrica ao longo da linha aplicada em ambas as direcções (o chamado bloco bidireccional) é muito importante. Em dois estudos recentemente publicados utilizando esta abordagem, a liberdade de AF/AT após um procedimento e uma média de 2,1 procedimentos foi de 17/20% e 56/63%, respectivamente, após um seguimento de cinco anos. Os preditores significativos da FA/AT recorrente foram a falta de conversão da FA em ritmo sinusal durante a ablação, um diâmetro atrial esquerdo ≥50 mm, FA de longa duração >18 meses e doença cardíaca estrutural [8].
A nossa estratégia para a FA persistente é realizar primeiro uma PVI circunferencial de “área ampla”. A modificação adicional do substrato só é realizada se o paciente não puder ser convertido ao ritmo sinusal (mesmo por electrocardioversión). Após um período de seguimento de cinco anos, a taxa de sucesso com esta estratégia em pacientes com FA de longa duração após a cirurgia inicial foi de 20%, e 45% após uma mediana de dois procedimentos. É importante notar que os pacientes com FA persistente <2 anos em particular mostraram bons resultados a longo prazo.
No maior ensaio multicêntrico aleatório de ablação da FA persistente (STAR AF 2) recentemente publicado, foram comparadas três estratégias de ablação. 589 pacientes seleccionados para a ablação por radiofrequência pela primeira vez devido à AF persistente (<3 anos) foram aleatorizados nos seguintes ramos de tratamento: PVI sozinho (grupo 1) vs. ablação PVI + CFAE (grupo 2) vs. ablação PVI + CFAE + lesões lineares (grupo 3). Após um período de observação de 18 meses, não foi possível mostrar diferenças estatisticamente significativas entre os braços da terapia.
O que dizem as directrizes?
As actuais directrizes europeias de 2016 sobre AF listam a ablação por cateter de AF sintomática em centros experientes como um método clinicamente estabelecido que deve normalmente ser realizado após uma tentativa de tratamento sem sucesso com medicamentos antiarrítmicos (recomendação classe IA para PAF e IIa B para AF persistente). O principal objectivo aqui é o PVI, que pode ser alcançado utilizando a corrente de radiofrequência ou o cryoballoon (IIa B). Em doentes sintomáticos, principalmente aqueles com FA sem doença cardíaca estrutural significativa ou com FA persistente com suspeita de taquicardomiopatia, a ablação do cateter é também recomendada como alternativa à terapia antiarrítmica medicamentosa devido às boas taxas de sucesso e às baixas complicações (IIa B). Nas doenças cardíacas estruturais, nota-se que pode ser necessária uma ablação mais extensa das AL. A ablação do istmo atrial direito deve ser executada como parte da ablação AF se a ablação do istmo atrial dependente do istmo tiver sido documentada antes ou durante o procedimento (IB). Ablação do cateter deve ser seguida pela administração de heparinas e anticoagulantes orais sobrepostos durante pelo menos dois meses (IIa B). Periproceduralmente, os novos anticoagulantes orais (NOAC) também podem ser utilizados. Depois disso, os factores de risco de AVC devem ser a base para uma nova decisão sobre a anticoagulação (IIa C). A anticoagulação contínua deve ser considerada em doentes com um ou dois factores de risco importantes não principais clinicamente relevantes para o AVC (por exemplo. B. CHA2DS2-VASc escore ≥2) (IIa B).
As decisões relativas à cirurgia cardíaca para tratar formas mais complexas de FA após múltiplos tratamentos de intervenção mal sucedidos devem ser tomadas por recomendação de uma Equipa de Coração de FA. Uma equipa cardíaca de FA deve ser constituída pelo menos por um electrofisiologista intervencionista, um cirurgião cardíaco com experiência em ablação cirúrgica de FA, e um anestesista cardíaco [3].
Desenvolvimentos modernos na terapia intervencionista
pressão de contacto (“força de contacto”): A recondução da PV após um isolamento (reconexão) bem sucedido é um dos principais desafios da PVI. Isto deve-se sobretudo a lesões insuficientes durante o procedimento de indexação. Sabe-se que a força de contacto (FC) desde a ponta do cateter até ao tecido a esclerosar é muito importante para se poder definir lesões transmurais. Estudos iniciais investigando estes novos cateteres com a capacidade de medir a FC e uma ponta de cateter arrefecida demonstraram a sua segurança para a ablação AF. Foi também demonstrado que os resultados estavam dependentes do nível de CF. Uma FC média <10 g foi significativamente mais frequentemente associada a arritmias recorrentes, enquanto resultados acima da média foram alcançados com uma FC >20 g (no entanto, o risco de complicações aumentou em >40 g). Durante um segundo procedimento de diagnóstico após a ablação inicial com cateteres CF, lesões teciduais incompletas correlacionadas inversamente com a CF e o produto da CF e a duração da ablação (a chamada force-time integral, FTI). O estudo EFFICAS I levou a um ajustamento das recomendações, que indicam uma FC óptima de 20 g e um mínimo de 400 g (FTI) por lesão de ablação durante a ablação.
Cryoballoon: O criobalão (Fig. 2) foi introduzido em 2006 e provou ser um sistema seguro e eficaz para a PVI. A PVI eléctrica é obtida posicionando o cateter balão no óstio da respectiva PV e arrefecendo-o a -55°C com azoto líquido de modo a que o tecido na junção do átrio esquerdo e a PV congele (normalmente mais de 180-240 s por PV). O cateter balão é inserido na LA através de uma bainha longa orientável. Um cateter de cartografia circular multipolar é inserido através do lúmen do cateter balão para derivar sinais do PV. Com a introdução da segunda geração, os resultados a longo prazo foram significativamente melhorados ao longo da primeira geração para a libertação da AF/AT de >80% a um ano e >70% a dois anos após um procedimento de indexação. Uma complicação característica do criobalão é a paresia do nervo frênico correto. A paralisia nervosa frénica é geralmente reversível no prazo de um ano, mas persiste em 2,5% dos doentes. A taxa de paresia do nervo frênico poderia ser reduzida se o congelamento fosse realizado com menos pressão de contacto, o cateter balão fosse posicionado mais antralmente, e o nervo frênico fosse estimulado durante o congelamento da PV direita para detectar perturbações de motilidade e uma redução da actividade eléctrica do diafragma direito no tempo. Vários estudos (incluindo o maior ensaio multicêntrico prospectivo randomizado de ablação AF, recentemente publicado [9]) demonstraram que o criobalão é equivalente ao PVI em termos de eficácia e segurança em comparação com a tecnologia mais antiga de ablação por radiofrequência.
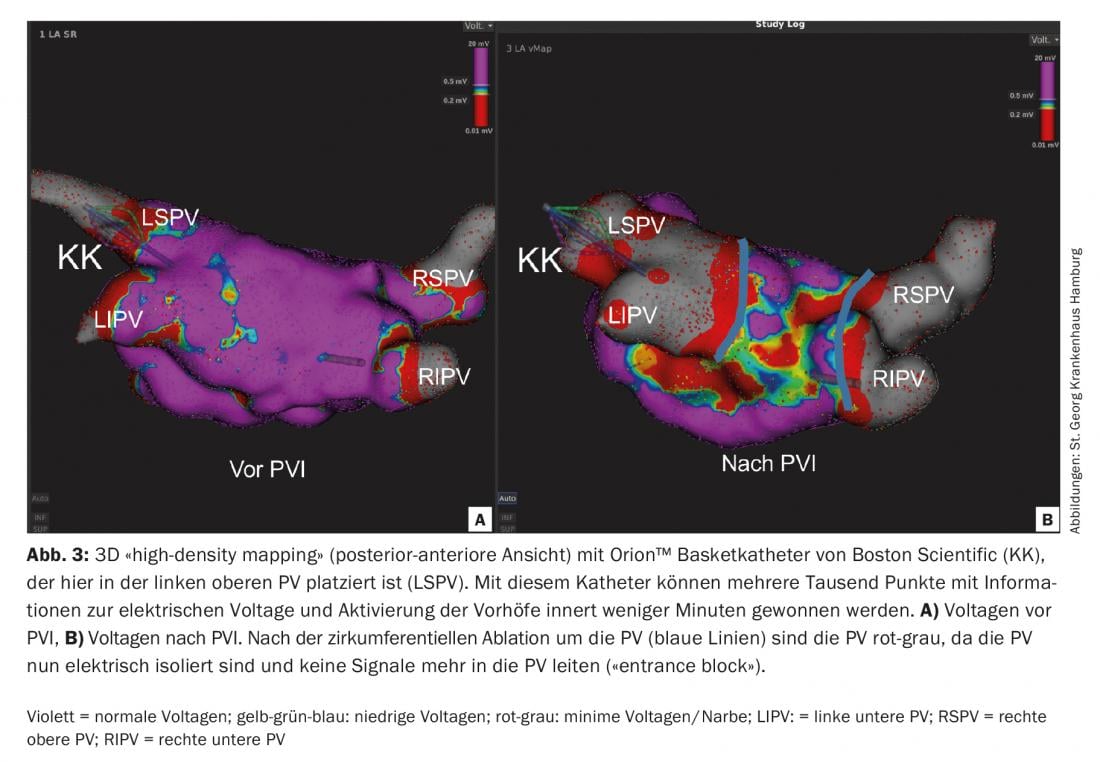
“Cartografia de alta densidade: Com o chamado “mapeamento de alta densidade”, tornou-se recentemente possível medir a condição do paciente em poucos minutos utilizando cateteres de diagnóstico multipolares (por exemplo, Orion™ da Boston Scientific, ou Pentaray® por Biosense Webster) para criar um mapa electroanatómico 3D dos átrios com vários milhares de pontos sem raios X. (Fig.3). Estes mapas 3D fornecem informações muito precisas sobre potenciais de tensão, bem como activação eléctrica do miocárdio, que podem ser muito úteis, especialmente para a ablação de taquicardia atrial reentrante. [10].
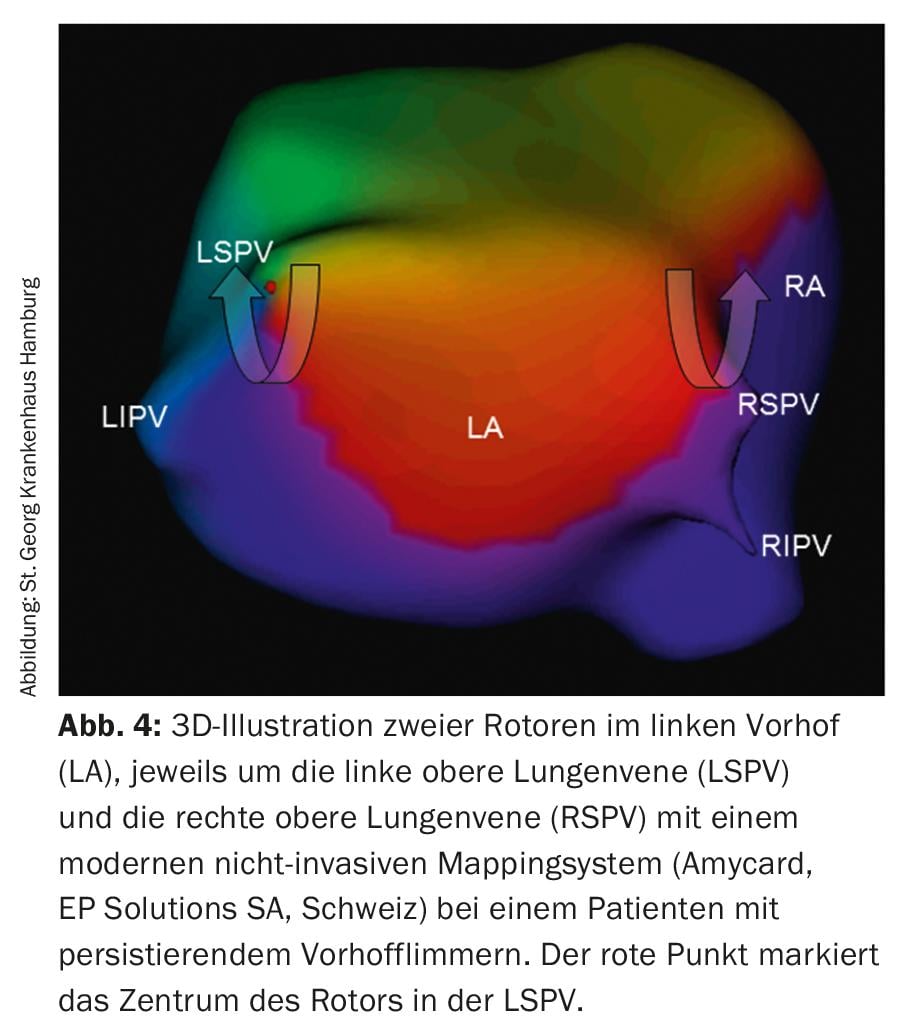
Ablação de rotores: Um conceito mais recente sobre as causas da AF persistente são os chamados rotores (Fig. 4) nos átrios, que iniciam e mantêm a AF – como um furacão – e podem por isso ser também o alvo da ablação de cateteres. Actualmente, existem vários sistemas que são concebidos para permitir a localização e visualização de rotores. No entanto, os resultados a longo prazo desta nova tecnologia têm de ser aguardados.
Controlo do factor de risco: Uma abordagem completamente diferente para melhorar o prognóstico a longo prazo após a ablação da FA foi tomada pelo factor de risco agressivo STudy de redução de STudy para Fibrilação Atrial (ARREST-AF). Aqui, 149 pacientes com FA e um índice de massa corporal de pelo menos 27 kg/m2 e pelo menos um factor de risco cardíaco adicional foram ablacionados. 61 optaram por participar na gestão rigorosa dos factores de risco sob a supervisão de médicos de uma clínica especializada, as restantes 88 disciplinas apenas foram ensinadas sobre a gestão rigorosa dos factores de risco. Durante o período de seguimento de 3,5 anos, estas medidas conduziram a uma melhoria significativa do perfil de risco no grupo com gestão do factor de risco em comparação com o grupo de controlo, por um lado, e, por outro, o sucesso da ablação durou mais tempo: 33 vs. 10% de liberdade de arritmia após uma ablação, 87 vs. 18% após múltiplas ablações [11].
Mensagens Take-Home
- A fibrilação atrial (FA) é a arritmia cardíaca mais comum no mundo ocidental, com uma prevalência de 1,5-2%, e é portanto uma
- importante desafio clínico e socioeconómico.
- O tratamento intervencionista da FA está a mostrar resultados promissores, com o isolamento das veias pulmonares (IVP) a desempenhar um papel fundamental.
- Um desafio do tratamento da FA com cateter é a criação de lesões transmurais permanentes. Novos procedimentos tais como o balão frio (crioablação) ou cateteres sensores de contacto devem melhorar esta situação.
- Especialmente em AF paroxística (PAF) e curta persistente (<3 meses), as hipóteses de sucesso da PVI são boas, mas também a AF persistente mais longa pode ser tratada com sucesso com a ablação do cateter.
- Se a terapia intervencionista leva a uma menor mortalidade, para além de uma morbilidade melhorada, é objecto de estudos em curso.
Conflitos de interesse: Ardan Saguner: Palestra honorária da Boston Scientific; Bolsas educacionais da Biosense Webster, Biotronik, Boston Scientific, e St. Jude Medical.
Literatura:
- Chugh SS, et al: Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulação 2014; 129(8): 837-847.
- Lloyd-Jones DM, et al: Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulação 2004; 110(9): 1042-1046.
- Kirchhof P, et al: 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37(38): 2893-2962.
- Haissaguerre M, et al: Iniciação espontânea da fibrilação atrial por batimentos ectópicos originários das veias pulmonares. N Engl J Med 1998; 339(10): 659-666.
- Saguner AM, et al: Ablação por cateter da fibrilação atrial em adultos muito jovens: um estudo de seguimento de 5 anos. Europace 2016; euw378.
- Ouyang F, et al: Resultados a longo prazo da ablação por cateter na fibrilação atrial paroxística: lições de um seguimento de 5 anos. Circulação 2010; 122(23): 2368-2377.
- Wijffels MC, et al: A fibrilação atrial gera a fibrilação atrial. Um estudo em cabras acordadas cronicamente instrumentadas. Circulação 1995; 92(7): 1954-1968.
- Scherr D, et al.: Resultado de cinco anos de ablação por cateter de fibrilação atrial persistente utilizando a terminação da fibrilação atrial como ponto final do procedimento. Circ Arrhythm Electrophysiol 2015; 8(1): 18-24.
- Kuck KH, et al: Cryoballoon or Radiofrequency Ablation for Paroxysmal Atrial Fibrillation (Ablação por Criobalão ou Radiofrequência para Fibrilação Atrial Paroxística). N Engl J Med 2016; 374(23): 2235-2245.
- Saguner AM, et al.: Primeira experiência clínica utilizando um novo sistema de mapeamento electroanatómico de alta resolução para procedimentos de ablação atrial esquerda. Clin Res Cardiol 2016; 105(12): 992-1002.
- Pathak RK, et al: Estudo de Redução do Factor de Risco Agressivo para Fibrilação Atrial e Implicações para o Resultado da Ablação. Journal of the American College of Cardiology 2014; 64(21): 2222-2231.
CARDIOVASC 2017; 16(4): 24-29