Os sarcomas são tumores malignos raros do tecido conjuntivo. A terapia é multidisciplinar e deve ser realizada em centros de sarcoma. Na Suíça, todas as disciplinas do sarcoma se organizaram a nível nacional (www.sarcoma.ch). Aqui, são publicadas directrizes terapêuticas, um registo, um estudo de coorte e um banco de tecidos. A remoção cirúrgica completa de tumores é a medida terapêutica mais importante, tanto para tumores ósseos como para tumores de tecidos moles. Em geral, a cirurgia é realizada com preservação de membros na medida do possível; no caso de tumores ósseos, a reconstrução é realizada preferencialmente com uma endoprótese (tumor modular) ou em combinação com um aloenxerto. A radioterapia é frequentemente utilizada para tumores de tecidos moles, especialmente quando o tumor é adjacente a estruturas neurovasculares para melhorar o controlo local. A quimioterapia sistémica aditiva, baseada principalmente em doxorubicina, é utilizada principalmente para osteosarcoma, sarcoma de Ewing, rabdomiossarcoma e metástases para melhorar o prognóstico.
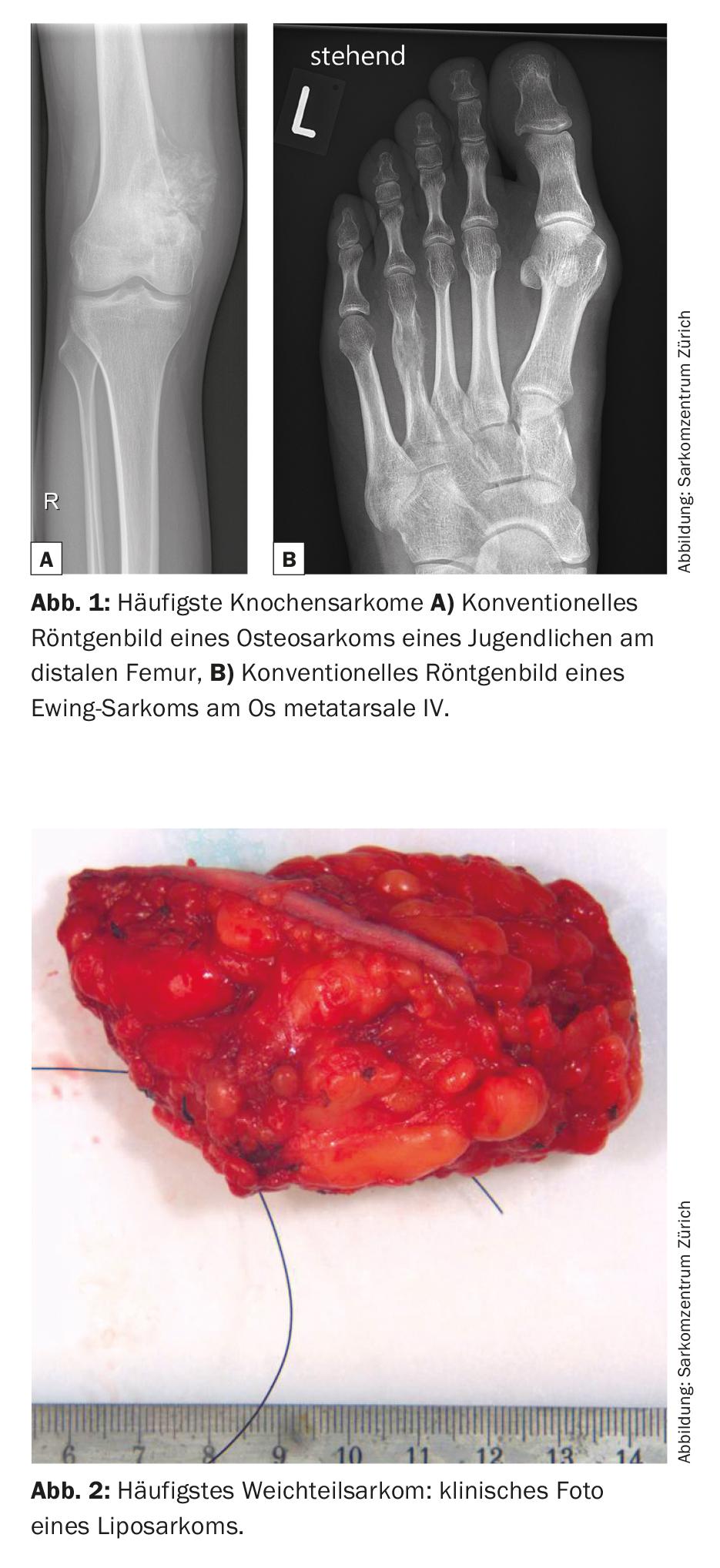
Os sarcomas são tumores malignos de tecido conjuntivo raros que representam 6% de todos os cancros infantis [1]. Existem numerosos subtipos, mais de 50 no total, que podem geralmente ser divididos em sarcomas de osso e tecido mole. O osteossarcoma metafisário e o sarcoma de Ewing diafisário são os sarcomas ósseos mais comuns, enquanto que o lipossarcoma é um dos sarcomas de tecido mole mais comuns (Fig. 1 e 2) .
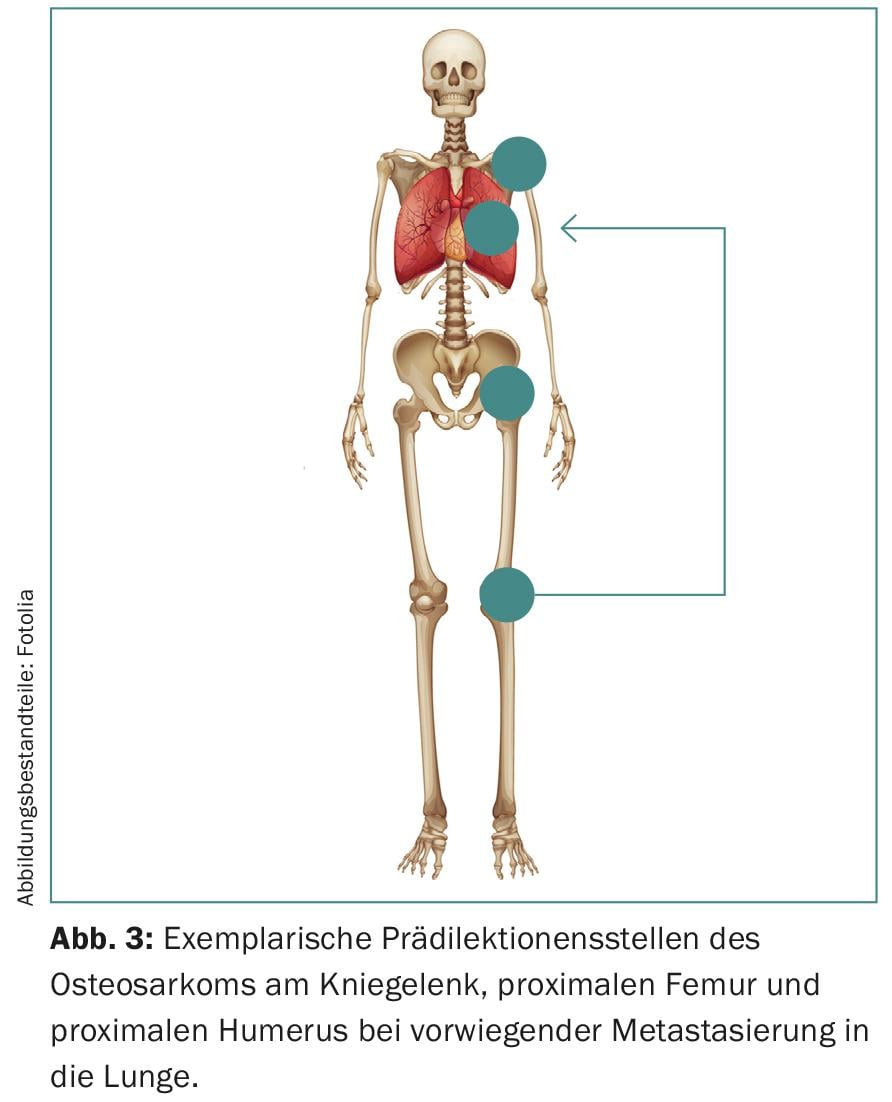
Além disso, os sarcomas mostram predilecções para certos grupos etários e estruturas anatómicas (Fig. 3) . Manifestam-se com uma distribuição etária bimodal, especialmente nas extremidades e no esqueleto axial. A região do joelho dos adolescentes é particularmente afectada, embora a cabeça, pescoço e abdómen também possam ser afectados.
Diagnósticos
Na maioria dos casos, o diagnóstico é feito com base num achado acidental, embora ocasionalmente possa haver inchaço e dor. Estes últimos têm classicamente um carácter local e progressivo que ocorre predominantemente à noite e não podem ser influenciados pelos AINE (anti-inflamatórios não esteróides) [2]. No exame clínico, o tecido tumoral com pele sobreposta e gânglios linfáticos adjacentes deve ser primeiro inspeccionado e palpado localmente. Posteriormente, a procura de metástases pode ser alargada à tiróide, abdómen, próstata ou mama. A sintomatologia sistémica B é muito rara.
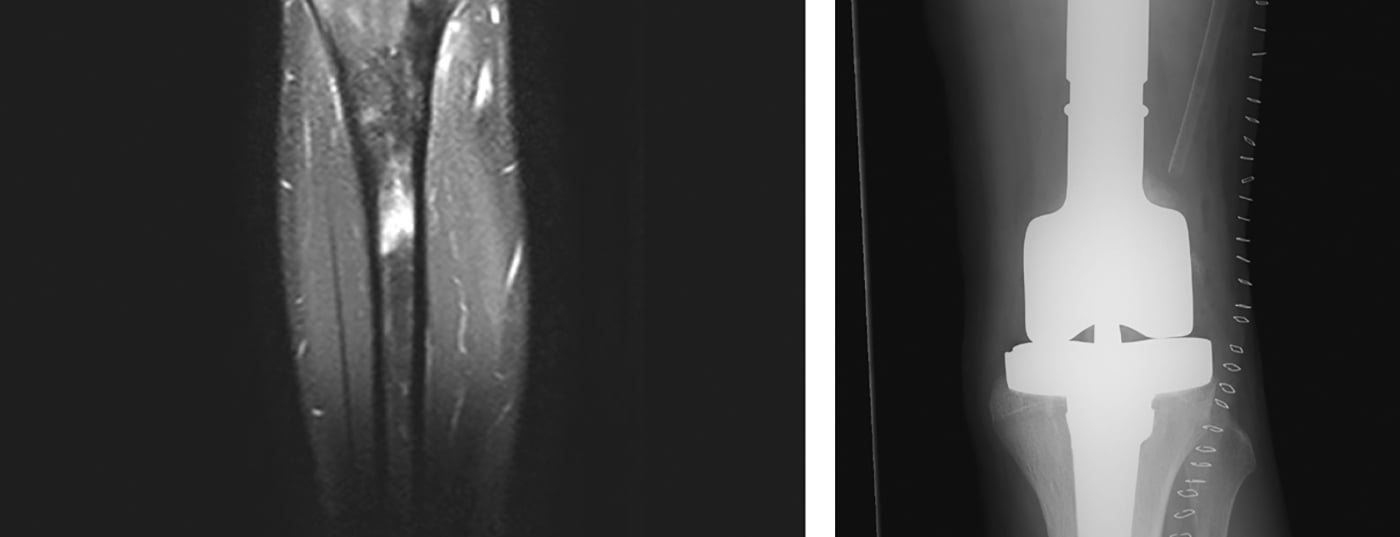
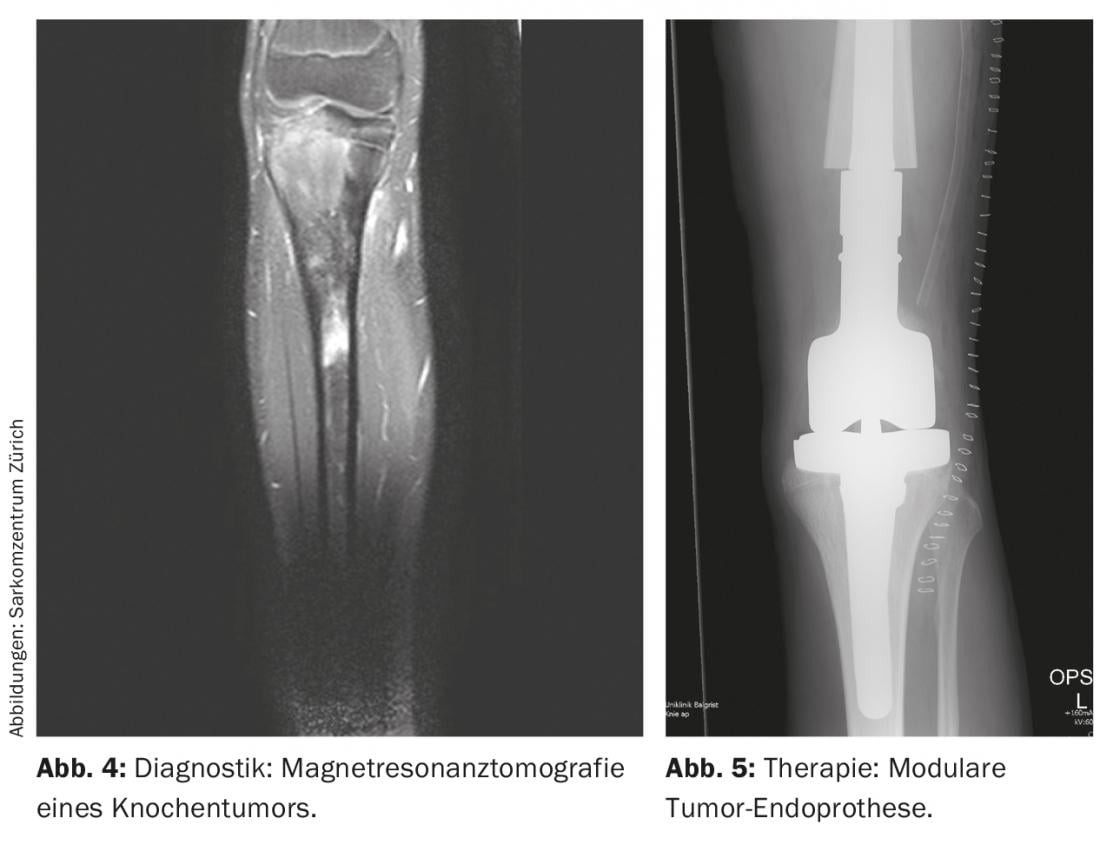
A imagem radiológica é utilizada para localizar o tumor, o que inclui radiografias locais e torácicas em dois planos e, se necessário, TC (tomografia computorizada), RM local (ressonância magnética) (Fig. 4 ) e Tc (tecnécio) esquelética sistémica ou, em alternativa, PET-CT. Em geral, é de notar que as radiografias convencionais de ossos longos devem mostrar sempre ambas as articulações adjacentes. Além disso, os pulmões também são examinados porque são os mais frequentemente afectados por metástases, em cerca de 10% dos casos. No diagnóstico, os osteosarcomas e os sarcomas de Ewing têm classicamente um esporão periosteal conhecido como um triângulo Codman, e calcificações periosteais de pele de cebola. Basicamente, o tamanho (≤ ou >10 cm), localização (epi- ou subfascial) e estado metastásico do tumor devem ser registados. Além disso, testes químicos de laboratório de rotina e a determinação da desidrogenase láctica, bem como da fosfatase alcalina são úteis para excluir doenças generalizadas e para estimar a carga da doença, mesmo que sejam relativamente inespecíficos.
Finalmente, uma biopsia guiada por TC ou US pode fornecer informações sobre o subtipo específico do sarcoma através de exames microscópicos, imunológicos e genéticos moleculares. Tem-se o cuidado de seleccionar o tracto da biópsia para que possa ser removido em toto em qualquer cirurgia subsequente. Se uma biópsia ponche der resultados equivalentes, é realizada uma biópsia aberta. Isto implica evitar hematomas devido ao risco de disseminação, utilizando um fecho da fáscia muscular ou uma inserção de redon. Intra-intervencionalmente, uma nova prova é sempre preparada no gelo. Além disso, deve ser efectuado um exame bacteriológico para garantir a segurança. Portanto, a administração de antibióticos pré-intervencionais não é aconselhável para não complicar os resultados do exame e o tratamento orientado para a resistência.
O bloco de tecido incluído em parafina é utilizado para classificação histológica, para a qual existem várias possibilidades. Dependendo da classificação, seguem-se então exames biológicos moleculares específicos. A encenação em seis etapas (IA-IIIB) de acordo com Enneking (Musculoskeletal Tumour Society) tem em conta metástases (não vs. sim), grau histológico (baixo vs. alto) e tamanho do tumor anatómico (intra vs. extra-compartimental). Na fase de sete etapas (IA-IVB) um pouco mais detalhada da AJCC (American Joint Commission on Cancer), o envolvimento dos gânglios linfáticos é indicado adicionalmente.
Terapia
As terapias elaboradas em centros de sarcoma altamente especializados conduzem a resultados relativamente bons no tratamento a longo prazo de sarcomas localizados com taxas de sobrevivência de 5 anos até 75% [3]. Em contraste, as taxas de sobrevivência dos sarcomas metastáticos são apenas de cerca de 25%. Uma vez que estes resultados têm vindo a atingir o patamar há mais de uma década, os sarcomas continuam a ser objecto de diversos projectos internacionais de investigação para obter uma melhor compreensão genética molecular e assim definir novas opções terapêuticas.
A terapia requer uma equipa interdisciplinar de cirurgiões de tumores ortopédicos, rádio, oncologistas, radiologistas e patologistas. Com base nas suas entidades demográficas, cada paciente e também cada subtipo de sarcoma, semelhante às neoplasias hematopoiéticas, deve receber uma terapia única, multidisciplinar, muitas vezes multimodal, adaptada às mudanças biológicas. Globalmente, o objectivo terapêutico curativo para tumores localizados é a excisão cirúrgica completa do tumor. Nos sarcomas ósseos em particular, a quimioterapia e a radioterapia são utilizadas para reduzir as (micro)metástases e as recidivas locais. Os sarcomas de tecido mole são muitas vezes tratados com terapia combinada, com radioterapia antes ou depois da cirurgia. Uma abordagem paliativa deve ser considerada logo que as metástases estejam presentes no diagnóstico, o que afecta cerca de 10% dos doentes. Directrizes para avaliação, diagnóstico, opções de tratamento e acompanhamento foram estabelecidas pelo Conselho Consultivo Nacional Sarcoma Suíço e publicadas no website www.sarcoma.ch.
Operação
Desde a sua introdução há mais de 30 anos, a remoção completa do tumor cirúrgico surgiu como a opção de tratamento mais importante (Fig. 2), e tem a melhor “resposta terapêutica” de todas as modalidades de tratamento. Em particular, pode ser utilizado como terapia singular para pequenos (<5 cm), completamente removidos e tumores de baixo grau dos tecidos moles [4]. A natureza da margem de ressecção é fundamental para a taxa de recorrência, que é de 100% para uma margem intralesional, <50% para uma margem marginal e <10% para uma margem ampla (>1 cm). Se a remoção completa do tecido tumoral não for alcançada na cirurgia primária, a cirurgia secundária em termos de pós-ressecção deve ser considerada em vez de substituir outras opções terapêuticas. Além disso, a metástaseectomia curativa continua a ser controversa.
A escolha do método cirúrgico mais adequado baseia-se principalmente na classificação e localização do tumor. Em regra, as técnicas cirúrgicas de preservação de membros são preferidas sempre que possível. Estes incluem a ressecção inicial em bloco de tumores e a reconstrução subsequente. O objectivo é conseguir uma ressecção tumoral equivalente à amputação clássica, preservando ao mesmo tempo a função da forma mais fisiológica possível. Em relação às localizações de tumores axiais, a navegação guiada por TAC pode ser útil para poupar estruturas neurovasculares importantes, especialmente em operações pélvicas difíceis. No entanto, o prognóstico dos tumores axiais é pior do que o das extremidades devido à difícil resectabilidade [5].
Normalmente, são utilizadas endopróteses alogâmicas e/ou modulares (tumores) (Fig. 5) [6]. Os aloenxertos tornaram-se mais disponíveis através de bancos de ossos nos últimos anos, fornecem um manto adequado de tecido mole e levam à osteointegração no corpo após vários anos. No entanto, existe não só um risco acrescido de fractura, mas também o risco de pseudoartrose devido à ossificação da zona de enxerto-hospedeiro, que dura até um ano. As Endopróteses são utilizadas principalmente para tumores metafisários com ressecção articular e/ou epifisária necessária para preservar a amplitude de movimento e compensar as diferenças de comprimento das pernas. Oferecem a vantagem de suportarem um peso completo relativamente rápido no pós-operatório com uma boa amplitude de movimento. Contudo, existem as desvantagens habituais das próteses, que podem soltar-se em cerca de 5-10% dos pacientes. A este respeito, apresentam taxas de sobrevivência de 5 e 10 anos de cerca de 80% e 70%, respectivamente. Um composto protético alograft oferece a vantagem de uma melhor ancoragem do tecido mole com menor risco de afrouxamento em comparação com o implante de próteses sozinho e é de outra forma capaz de combinar as outras vantagens e desvantagens de ambos os métodos.
A amputação é executada em menos de 10% dos casos e é actualmente utilizada como último recurso, uma vez que não conduz a melhores taxas de sobrevivência do que a cirurgia de preservação de membros executada de forma adequada [7]. É uma opção terapêutica válida especialmente para as recidivas não reconstruíveis que afectam as estruturas neurovasculares e assim limitam a função. A este respeito, a colocação de próteses hoje em dia oferece boas e diversas possibilidades, especialmente para cotos de amputação que são o mais distal possível. Além disso, uma argamassa de inversão Van Ness é uma amputação intercalar de abdução de membro, na qual a perna inferior, incluindo o pé, é fixada ao membro proximal. Isto permite à articulação superior do tornozelo assumir a função da articulação do joelho e controlar melhor uma prótese.
Quimioterapia
A quimioterapia sistémica pode ser administrada concomitantemente com a cirurgia, quer no pré-operatório quer no pós-operatório, ou em ambos, dependendo do tipo de tumor. Esta consiste geralmente numa combinação à base de doxorubicina [8], em que a doxorubicina interfere com a síntese de ADN como um intercalante e conduz à apoptose através da formação de radicais livres. No caso do osteosarcoma, este consiste geralmente em vários ciclos de doxorubicina, metotrexato e cisplatina. Para além dos osteosarcomas, os sarcomas de Ewing, rabdomiossarcomas e metástases são frequentemente tratados com quimioterapia. No entanto, o seu efeito terapêutico e, portanto, prognóstico é controverso, especialmente nos sarcomas de tecidos moles. Devido aos efeitos secundários não negligenciáveis, tais como nefro- ou cardiotoxicidade, deve ser realizada uma análise de risco-benefício em cada caso individual. Além disso, a aplicação é melhor feita no contexto de ensaios clínicos.
Pode ser administrado de forma pré-operatória, neoadjuvante, ou pós-operacional, adjuvante, durante cerca de sete meses. A vantagem da utilização neoadjuvante é a redução da massa tumoral, o tratamento de micrometástases radiologicamente invisíveis, e a relevância prognóstica. As micro-metástases encontram-se em até 80% dos casos, especialmente nos osteosarcomas. O prognóstico depende crucialmente da resposta à quimioterapia e reflecte-se na taxa de necrose histológica ( <% = bom vs. ≥90 90% = mau) de acordo com Salzer-Kuntschik.
Radioterapia
A radioterapia é outra opção de tratamento, especialmente para os sarcomas de tecidos moles. Pode reduzir a taxa de recidiva, que é inferior a 10%. Se isto também influencia a formação de metástases e o prognóstico permanece pouco claro. É utilizado principalmente para sarcomas grandes, profundos, de alta qualidade, incompletamente excisados, neurovasculares, de tecido mole e metastásicos [9]. Geralmente, leva a rupturas tóxicas de dupla cadeia do ADN celular (ácido desoxirribonucleico) por radicais livres e, portanto, a apoptose. O uso pré-operatório é frequentemente preferido. Por um lado, isto permite uma dose terapêutica mais baixa de cerca de 50 Gy (Gray) devido ao contorno mais detalhado e ao menor volume, e por outro lado, um melhor resultado funcional a longo prazo pode ser alcançado. No entanto, existe também um risco acrescido de perturbações reversíveis de cicatrização de feridas pós-operatórias. O uso adjuvante, por outro lado, leva mais frequentemente a complicações tardias irreversíveis, tais como linfedema, fibrose, rigidez articular, fracturas de stress e sarcomas pós-radiação, pelo que é melhor evitá-los.
Outras opções de tratamento
Para além das terapias padrão já mencionadas, existem outras opções de tratamento cuja eficácia ou superioridade ainda não foi suficientemente comprovada em ensaios controlados aleatorizados. Estes incluem hipertermia local regional, perfusão de membros hipertérmicos isolados, infusão de membros isolados e braquiterapia local à base de cateteres, e anticorpos sistemicamente monoclonais, bisfosfonatos, terapia com células estaminais e nanotecnologia (fotodinâmica) [10].
Verificações de acompanhamento
Para além do acompanhamento clínico inicial, que difere consoante o procedimento, o primeiro acompanhamento clínico-radiológico, incluindo um exame radiológico, tem lugar três meses após a operação. exame local convencional de raio-X e ressonância magnética da área tumoral, bem como um TAC ao tórax para excluir metástases (ver também www.sarcoma.ch). Uma vez que a maioria das recorrências ou metástases tardias ocorrem nos primeiros dois a três anos, as visitas de acompanhamento são realizadas de três em três meses, nesta altura, antes de se realizarem consultas semestrais até ao acompanhamento de cinco anos. Posteriormente, o esquema é adaptado a controlos de um a dois anos.
Conflito de interesses: Os autores declaram que não há conflito de interesses.
Literatura:
- HaDuong JH, et al: Sarcomas. Pediatr Clin North Am 2015; 62: 179-200
- Miller MD, et al. Revisão de Ortopedia.6ª ed. Filadélfia, PA: Elsevier Saunders 2012; 623-674.
- Kager L, et al: Osteosarcoma metastático primário: apresentação e resultado dos pacientes tratados nos protocolos do Grupo de Estudo do Osteosarcoma da Cooperativa neoadjuvante. J Clin Oncol 2003; 21: 2011-2018.
- Ferrone ML, Raut CP: A moderna terapia cirúrgica: salvamento de membros e o papel da amputação para sarcomas de tecidos moles de extremidades. Surg Oncol Clin N Am 2012; 21: 201-213.
- Jentzsch T, et al.: Expressão de MSH2 e MSH6 num Microarranjo Tecidual em Pacientes com Osteosarcoma. Anticancer Res 2014; 34: 6961-6972.
- Moore DD, Luu HH: Osteosarcoma. Tratamento do cancro Res 2014; 162: 65-92.
- Grimer RJ, et al: Resultados cirúrgicos no osteossarcoma. J Bone Joint Surg Br 2002; 84: 395-400.
- Whelan JS, et al: EURAMOS-1, um estudo internacional randomizado para o osteosarcoma: resultados do tratamento pré-randomização. Ann Oncol 2015 Fev; 26(2): 407-414.
- Yang JC, et al: Estudo prospectivo aleatório do benefício da radioterapia adjuvante no tratamento de sarcomas de tecidos moles da extremidade. J Clin Oncol 1998; 16: 197-203.
- Wunder JS, et al: Oportunidades de melhorar a relação terapêutica para pacientes com sarcoma. Lancet Oncol 2007; 8: 513-524
InFo ONCOLOGy & HEMATOLOGy 2015; 3(5): 18-21