- O tratamento a longo prazo com UPA até 5,5 anos não revela novos sinais de segurança (1).
- A UPA tem um perfil de segurança consistente no tratamento da artrite reumatóide (AR), da artrite psoriática (APS) e da espondiloartrite axial (EA), embora a frequência dos efeitos secundários varie devido às diferenças na população de doentes e às comorbilidades relacionadas com a doença (1).
- O UPA tem um perfil de segurança comparável ao do adalimumab na AR* e na APS (1).
* Com excepção dos já conhecidos eventos mais elevados de herpes zoster e NMSC e níveis mais elevados de CPK.
UPA nas doenças reumáticas
A AR, a APS e a EA são muito stressantes para as pessoas afectadas: a inflamação subjacente pode causar lesões permanentes nas articulações e reduzir significativamente a qualidade de vida das pessoas afectadas [2, 3]. O upadacitnib (UPA, RINVOQ®) é um inibidor oral e reversível da Janus quinase (JAK) que actua especificamente na JAK1 e, em menor grau, também na JAK2, JAK3 ou TYK2. A UPA é utilizada na dose de 15 mg uma vez por dia para a AR, EA e APS e está também aprovada para o tratamento de adultos com dermatite atópica (DA) moderada a grave [4].
A UPA demonstrou uma forte eficácia em todos os 9 ensaios em AR, PsA, AS e AD. No entanto, a utilização segura é igualmente crucial para o tratamento [4]. Os dados do ensaio de vigilância ORAL, que comparou o inibidor da JAK tofacitinib com um inibidor do factor de necrose tumoral (TNF) em doentes idosos com AR e factores de risco cardiovascular, realçam a necessidade de caracterizar melhor o perfil de segurança dos inibidores da JAK na terapêutica das doenças reumáticas, particularmente no contexto de comparadores activos. Uma nova publicação de Burmester et al. mostra agora o perfil de segurança a longo prazo da UPA durante um período de até 5,5 anos em doenças reumáticas, em que não surgiram novos sinais de segurança [1].
Tratamento a longo prazo com UPA
Globalmente, a segurança da UPA foi estudada em 6000 doentes com AR, APS, EA e DA ao longo de 15 000 doentes-ano. Na AR, AS e PsA, foi incluído um total de 9 ensaios de fase IIb/III, ou seja, estão disponíveis dados sobre 4298 doentes tratados que receberam pelo menos uma dose de UPA (3209 doentes com AR, 907 com PsA e 182 com AS). Isto corresponde a um total de 11272 doentes-ano (9079,1 para a AR, 1872 para a APS e 320 para a EA, respectivamente) [1]. A duração máxima do tratamento foi de até 5,5 anos para a AR, 3,9 anos para a APS e 3,3 anos para a EA. Cerca de 80% dos doentes de todos os grupos tinham pelo menos um factor de risco para doenças cardiovasculares no início do estudo (Quadro 1). Os doentes mais velhos (> 65 anos) estavam mais frequentemente representados na população com AR (20%) do que na população com EA (6%) [1]. Os doentes que receberam pelo menos uma dose de ADA ou MTX foram utilizados para comparação. A maioria dos doentes com AR e PSA a tomar UPA recebeu terapêutica concomitante com csDMARD – nos doentes com EA, a terapêutica adicional com csDMARD foi rara [1].
Tabela 1: Dados demográficos de base e características da doença de UPA, ADA e MTX em doentes com AR e UPA e ADA em doentes com APs e UPA em doentes com EA, respectivamente.

* A actividade da doença é medida da seguinte forma: AR, DAS (Disease Activity Score)-28 (CRP); PsA, DAPSA (Disease Activity Index for Psoriatic Arthritis); AS, ASDAS (Ankylosing Spondylitis Disease Activity Score).
†Osfactores de riscoCVincluem história de eventos cardiovasculares, hipertensão arterial, diabetes mellitus, consumo de tabaco/nicotina, LDL-C elevado e HDL-C diminuído. Adaptado de [1]
Não há novos sinais de segurança durante a UPA
O perfil de segurança global da UPA foi comparável na AR, APS e EA. Foram observadas infecções graves em doentes com AR e APS em tratamento com UPA (Fig. 1), raramente levando à interrupção do tratamento e com uma incidência semelhante em doentes com AR em tratamento com UPA e em doentes em tratamento com ADA. Em contrapartida, não foram notificadas infecções graves em doentes com EA sob terapêutica com UPA. O aumento das taxas de infecções graves em doentes com PsA sob UPA parece estar relacionado com a COVID-19 [1].
Os tumores malignos (excluindo o cancro da pele não melanoma, CCNM) foram notificados em todas as fases da doença a uma taxa máxima de um evento por 100 doentes-ano (≤1,0 E/100 PY) (Fig. 1), o que foi consistente em todas as doenças e também entre o UPA e os medicamentos comparadores activos. Não se registou qualquer alteração significativa desta taxa durante todo o período de ingestão de UPA. As taxas de NMSC sob terapia UPA (≤ 0,8 E/100 PY) foram geralmente as mesmas para todas as doenças, excepto AS – não foram observadas malignidades nesta população de doentes [1].
Foram notificados eventos cardiovasculares adversos graves (MACE) em todos os grupos de tratamento com taxas <0,5 por 100 pacientes-ano (PY) (Fig. 1). Com excepção do tratamento com UPA em doentes com EA, em que não foram observados eventos cardiovasculares. Globalmente, a taxa de MACE foi comparável em doentes com AR e APS sob terapêutica com UPA, ADA e MTX. Não houve correlação entre a duração do uso de UPA e a ocorrência de MACE. A maioria dos doentes que sofreram um MACE tinham pelo menos um factor de risco cardiovascular [1].
O tromboembolismo venoso (TEV) foi observado em pacientes em uso de UPA em todos os estágios da doença, com taxas de <0,4 E/100 PY na AR ou 0,2 E/100 PY na APS e 0,3 E/100 PY na EA. O número de eventos com a UPA foi comparável ao da ADA (AR e APS) e do MTX (AR) (Fig. 1). Não foi observada correlação entre a duração da exposição à UPA e a ocorrência de TEV. A maioria dos doentes que sofreram TEV tinham pelo menos um factor de risco cardiovascular e/ou tromboembólico [1].
Os pacientes que receberam UPA também tiveram relatos de herpes zoster, como esperado. Em geral, esta situação era ligeira ou moderada. O herpes zoster raramente levou à interrupção da terapêutica e só afectou um único dermatoma. Além disso, não foi possível estabelecer uma correlação entre a duração do tratamento e a ocorrência de herpes zoster [1]. A vacina contra o herpes zoster está disponível. A vacina deve ser administrada 4 semanas antes do tratamento com um agente imunomodulador activo, como a UPA [4].
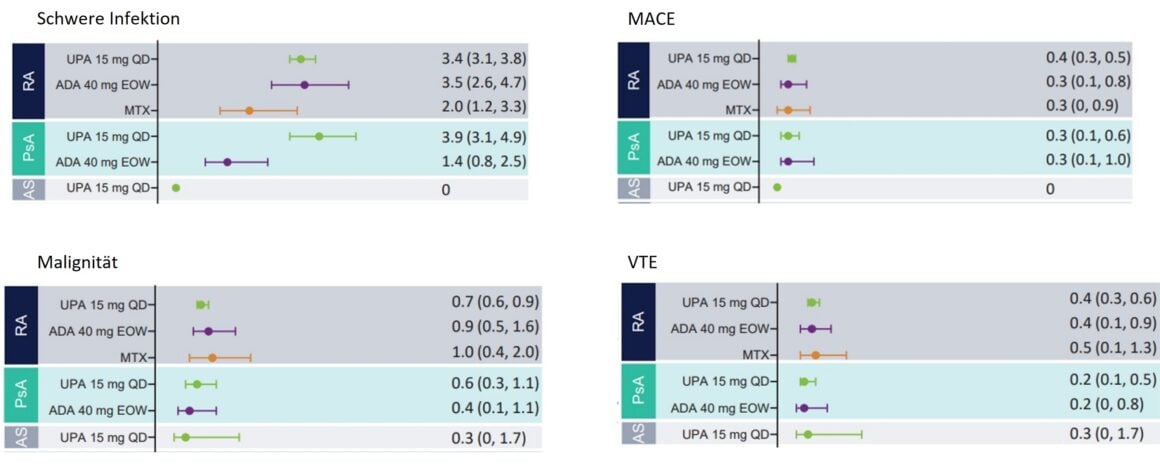
Figura 1: Taxas ajustadas à exposição de eventos adversos emergentes do tratamento (TEAEs) de particular interesse em pacientes com AR, PsA e AS. MACE, Eventos Cardiovasculares Adversos Graves; TEV, Tromboembolismo Venoso. Adaptado de [1]
Ponderação do perfil risco-benefício
O tratamento das doenças reumáticas deve ter como objectivo a obtenção de uma remissão sustentada [5]. A remissão não só melhora o resultado do tratamento, como também reduz o fardo do doente para além dos sintomas da doença. Assim, a remissão reduz o risco de infecção [6], o risco de doença cardiovascular [7] e possivelmente também o risco de linfoma [8]. Os inibidores da JAK demonstraram ser uma alternativa eficaz para os doentes com AR, EA e APS com resposta inadequada ou intolerância aos medicamentos csDMARDs ou bDMARDs [4]. O inibidor da JAK UPA foi e está a ser investigado em programas clínicos abrangentes de fase III [1]. Estão disponíveis os primeiros dados a longo prazo da UPA, que investigam a segurança e a eficácia em doentes com AR e resposta inadequada ao metotrexato. A UPA em combinação com MTX é superior à ADA com MTX em termos de resposta clínica. A eficácia nos sintomas articulares foi medida pelos critérios de resposta ACR, pela intensidade da dor e pela preservação da função física. Além disso, uma proporção significativamente mais elevada de doentes sob UPA atingiu a remissão ou uma baixa actividade da doença. As taxas de acontecimentos adversos foram comparáveis às da ADA, com excepção do herpes zoster, linfopenia, disfunção hepática (principalmente elevações da ALT e ALS) e elevações da CPK. Analisando os benefícios e riscos da UPA em comparação com a ADA, a UPA mostrou melhores resultados clínicos com um perfil comparável de eventos adversos (Fig. 2) [9].

Figura 2: Relação benefício-risco entre UPA e ADA num contexto clínico. O número incremental de doentes que atingiram os parâmetros de eficácia e segurança baseou-se nas estimativas pontuais do Número Necessário para Tratar (NNT) e do Número Necessário para Prejudicar (NNH) para o tratamento com UPA em vez de ADA. a Diferença estatisticamente significativa para UPA vs. ADA (95% Ki). Adaptado de acordo com [9]
Conclusão
Em resumo, o perfil de segurança da UPA na AR, APS e EA é comparável e não foram observados novos sinais de segurança, mesmo com um tratamento a longo prazo com UPA até 5,5 anos (1). Além disso, a UPA apresenta um perfil de segurança consistente na AR, APS e EA, embora a frequência dos efeitos secundários varie devido a diferenças na população de doentes e nas comorbilidades relacionadas com a doença. Globalmente, o perfil de segurança da UPA na AR e na APS é comparável ao da ADA e do MTX (1).
A publicação completa de Burmester et al. pode ser consultada aqui.
ACR, American College of Rheumatology (Colégio Americano de Reumatologia); ADA, adalimumab; ALT, alanina aminotransferase; ALS, aspartato aminotransferase; CV, cardio-vascular; CDAI, Clinical Disease Activity Index (Índice de Actividade Clínica da Doença); csDMARD, fármacos anti-reumáticos modificadores da doença sintéticos convencionais; DAS28, 28-joint Disease Activity Score (Pontuação de Actividade da Doença em 28 articulações); HZ, herpes zoster; IR, resposta inadequada; KI, intervalo de confiança; LDA, baixa actividade da doença; MACE, evento cardiovascular adverso importante; MTX, metotrexato; NNT, número necessário para tratar; NMSC, cancro da pele não melanoma; NNH, número necessário para causar danos; UPA, upadacitinib; VTE, tromboembolismo venoso.
Referências:
1. Burmester, G.R., et al, Safety profile of upadacitinib over 15 000 patient-years across rheumatoid arthritis, psoriatic arthritis, ankylosing spondylitis and atopic dermatitis. RMD Open, 2023. 9(1).
Gudu, T. e L. Gossec, Qualidade de vida na artrite psoriática. Expert Rev Clin Immunol, 2018. 14(5): p. 405-417.
Combe, B., et al, actualização de 2016 das recomendações da EULAR para a gestão da artrite precoce. Ann Rheum Dis, 2017. 76(6): p. 948-959.
4. informações técnicas actuais sobre RINVOQ® (upadacitinib) em
www.swissmedicinfo.ch
.
Smolen, J.S., et al, recomendações da EULAR para o tratamento da artrite reumatóide com medicamentos antirreumáticos modificadores da doença sintéticos e biológicos: atualização de 2019. Ann Rheum Dis, 2020. 79(6): p. 685-699.
6 Accortt, N.A., et al, Impacto da Remissão Sustentada no Risco de Infecção Grave em Pacientes com Artrite Reumatóide. Arthritis Care Res (Hoboken), 2018. 70(5): p. 679-684.
7. Solomon, D.H., et al, Actividade da doença na artrite reumatóide e o risco de eventos cardiovasculares. Arthritis Rheumatol, 2015. 67(6): p. 1449-55.
8 Baecklund, E., et al, Association of chronic inflammation, not its treatment, with increased lymphoma risk in rheumatoid arthritis. Arthritis Rheum, 2006. 54(3): p. 692-701.
9 Conaghan, P., et al, Análise Benefício-Risco de Upadacitinib Comparado com Adalimumab no Tratamento de Pacientes com Artrite Reumatóide Moderada a Grave. Rheumatol Ther, 2022. 9(1): p. 191-206.
As referências podem ser solicitadas por profissionais em medinfo.ch@abbvie.com.
Relatório: Corinne Peter, MD
Este artigo foi produzido com o apoio financeiro da AbbVie AG, Alte Steinhauserstrasse 14, Cham.
CH-RNQD-230016_04/2023
Em linha desde 04.05.2023











