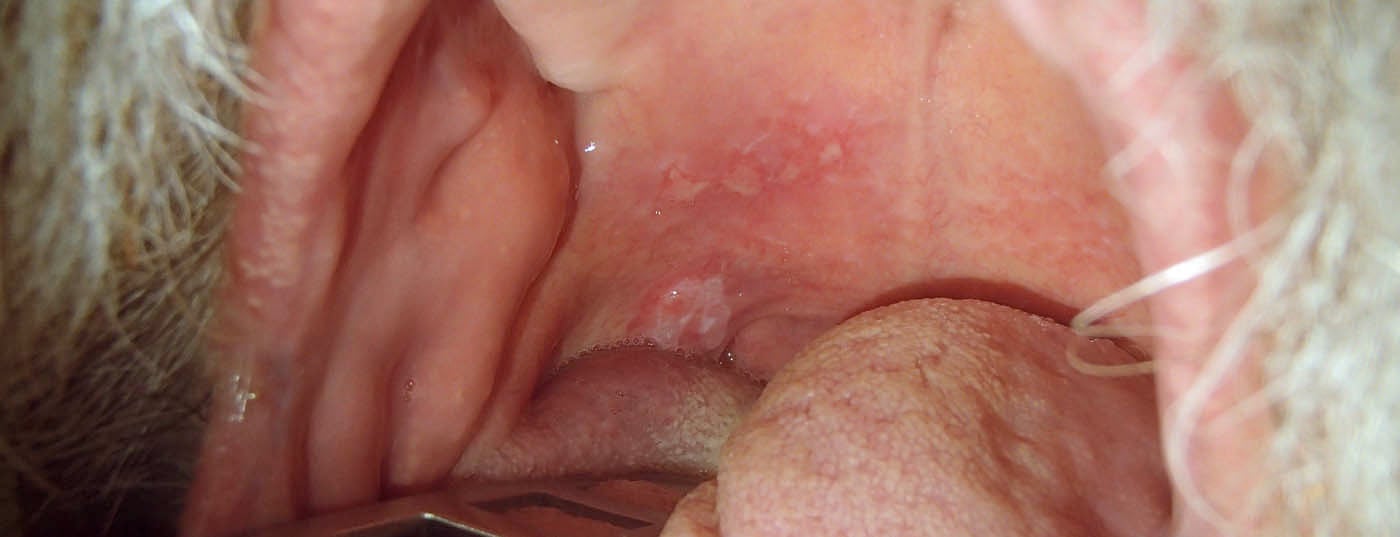
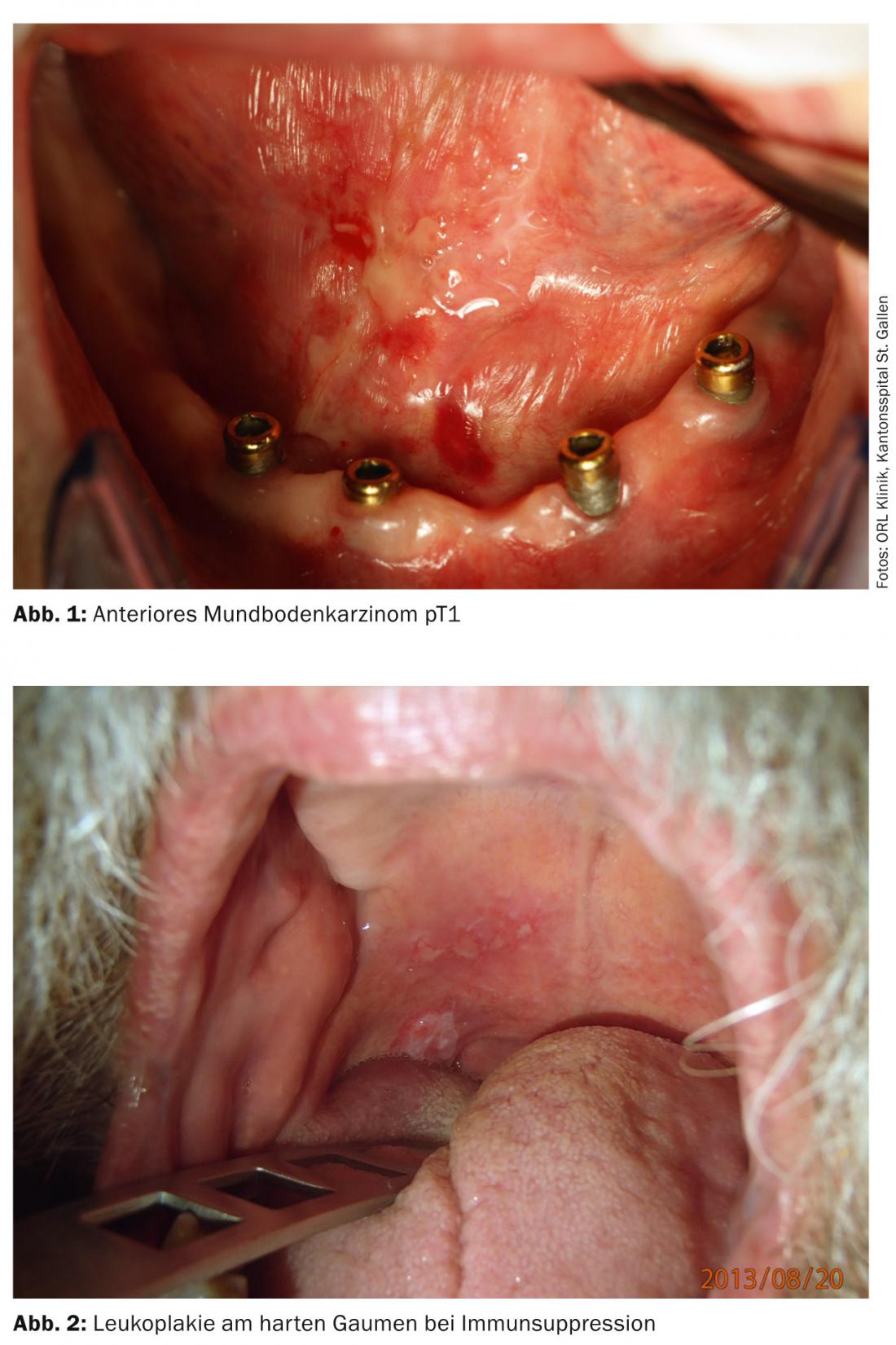
Os factores de risco importantes para carcinomas das cavidades orais nas nossas latitudes são o consumo de tabaco e álcool, infecção crónica com HPV de alto risco, imunossupressão e tumores anteriores na região da cabeça e pescoço. Muitas vezes os carcinomas só são detectados nas fases tardias, razão pela qual a taxa de sobrevivência global dos doentes com carcinoma da cavidade oral é de apenas 50%. O tratamento consiste principalmente na ressecção cirúrgica de tumores com ou sem terapia(quimio)adjuvante de rádio. Em todos os pacientes com fases T1/T2cN0, recomenda-se a biopsia do gânglio linfático sentinela para determinar a necessidade de dissecção do pescoço.
Cerca de 5% de todos os tumores malignos a nível mundial são carcinomas das cavidades orais, 95% dos quais são carcinomas das células escamosas [1]. A idade máxima é de 60 anos. Há uma ligeira predisposição para o sexo masculino.
Factores de risco: Tabagismo, álcool e infecção com HPV de alto risco.
Os principais factores de risco para o desenvolvimento de carcinoma na cavidade oral são o consumo de tabaco (mais de 1 maço/d) e o abuso de álcool (mais de 100 g/d). Noutros países como a Índia, onde se consome nozes de bétel e tabaco para mascar, o carcinoma das cavidades orais é mesmo um dos malignos mais comuns. Outra causa é a imunossupressão, que tem ganho importância com o número crescente de doentes imunossuprimidos, por exemplo após o transplante de órgãos. A taxa de incidência em indivíduos após transplante é de 5% após 20 anos e depende principalmente do grau de reacção enxerto-versus-hospedeiro [2].
Nos últimos anos, tem havido um aumento das indicações em doentes mais jovens com menos de 45 anos de idade, o que pode ser explicado, analogamente ao carcinoma orofaríngeo, por uma prevalência crescente de carcinomas causados por tipos de alto risco do vírus do papiloma humano (HPV). Contudo, a proporção de carcinomas associados ao HPV na cavidade oral, com menos de 20%, é significativamente inferior à da orofaringe, com mais de 50%.
Outro factor de risco importante para o desenvolvimento de um tumor maligno no tubo superior do ar é um tumor maligno anterior na região da cabeça e pescoço. Numa avaliação retrospectiva de quase 100.000 pacientes, o risco cumulativo de desenvolver um segundo tumor primário no tracto aerodigestivo superior após 20 anos era de 36% [3]. A razão para isto poderia ser a “nova” abordagem desenvolvida por Slaughter et al. descrita pela primeira vez em 1953, que descreve que os efeitos cancerígenos do tabaco e do álcool actuam simultaneamente em várias áreas do tracto aerodigestivo superior e desencadeia o desenvolvimento de vários tumores primários independentes [4].
Lesões pré-cancerosas
Alguns carcinomas da cavidade oral surgem devido a uma lesão precursora ou a condições pré-malignas. A leucoplasia, que ocorre com uma prevalência de 0,2-5%, é considerada uma condição pré-cancerosa opcional; as condições pré-cancerosas obrigatórias são a eritroplasia e a leucoplasia verrucosa. A leucoplasia pode corresponder histopatologicamente à simples hiperplasia epitelial ao carcinoma invasivo [5]. As lesões no chão da boca e na borda da língua mostram mais frequentemente áreas displásicas em comparação com a mucosa bucal [6].
Uma vez que a distinção entre uma mudança benigna, pré-maligna ou maligna é dificilmente possível clinicamente, recomenda-se a remoção da biópsia. As displasias leves e moderadas devem ser monitorizadas ao longo do seu curso, uma vez que 3-8% das leucoplasias degeneram ao longo de um período de cinco anos. Se for histopatologicamente uma displasia de alto grau, a lesão é removida com uma margem de segurança de 0,5 cm. Devido ao risco de um falso achado negativo, especialmente com alterações de grandes áreas, a mucosectomia é recomendada como alternativa [5]. No caso de eritroplasia como lesões pré-cancerosas obrigatórias, recomenda-se a ressecção cirúrgica em todos os casos.
Métodos para diagnóstico precoce
Os tumores das passagens superiores de ar e alimentos permanecem frequentemente assintomáticos durante muito tempo e são assim descobertos tardiamente (Fig. 1 e 2) . Assim, apenas um terço dos doentes com carcinoma da cavidade oral são diagnosticados numa fase precoce sem metástase regional. Cerca de 10% dos doentes já têm metástases à distância no diagnóstico [7].
Uma vez que o momento do diagnóstico afecta directamente o prognóstico de um paciente, a detecção precoce de uma lesão pré-maligna ou invasiva é de grande importância. Para melhorar o diagnóstico precoce, propagou-se a coloração do tecido com corantes como o azul toluidina; além disso, foram desenvolvidos vários métodos técnicos como o diagnóstico por autofluorescência, espectroscopia óptica, tomografia de coerência óptica ou imagens de banda estreita (NBI). Numa meta-análise que examinou o uso de azul toluidina na região da cabeça e pescoço, a sensibilidade para a detecção de um tumor invasivo foi de 78-100% e a especificidade foi de 30-100%. Para a displasia, o método foi positivo em apenas cerca de metade dos casos [8]. A técnica não se estabeleceu como método de rastreio devido à sua baixa especificidade [9,10], como também foi demonstrado numa meta-análise recente. Isto comparou a coloração azul toluidina, os cittodiagnósticos e a espectroscopia de reflexão difusa (DRS) com autofluorescência induzida por laser (LIAF) [11]. A maior precisão diagnóstica foi alcançada pelo DRS (97%) e pelo LIAF (96%). Ambas as técnicas eram claramente superiores aos outros métodos, sendo a coloração azul toluidina a pior (67%).
Volgger et al. investigou o significado da tomografia de coerência óptica para o diagnóstico de tumores no tracto aerodigestivo superior [5]. Os autores concluem que a tomografia de coerência óptica é um instrumento adequado para o diagnóstico precoce de tumores devido à sua alta resolução e facilidade de utilização, mas não pode substituir uma biópsia. Estudos anteriores chegaram a uma conclusão semelhante [12,13].
A imagem de banda estreita (NBI) está focada no melhoramento do contraste de imagem de estruturas vasculares superficiais, revelando neoplasias vasculares características em lesões pré-malignas ou invasivas que podem ser usadas para diagnóstico precoce. Uma revisão recente concluiu que a precisão diagnóstica da NBI é de 92-97% em comparação com 66-89% para a endoscopia à luz branca; assim, a NBI tem grande utilidade potencial na detecção e avaliação de lesões pré-malignas e invasivas [14]. No entanto, em princípio, a clarificação histológica precoce das alterações nas mucosas orais continua a ser o método de diagnóstico de escolha.
Encenação
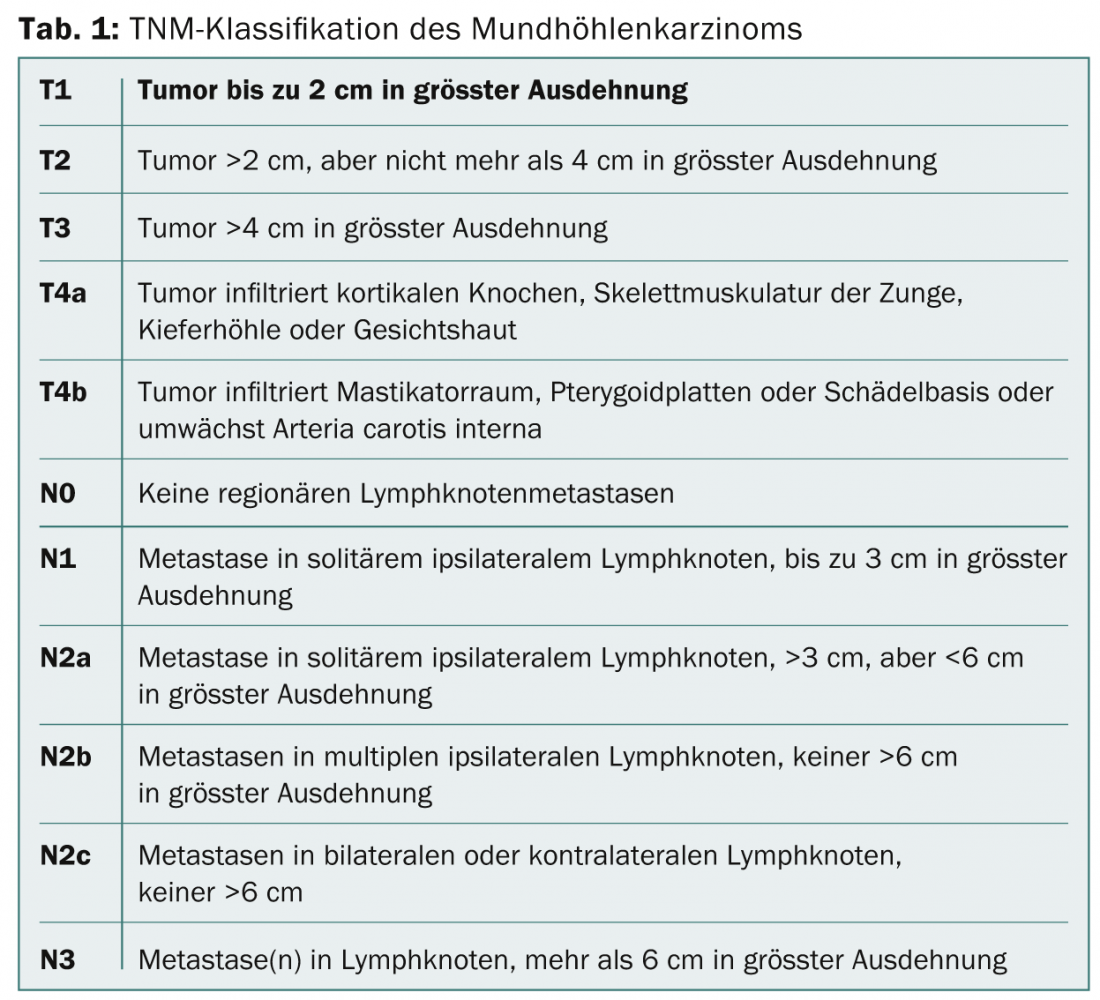
No caso do carcinoma da cavidade oral, a decisão de tratamento deve ser tomada após discussão num painel interdisciplinar de tumores, tendo em conta a localização exacta do tumor, a fase do tumor de acordo com a classificação TNM (Tab. 1), as doenças secundárias e os desejos do doente. Se a biopsia tiver confirmado o diagnóstico de carcinoma da cavidade oral, deve ser realizada uma sonografia dos tecidos moles do pescoço com aspiração de agulha fina dos gânglios linfáticos para o estadiamento. A clarificação radiológica do tumor primário é feita de preferência através de ressonância magnética (RM), especialmente porque a RM é mais capaz de mostrar a extensão do tecido mole e tem a mesma sensibilidade no que diz respeito à infiltração óssea na mandíbula ou maxila que a tomografia computorizada de alta resolução (TC) [15]. Uma panendoscopia superior é geralmente realizada sob anestesia, para avaliação clínica detalhada do tumor e para excluir segundos tumores sincrónicos, que podem ser detectados em cerca de 5% dos pacientes [16]. Em fases avançadas do tumor (cT3-4 ou cN2-3), a tomografia por emissão de pósitrons (PET) com fluorodeoxiglusoe (FDG) foi estabelecida para a encenação e exclusão de metástases distantes [17].
Opções terapêuticas
Para o tratamento das fases iniciais do tumor (cT1-2 e cN0-1), a “terapia de uma única modalidade” é geralmente suficiente, geralmente apenas sob a forma de cirurgia [15]. Alternativamente, a radioterapia (radiação percutânea ou braquiterapia) pode ser considerada. Os carcinomas avançados da cavidade oral (cT3-4, >cN1) são geralmente tratados multimodalmente com ressecção cirúrgica e radioterapia adjuvante com ou sem quimioterapia concomitante [15]. Com base no trabalho de Bernier e Cooper, a indicação para quimioterapia adjuvante com cisplatina a radiação adjuvante é dada para o crescimento do tumor extracapsular (ECS), carcinomatose linfangiosa, propagação do tumor perineural e margens de ressecção positivas [18–20]. Um estudo recente confirma que, especialmente em pacientes com ECS, a sobrevivência de 2 e 5 anos pode ser significativamente melhorada pela quimioterapia [21].
A cirurgia primária seguida de radioterapia adjuvante com ou sem quimioterapia é o tratamento de escolha para o carcinoma avançado na maioria dos centros. Cohen et al. mas mostram resultados funcionais comparáveis e taxas de sobrevivência em pacientes irradiados primários com carcinomas T4 [22]. Em contraste, o estudo de Gore et al. uma clara vantagem de sobrevivência dos pacientes tratados com cirurgia primária [23].
A radioterapia acarreta o risco de osteonecrose como consequência a longo prazo, especialmente da mandíbula [24]. A incidência é de 2-22% [25]. No entanto, a osteonecrose raramente ocorre após a irradiação com uma dose inferior a 60 Gy. A radiação hiperfractiva ou moderadamente acelerada e a utilização de radioterapia de intensidade modulada parecem minimizar o risco [26,27]. A braquiterapia e a quimioterapia concomitante, por outro lado, são factores de risco para a osteonecrose [24,28,29].
Desafios da reconstrução
O desafio na cirurgia é de ressecar o tumor com margem de segurança suficiente e ainda preservar a função. Os défices pós-terapêuticos na deglutição e na função da fala são comuns e afectam significativamente a qualidade de vida [30]. De acordo com os inquéritos actuais, 50-75% dos sobreviventes a longo prazo são afectados por algum grau de perturbações de deglutição e/ou articulação [31–33].
Uma vez que a localização e a extensão da ressecção estão correlacionadas com a disfunção pós-operatória, a técnica de reconstrução escolhida deve ter em conta tanto o aspecto anatómico como a função [34]. Várias técnicas foram desenvolvidas para este fim. Vão desde o fecho primário, cicatrização por secundam, enxertos cutâneos fendidos, abas de deslocamento e abas pediculadas até abas anastomosadas microvasculares livres. A gestão dos defeitos de ressecção varia muito e depende não menos da experiência do cirurgião. De acordo com Shah et al. defeitos superficiais da mucosa e dos tecidos moles subjacentes podem ser adequadamente fechados com enxertos de pele fendidos [35]. Os nossos próprios dados mostram que a reconstrução do defeito é frequentemente desnecessária nas fases iniciais e que a cura por secundam produz bons resultados funcionais [36].
Gestão da área de drenagem linfática
20-30% dos doentes com tumores em fase inicial (T1/T2cN0) têm metástases ocultas, razão pela qual a dissecção electiva do pescoço é preferível a uma estratégia de “vigiar e esperar” [37]. A extensão da cirurgia no pescoço mudou durante a última década, de procedimentos radicais para técnicas minimamente invasivas. Como alternativa à dissecção electiva do pescoço, a biopsia do gânglio linfático sentinela (SNB) foi estabelecida em muitos centros nos últimos 15 anos para todos os doentes com T1/T2cN0. Em até 38% dos pacientes, são detectados gânglios linfáticos positivos e é realizada uma dissecção completa do pescoço. Se houver crescimento de tumor extracapsular ou se forem afectados mais de dois gânglios linfáticos, é indicada a radiochemoterapia adjuvante [38]. O SNB está associado a um risco cirúrgico reduzido e a uma morbilidade significativamente menor do que a dissecção electiva do pescoço [39,40]. Em doentes com metástases linfonodais verificadas citologicamente ou radiologicamente prováveis, há uma indicação de ressecção simultânea do tumor primário e da dissecção terapêutica do pescoço.
Factores prognósticos
A taxa de sobrevivência global dos doentes com carcinoma da cavidade oral é de 50%; esta taxa não aumentou significativamente nas últimas décadas, apesar dos avanços técnicos na terapia e imagiologia [15]. Para além da fase tumoral, vários parâmetros histopatológicos surgiram como importantes factores prognósticos. Segundo um dos nossos estudos, contudo, não é a espessura do tumor e a profundidade de infiltração, mas o grau de diferenciação tumoral e um padrão de crescimento dissoluto na frente tumoral que parecem aumentar significativamente o risco de metástases linfogénicas e, assim, influenciar a sobrevivência [41].
A ressecção com uma margem de segurança suficiente é de importância prognóstica crucial, no entanto, a definição de margens de ressecção adequadas dá sempre lugar a discussão. Em 1978, as margens de ressecção positivas foram relatadas por Looser et al. definido como uma distância ao tumor inferior a 5 mm ou células displásicas na margem de ressecção [42]. Este conceito ainda é utilizado. Requer ressecção com uma margem de ressecção cirúrgica de pelo menos 1 cm devido ao encolhimento do tumor em formalina, que nem sempre é possível dependendo do tamanho e localização do tumor.
Os conceitos futuros darão provavelmente maior peso à importância das alterações moleculares nas margens ressecadas [43]: As alterações epigenéticas nas células tumorais, que são decisivas para a tumourigénese e estão a ser identificadas cada vez mais, devem ser determinadas intra-operatoriamente com reacções em cadeia da polimerase quantitativa (PCR) num procedimento rápido [44]. Isto permite definir as margens de ressecção necessárias, e estes factores também podem ser tidos em conta ao determinar a indicação para a terapia adjuvante. Supic et al. investigou a hipermetrotilação aberrante de vários genes (p16, DAPK, E-cad e outros) e descobriu que nas margens de ressecção histologicamente negativas, a hipermetrotilação do gene DAPK, em particular, estava associada a uma sobrevivência mais fraca [45]. Na nossa opinião, quanto mais tempo este princípio for aplicado, mais ele encontrará o seu caminho na rotina clínica.
Mensagens Take-home para o praticante
- 95% dos carcinomas das cavidades orais são carcinomas de células escamosas.
- Muitas vezes só são reconhecidos nas fases tardias.
- Os carcinomas da cavidade oral são tratados principalmente cirurgicamente com ou sem rádio(quimioterapia)adjuvante.
- Para as fases T1/T2cN0, recomenda-se uma biopsia do gânglio linfático sentinela.
- No futuro, a determinação de alterações moleculares nas margens ressecadas tornar-se-á mais importante para uma ressecção cirúrgica adequada.
Martina A. Broglie Däppen, MD
Séverine M. Niederer-Wüst, MD
Prof. Dr. med. Sandro J. Stöckli
Literatura:
- Thomas L, et al: Am J Otolaryngol 2012; 33(6): 650-656.
- Curtis RE, et al: Blood 2005; 105(10): 3802-3811.
- Chuang SC, et al: Int J Cancer 2008; 123(10): 2390-2396.
- Slaughter DP, et al: Cancer 1953; 6(5): 963-968.
- Volgger V, et al: Head Neck 2013; 35(11): 1558-1566.
- Neville BW, Day TA: CA Cancer J Clin 2002; 52(4): 195-215.
- Howlader N, et al: J Natl Cancer Inst 2009; 101(7): 533-36.
- Gray M, et al: Br Dent J 2000; 189(3): 125.
- Lingen MW, et al: Oral Onc 2008; 44(1): 10-22.
- Patton LL, et al: J Am Dent Assoc 2008; 139(7): 896-905.
- Fuller C, et al: Head Neck 2014 Mar 5. [Epub ahead of print]
- Wilder-Smith P, et al: Lasers Surg Med 2009; 41(5): 353-357.
- Hamdoon Z, et al: Photodiagnosis Photodyn Ther 2011; 8(1): 49-52.
- Vu AN, Farah CS: Oral Oncol 2014; 50(5): 413-420.
- Belcher R, et al: J Surg Oncol 2014; 110(5): 551-574.
- Haerle SK, et al: Head Neck 2010; 32(3): 319-325.
- Arias F, et al: Clin Transl Onc 2014 Jul 31. [Epub ahead of print]
- Bernier J, et al: N Engl J Med 2004; 350(19): 1945-1952.
- Bernier J, Cooper JS: Oncologista 2005; 10(3): 215-224.
- Cooper JS, et al: NEJM 2004; 350(19): 1937-1944.
- Zhang H, et al: J Otolaryngol Head Neck Surg 2013; 42: 30.
- Cohen EE, et al: Head Neck 2009; 31(8): 1013-1021.
- Gore SM, et al: Pescoço da cabeça. 2014 Fev 15. [Epub ahead of print]
- Schwartz HC, et al: Am J Clin Onc 2002; 25(2): 168-171.
- Store G, et al: Clin Otolaryngol Allied Sci 2000; 25(5): 378-384.
- Liões A, Ghazali N: Br J Oral Maxillofac Surg 2008; 46(8): 653-660.
- Studer G, et al: Strahlenther Onk 2006; 182(5): 283-288.
- Kuhnt T, et al: Med Oncol 2006; 23(3): 325-333.
- Hehr T, et al: Radiother Oncol 2006; 80(1): 33-38.
- Dwivedi RC, et al: Eur Arch Otorhinolaryngol 2012; 269(4): 1233-1239.
- Suarez-Cunqueiro MM, et al: Arco Otolaryngol Head Neck Surg 2008; 134(12): 1299-1304.
- Pauloski BR, et al: Head Neck 2006; 28(12): 1069-1076.
- Gillespie MB, et al: Arch Otolaryngol Head Neck Surg 2005; 131(7): 615-619.
- de Bree R, et al: Eur Arch Otorhinolaryngol 2008; 265(1): 1-9.
- Shah JP, Gil Z: Oral Oncol 2009; 45(4-5): 394-401.
- Romer, dados ainda não publicados.
- Stoeckli SJ, Broglie MA: Curr Opinião Otolaryngol Head Neck Surg 2012; 20(2): 103-08.
- Broglie MA, et al: Head Neck 2013; 35(5): 660-666.
- Schiefke F, et al: Head Neck 2009; 31(4): 503-512.
- Murer K, et al: Head Neck 2011; 33(9): 1260-1264.
- Goerkem M, et al: Ann Surg Onc 2010; 17(2): 527-535.
- Looser KG, et al: Head Neck Surg 1978; 1(2): 107-111.
- Weinstock YE, et al: Oral Maxillofac Surg Clin North Am 2014; 26(2): 151-162.
- Goldenberg D, et al: Arch Otolaryngol Head Neck Surg 2004; 130(1): 39-44.
- Supic G, et al: Oral Oncol 2011; 47(8): 702-708.
InFo ONCOLOGy & HEMATOLOGy 2014; 2(10): 6-10