O principal problema da angioplastia é a estenose recorrente, uma grande percentagem da qual é devida ao desenvolvimento da hiperplasia neointimal (NIH). Isto pode ser eficazmente suprimido através da aplicação de medicamentos antiproliferativos em stents e balões. Estudos iniciais sobre o tema mostram resultados encorajadores, esperando-se que mais ensaios aleatórios forneçam mais informações sobre potenciais efeitos secundários, selecção de doentes e também sobre a relação custo-benefício.
Numerosos estudos epidemiológicos utilizando técnicas de exame objectivo mostram uma prevalência de doença arterial periférica (DVPA) de 3-10% e 15-20% a partir da idade de 70 anos. Clinicamente, PAOD apresenta-se em fases desde pacientes assintomáticos até à isquemia de membros críticos (CLI). Após o diagnóstico de LCI, 30% dos pacientes sofrem uma amputação no primeiro ano, 20% têm dor persistente e ulceração [1]. A taxa de mortalidade de um ano aqui é de 20%, com eventos cardíacos e cerebrais a dominarem o destino dos pacientes. A revascularização é, portanto, um objectivo terapêutico primordial. O sucesso técnico da angioplastia transluminal percutânea (PTA) é geralmente muito elevado. Para eventos agudos como as dissecções limitadoras de fluxo e o “recuo elástico” da artéria, o stent oferece uma solução mecânica no sentido de um suporte de vaso. O principal problema do método é a ocorrência de estenose recorrente, que ocorre em 30-50%/ano, dependendo da extensão e localização da lesão. A principal causa da estenose recorrente é o desenvolvimento da hiperplasia neointimal (NIH). Isto pode ser eficazmente suprimido pela aplicação tópica de medicamentos antiproliferativos. Na angioplastia coronária percutânea, este conceito tem sido aplicado com sucesso há quase uma década e é amplamente apoiado por vários ensaios aleatorizados. Em contraste, a evidência para este método na área de fluxo periférico é significativamente menor. Um artigo de revisão sobre o tema já foi publicado no VASA 02/2012 [2]. A seguir, foram acrescentados os resultados do estudo actual.
Estenose recorrente após angioplastia
O NIH é o resultado de uma cascata vasoproliferativa que começa no trauma vascular por PTA com danos endoteliais e activação plaquetária. Os complexos mecanismos bioquímicos envolvidos no desenvolvimento do NIH ainda não são totalmente compreendidos. Eventos secundários como o stress oxidativo e a inflamação causam a expressão de várias metaloproteinases de matriz (MMPs) através de um aumento dos radicais livres, que contribuem para a degradação do colagénio e da elastina na parede arterial e assim permitem a migração das células para a íntima vascular. O paradigma de que estas células são apenas células musculares lisas vasculares que perderam expressão de desmin e contractilidade e agora expressam vimentina foi desafiado pela investigação de vários grupos. Foi demonstrado que após a angioplastia coronária ou cirurgia de bypass, os fibroblastos também migram da adventícia através dos meios de comunicação social para a íntima e adquirem a expressão do SMA (“smooth muscle actin”), transformando-se assim em miofibroblastos [3–5]. Após PTA de shunts de diálise, foram também detectadas células musculares lisas e células endoteliais derivadas de células estaminais circulantes da medula óssea [6]. De um ponto de vista terapêutico, está a ser criada aqui uma base promissora para novas abordagens terapêuticas.
Uma vez na íntima vascular, os miofibroblastos proliferam e sintetizam proteínas de matriz extracelular. Este processo termina tipicamente cerca de três a quatro meses após um trauma vascular numa camada celular neointimal, o que, dependendo da sua espessura, pode restringir o lúmen do vaso a tal ponto que ocorre uma estenose recorrente. A aplicação de drogas inibitórias do ciclo celular antiproliferativo em balões e stents (paclitaxel, sirolimus, everolimus) suprime eficazmente a formação da camada neointimal. A administração tópica permite elevadas concentrações locais de fármacos sem causar potenciais efeitos secundários sistémicos.
Sirolimus (rapamicina) é um macrolídeo natural com efeitos imunossupressores. É capaz de aumentar a concentração da proteína inibitória do ciclo celular p27, o que inibe a transição da fase G1 para a fase S da célula. Everolimus, que é um derivado do sirolimus, tem o mesmo mecanismo de acção. A substância activa Paclitaxel (PTX) foi originalmente isolada da casca do teixo do Pacífico (Taxus brevifolia). Recentemente, pode ser parcialmente sintetizada a partir do teixo europeu. O paclitaxel liga-se irreversivelmente à beta-tubulina e evita assim a degradação das microtubulas, razão pela qual a célula já não se pode dividir mitoticamente. O paclitaxel é altamente lipofílico e por isso é rapidamente absorvido pela parede vascular.
Situação do estudo
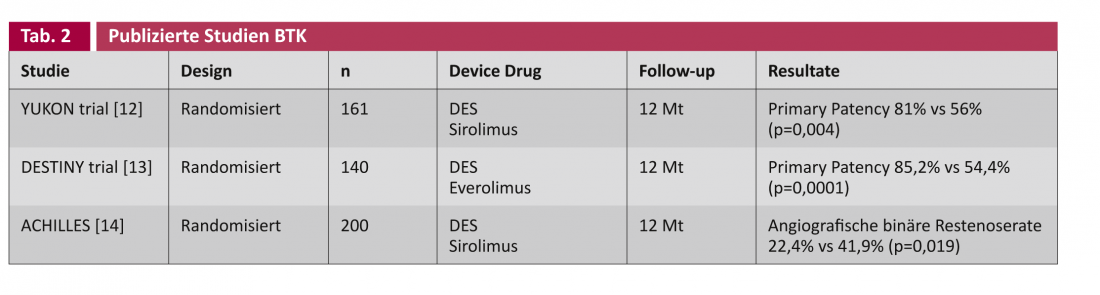
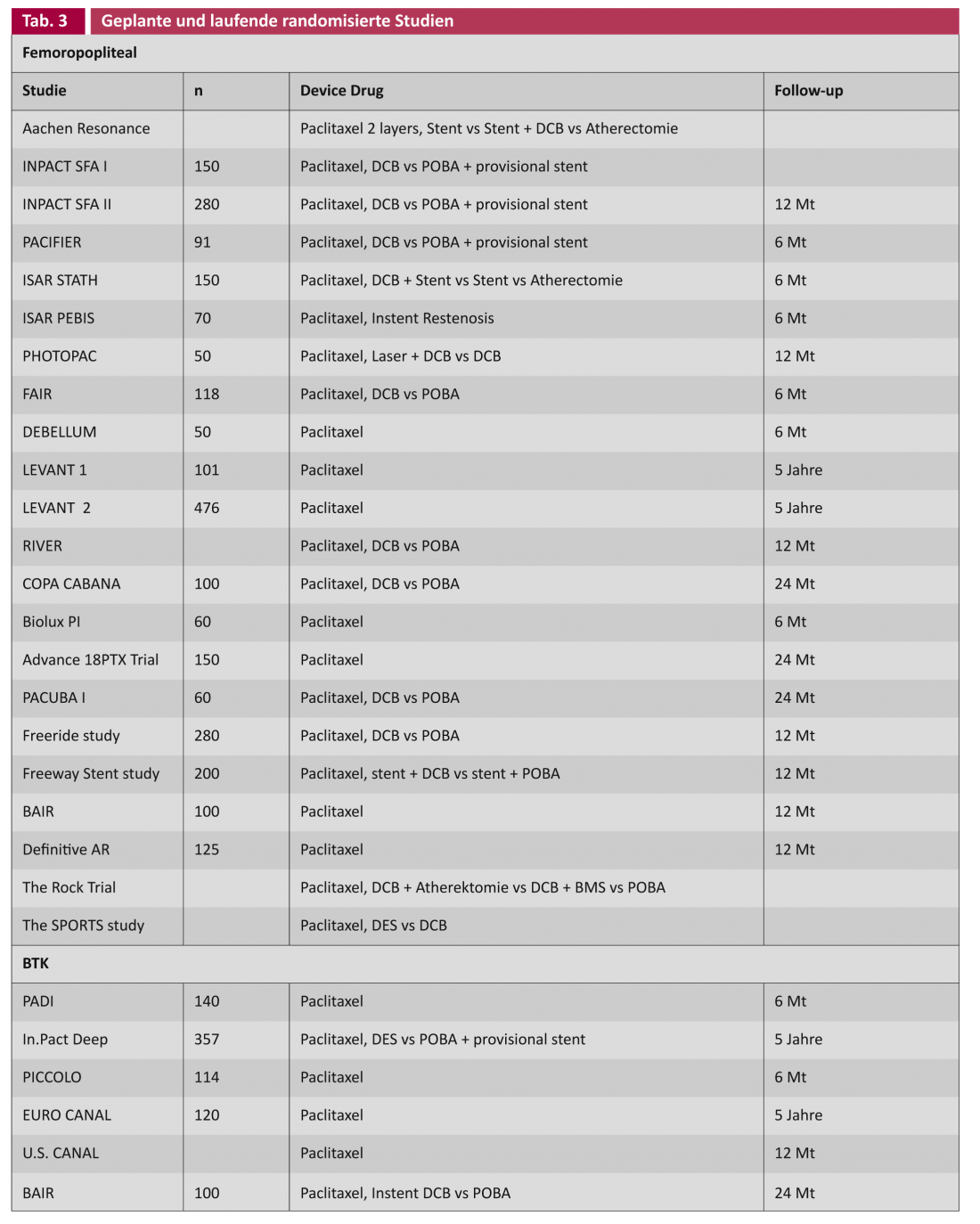
Nos estudos sobre endopróteses com eluição de drogas (DES) e balões revestidos com drogas (DCB), é feita uma distinção geral entre as aplicações nas artérias femoropoplíteas (tabela 1) e nas artérias abaixo do joelho (BTK) (tabela 2).
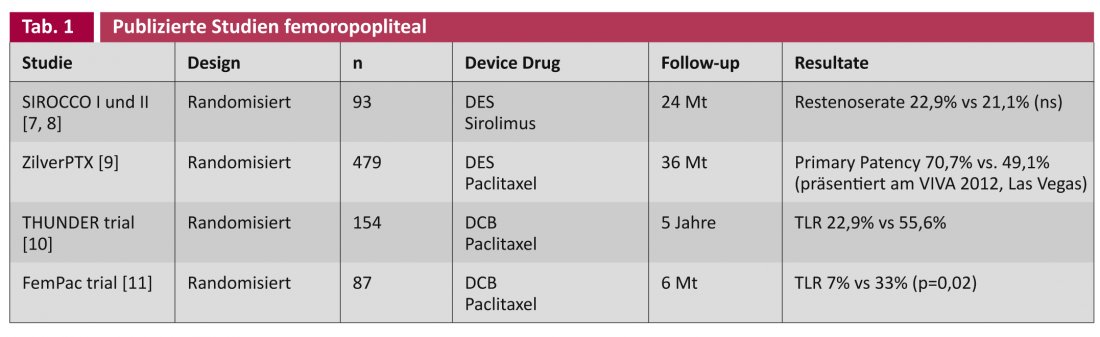
Os estudos SIROCCO foram conduzidos em 2002 e 2002, respectivamente. Em 2006, um stent sirolimus-eluting foi comparado aleatoriamente com o mesmo stent não revestido no tratamento da artéria femoral superficial [7, 8]. Após dois anos, não foi encontrada qualquer diferença na ocorrência de estenose recorrente, possivelmente devido à concentração de sirolimo ser demasiado baixa (90 μg/cm2). O recente estudo prospectivo randomizado e multicêntrico do stent ZilverPTX® comparou um stent de nitinol com paclitaxel (3 μg/mm2) contra a angioplastia simples de balão velho (POBA) e o mesmo stent de metal nu não revestido (BMS) em 479 pacientes. O estudo foi concebido para cinco anos, com resultados provisórios a serem relatados continuamente em congressos: Após actualmente três anos, o stent revestido mostra uma superioridade clara estatisticamente significativa na patência primária (= “ausência angiográfica ou duplex sonográfica de estenose recorrente”) de 70,7% vs. 49,1% (apresentado VIVA 2012, Las Vegas).
Em princípio, é desejável no tratamento de lesões vasculares se nenhum material estranho, como um stent, tiver de ser deixado para trás. O conceito de DCB tem isto em conta. No ensaio THUNDER, existe uma vantagem significativa para a DCB no que respeita à taxa de reintervenção (“target lesion revascularisation”, TLR) mesmo após cinco anos, embora apenas com lesões vasculares curtas (Leipzig Interventional Course 2012). Resta saber se existe também um lugar para o DCB em lesões longas e fortemente calcificadas. Estão em curso estudos que investigam a DCB em conjunto com outras tecnologias, tais como a aterectomia, bem como toda uma série de estudos de DCB em uso primário (Tab. 3).
O uso de tecnologia de eluição de drogas no segmento arterial infrapoplíteo requer uma consideração separada. Os pacientes com isquemia de membros críticos têm geralmente múltiplas obstruções das artérias da perna inferior, como se verifica nos diabéticos e nos pacientes com insuficiência renal grave. Ao assegurar pelo menos um recipiente aberto ao pé (“fluxo em linha recta”), a cura da ferida deve ser melhorada e a taxa de amputação reduzida. No entanto, a angioplastia apenas nas artérias da perna inferior produz frequentemente um resultado de dilatação insuficientemente bom, sobretudo devido ao comprimento das oclusões dos vasos. A dissecação e o recuo ocorrem frequentemente aqui, podendo levar à oclusão precoce nas artérias de calibre fino.
Scheinert et al. foram os primeiros a inserir um stent coronário com efeito de droga infrapoplíte em 30 pacientes em 2006. Após seis meses, não foi encontrada uma única estenose recorrente [15]. O ensaio YUKON-BTK randomizou isto para um stent sirolimus-eluting e também encontrou uma superioridade estatisticamente significativa de DES na patência primária (81% vs 56%, p=0,004) [12]. Outros ensaios randomizados publicados sobre o tema incluem o DESTINY [8] e ACHILLES [14], que também consideram esta paternidade primária do DES significativamente melhor do ponto de vista estatístico.
Contudo, no que diz respeito aos importantes parâmetros clínicos da amputação e morte, a tecnologia ainda não traz nenhuma vantagem demonstrável, como Rastan et al. numa análise dos dados agregados de 1039 doentes nos estudos acima referidos [16].
Discussão
Para além dos estudos aleatorizados acima listados, existe toda uma série de dados de registo [2]. A interpretação dos resultados sugere que o revestimento medicamentoso, análogo à angioplastia coronária, é um método promissor no tratamento do PAVK. Evidências crescentes mostram que a taxa de estenose recorrente, e portanto potencialmente reintervenções, pode ser reduzida tanto femoropoplítea como infrapoplítea. No entanto, é prematuro formular um padrão de ouro a partir disto, especialmente porque os estudos aleatórios com os critérios de inclusão nem sempre reflectem as condições diárias regulares. Os resultados dos grandes estudos em curso fornecerão mais informações sobre os potenciais efeitos secundários, sobre a selecção correcta dos pacientes e também sobre a relação custo-benefício (Tab. 3). Este último requer uma atenção especial, pois espera-se que a potencial redução da taxa de reintervenção conduza a uma redução dos custos, como foi demonstrado comparativamente em estudos de cardiologia através da utilização de DES. [17].
Não existem dados prospectivos randomizados sobre pós-tratamento com dupla antiagregação. De acordo com o consenso suíço, a dupla antiagregação é geralmente realizada durante um mês após a implantação da BMS periférica [18]. Devido ao atraso na reendotelização após a implantação do DES/DCB, esta é realizada por um período mais longo, análogo ao da cardiologia. Nos estudos citados, isto foi entre um e seis meses, dependendo da região vascular tratada.
Literatura:
- Norgren L, et al; Grupo de trabalho TASC II: J Vasc Surg 2007; 45 Suppl: S5-67.
- Buechel R, Stirnimann A, Zimmer R, Keo H, Groechenig E: VASA 2012; 41(4): 248-261.
- Scott NA, et al: Circulation 1996; 93(12): 2178-2187.
- Shi Y, et al: Circulation 1996; 94(7): 1655-1664.
- Shi Y, et al: Circulation 1997; 95(12): 2684-2693.
- Sata M, et al: Nat Med 2002; 8(4): 403-409.
- Duda SH, et al: Circulation 2002; 106(12): 1505-1509.
- Duda SH, et al: J Endovasc Ther 2006; 13(6): 701-710.
- Dake MD, et al; em nome do Zilver PTX Investigators: Circ Cardiovasc Intervent 2011; 4(5): 495-504.
- Tepe G, et al: NEJM 2008; 358(7): 689-699.
- Werk M, et al: Circulation 2008; 118(13): 1358-1365.
- Rastan A, et al: Eur Heart J 2011; 32: 2274-2281.
- Bosiers M, et al: J Vasc Surg 2012; 55(2): 390-398.
- Scheinert D, et al; ACHILLES Investigadores: J Am Coll Cardiol 2012; 60(22): 2290-2295.
- Scheinert D, et al: EuroIntervention 2006; 2(2): 169-174.
- Rastan A, Noory E, Zeller T: Vasa 2012; 2: 90-95.
- Filion KB, et al: Am J Cardiol 2009; 103(3): 338-344.
- Jäger K, et al: Schweiz Med Forum 2009; 9(39): 690.
CARDIOVASC 2013; 12(1), 15-19