Vários estudos conduziram recentemente a uma expansão das indicações para a terapia de ressincronização cardíaca. O desejo de evitar eléctrodos intravasculares ligados a um dispositivo subcutâneo levou ao desenvolvimento de CDIs subcutâneos implantáveis e de pacemakers sem sonda, entregues por cateter. Enquanto os primeiros já são utilizados na prática clínica diária após cuidadosa selecção de pacientes, os segundos só são utilizados no contexto de estudos. Estão em curso esforços para desenvolver um sistema completo de duas ou três câmaras sem condutores eléctricos. As complicações da infecção após implantações e mudanças de dispositivos cardíacos são um problema temido. Os envoltórios de dispositivos revestidos com antibióticos são uma abordagem promissora para reduzir a taxa de infecção. Contudo, são necessários mais estudos sobre isto e sobre a administração de antibióticos periintervencionais sistémicos.
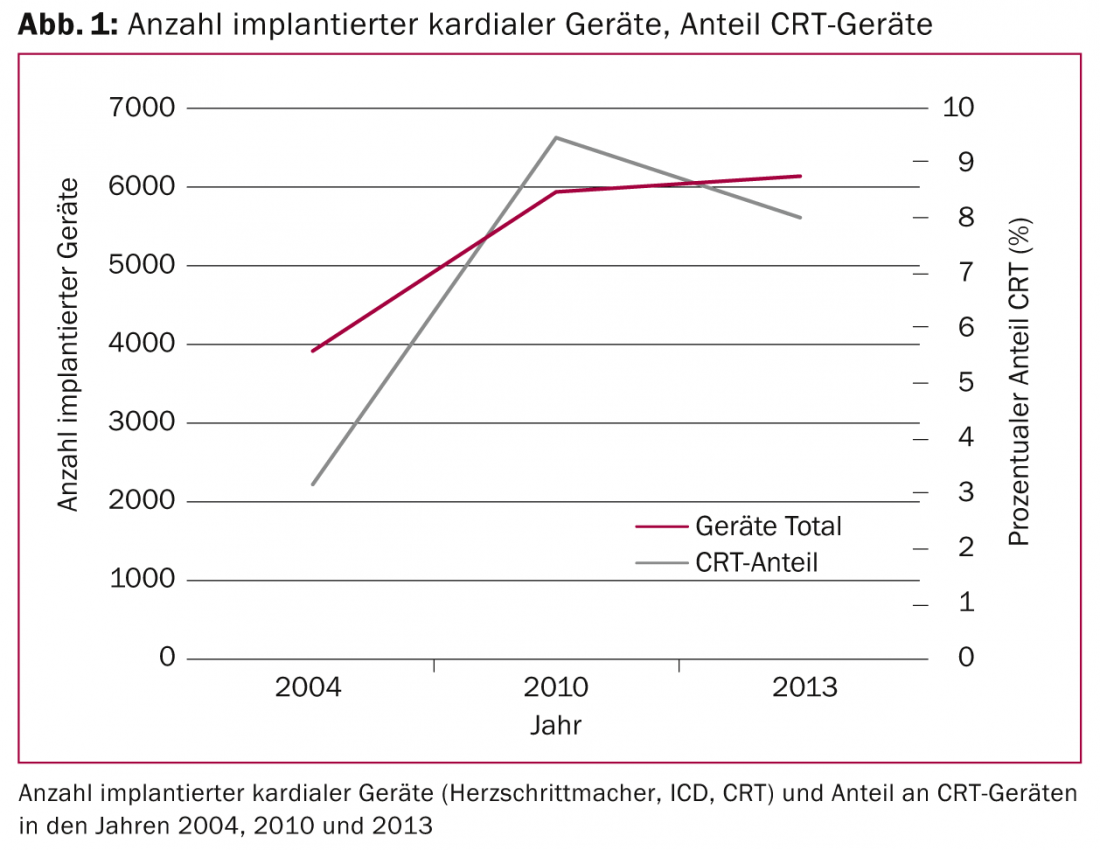
As indicações para a implantação de dispositivos cardíacos (pacemakers convencionais, desfibriladores implantáveis [ICD] e sistemas de pacemakers biventriculares) expandiram-se nos últimos dez anos devido a novas descobertas, especialmente no campo da terapia de ressincronização cardíaca (CRT). Embora pouco menos de 4000 dispositivos cardíacos tenham sido implantados na Suíça em 2004, este número cresceu para uns bons 6000 dispositivos em 2013. A percentagem de dispositivos CRT triplicou entre 2004 e 2010 (Fig. 1) .
Um marco técnico foi a introdução do CDI subcutâneo e a demonstração da viabilidade/segurança da estimulação sem chumbo. No entanto, enquanto estas novas tecnologias só gradualmente vão encontrando o seu caminho na prática clínica de rotina, a realização de exames de RM em pacientes com dispositivos não compatíveis com RM ou a prevenção de infecções por dispositivos são desafios frequentes na prática clínica diária que serão brevemente abordados neste artigo de revisão.
Selecção de doentes para terapia de ressincronização cardíaca
No domínio da CRT, foram realizados e publicados numerosos estudos interessantes nos últimos anos. O estudo de extensão CARE-HF demonstrou uma redução significativa do risco de mortalidade relativa a todas as causas de 40% (redução absoluta de 38,1 para 24,7%) no prazo de três anos com CRT em pacientes com insuficiência cardíaca grave tratada de forma óptima (NYHA III/IV), LVEF ≤35% e um complexo QRS alargado. Em pacientes com insuficiência cardíaca ligeira (NYHA I/II) e uma indicação de CDI profilático primário, a TRC adicional não reduziu o ponto final composto primário no ensaio REVERSE, mas reduziu as hospitalizações relacionadas com insuficiência cardíaca e afectou favoravelmente a geometria ventricular esquerda com um aumento significativo da fracção de ejecção. A mortalidade anual no seguimento de 5 anos recentemente publicado foi surpreendentemente baixa, 2,9%, o que pelo menos parcialmente explica a falta de impacto da terapia neste ponto final em 610 pacientes, incluindo . O ensaio RAFT semelhante comparou a terapia CRT-ICD apenas com a terapia de CDI e encontrou uma redução significativa no ponto final primário da mortalidade por todas as causas e da hospitalização relacionada com insuficiência cardíaca em pacientes com insuficiência cardíaca NYHA II/III. Em conjunto, estes dois documentos sugerem que os pacientes com insuficiência cardíaca mais leve também beneficiam da TRC. Uma expansão adicional da TRC poderia também resultar no futuro dos resultados positivos do estudo recentemente publicado do bloco HF, no qual pacientes com indicação de marcapasso devido a arritmia lenta beneficiaram da TRC em comparação com a terapia convencional de marcapasso, independentemente da sua classe NYHA, se a função da bomba ventricular esquerda fosse inferior a 50%.
O facto de pacientes com uma largura QRS <120 ms poderem ter provas ecocardiográficas de dissincronia e de alguns estudos monocêntricos terem demonstrado um benefício nos sintomas de insuficiência cardíaca da TRC nestes pacientes levou à ideia de alargar o conceito de TRC a pacientes com uma QRS relativamente estreita. No entanto, os dois ensaios randomizados controlados multicêntricos LESSER-EARTH e EchoCRT mostraram não só uma falta de benefício de sobrevivência da TRC em comparação com a terapia de CDI apenas, mas até mesmo um excesso de mortalidade no grupo da TRC (EchoCRT), de modo que a TRC é agora uma contra-indicação em doentes com um QRS <120 ms sem indicação de pacemaker.
O lado negativo das indicações crescentes de CRT é certamente a maior taxa de complicações dos dispositivos CRT em comparação com os dispositivos de CDI. Numa análise multivariável, a implantação de CRT-D foi associada a um risco 2,2 vezes maior de complicações no prazo de 45 dias após a implantação em comparação com a implantação de CDI de câmara única [1], e a implantação de CRT-D é um factor de risco independente para revisões de dispositivos em comparação com a implantação de CDI apenas.
Estimulação Multisite LV
A diminuição da resposta à CRT pode ser observada com cicatrização crescente do LV, cicatrização póstero-lateral ou dissincronia mecânica extrema [2]. As áreas cicatriciais têm propriedades de condução eléctrica desfavoráveis e a estimulação numa área cicatrizada do miocárdio é, portanto, indesejável. Os ensaios TARGET e STARTER mostram que a colocação da sonda-alvo do VE em segmentos do miocárdio tardiamente excitados identificados ecocardiograficamente pode influenciar favoravelmente o prognóstico [2]. As sondas multipolares do VE com múltiplos vectores de estimulação à escolha podem oferecer vantagens a este respeito, uma vez que segmentos miocárdicos viáveis e/ou áreas excitadas tardiamente podem ser especificamente estimulados mesmo após a implantação da sonda (multipolar) do VE através de programação apropriada. Além disso, a possível estimulação frênica pode ser contornada através da alteração do vector de estimulação. As vantagens teóricas são convincentes e resta saber se os poucos dados disponíveis que confirmam este conceito serão também consolidados em estudos de maior envergadura.
pode.
CDI subcutâneo
Os sistemas de CDI transvenosos desenvolvidos nos anos 80 requerem eléctrodos complexos que têm de cumprir tanto as funções de detecção/pacing como as de desfibrilação. Não é, portanto, surpreendente que, apesar das tecnologias inovadoras, estes eléctrodos sejam propensos a defeitos, como o Medtronic SprintFidelis ou os eléctrodos SJM Riata nos mostraram. Num estudo alemão monocêntrico com 990 pacientes com CDI, 15% tiveram problemas de eléctrodos durante o seguimento (mediana de 2,5 anos) [3], 56 defeitos de isolamento, 12 fracturas de eléctrodos e 31% outros problemas como perda de captação, problemas de detecção ou impedância. Embora estes números elevados não tenham podido ser confirmados num estudo multicêntrico em que a taxa de 5 anos de revisões de eléctrodos foi de 2,5% [4], não pode haver dúvida de que a maior fraqueza de um CDI é o eléctrodo. É portanto tentador poder oferecer protecção antitaquicárdica sem as dificuldades associadas ao chumbo transvenoso; esta abordagem foi tornada pelo menos parcialmente possível pela introdução do S-ICD, que não requer um chumbo intravenoso (Fig. 2) .
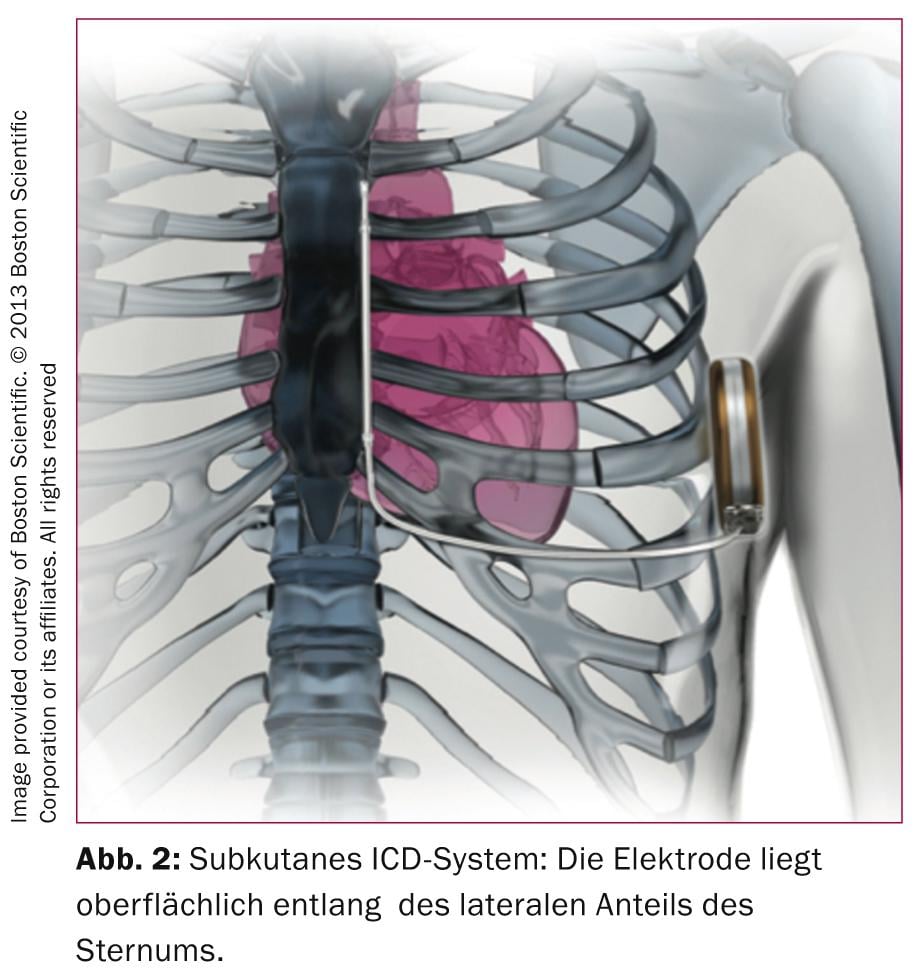
A ausência de um eléctrodo intravascular tem vantagens ao implantar o dispositivo (redução da dose de radiação de raios X) e evita problemas futuros de eléctrodos com extracções de eléctrodos complicadas eventualmente necessárias. A desvantagem do S-ICD é que na ausência de um chumbo de electrografia intracardíaca, a detecção da fibrilação ventricular pode ser difícil, razão pela qual o ECG de superfície deve ser analisado em detalhe antes de implantar um S-ICD. No entanto, de acordo com os dados de registo mais completos publicados até à data [5], a taxa de choques inadequados é de 7%, ou seja, em comparação com os sistemas convencionais de CDI, a taxa de choques injustificados de CDI é bastante baixa [6]. O anti-tachypacing para sobre-estimular a taquicardia ventricular não é possível com sistemas subcutâneos (ou não seria tolerado pelos pacientes), razão pela qual estes sistemas tendem a ser menos utilizados em pacientes com doença arterial coronária ou cardiomiopatia não isquémica e as principais indicações são pacientes com perturbações do canal iónico, cardiomiopatia hipertrófica ou pacientes após infecções do CDI com sistemas transvenais. Finalmente, um pico de corrente mais forte carregando o condensador a 80 J é necessário para terminar a taquicardia/fibrilação ventricular, o que requer um dispositivo maior. Em casos individuais, é portanto necessário pesar criticamente as vantagens e desvantagens antes de se implantar um S-ICD.
Estimulação sem chumbo
Muitas complicações da implantação de dispositivos devem-se ao facto de os eléctrodos terem de ser inseridos e ancorados intravascularmente no coração e estarem sujeitos a stress mecânico constante ao longo da vida do paciente. Portanto, uma forma sem sonda para estimular o coração é muito atractiva. No estudo LEADLESS, o Nanostim™ Leadless Pacemaker System desenvolvido pela Nanostim (adquirido pela St. Jude Medical) foi testado pela primeira vez em 33 pacientes e considerado viável e seguro. A Medtronic desenvolveu um sistema semelhante (Micra™ Transcatheter Pacing System), que também pode ser ancorado no ápice do ventrículo direito através de um cateter orientável a partir da virilha. A bateria deste sistema tem uma vida útil prevista de cerca de oito anos. Estão em curso esforços técnicos para permitir a comunicação entre diferentes pequenos pacemakers colocados no átrio direito e ambos os ventrículos, abrindo o caminho para sistemas de duas e três câmaras sem chumbo. Caso estes sistemas venham a ser amplamente utilizados no futuro , o que estamos convencidos de que o serão, a nossa técnica de implantação sofrerá grandes alterações, uma vez que tais sistemas têm de ser inseridos a partir de inguinal num laboratório de electrofisiologia/ cateterismo cardíaco e os actuais cateteres, que ainda não estão no mercado, têm hoje entre 18 e 23 F de diâmetro. Em mãos inexperientes, isto conduz inevitavelmente a complicações e coloca novos desafios para a logística hospitalar.
Imagens de ressonância magnética em doentes com dispositivos cardíacos
Estima-se que até 75% dos doentes com um pacemaker receberão uma indicação para uma ressonância magnética durante a sua vida. Esta realização é levada em conta por um número crescente de dispositivos compatíveis com MR de diferentes fabricantes, que são frequentemente e implantados com prazer na vida quotidiana. Apesar da crescente popularidade destes dispositivos, o problema de um exame de RM desejado em pacientes com sistemas existentes não capazes de RM surge frequentemente na prática clínica diária. Nestes casos, um exame de ressonância magnética geralmente não é viável. Embora haja provas crescentes de que os exames de RM têm relativamente poucas complicações mesmo nestes pacientes, a FDA dos EUA e os fabricantes de dispositivos consideram todos os CDI e a maioria dos pacemakers como contra-indicações para o exame de RM. No entanto, de acordo com as últimas directrizes ESC [7], após exclusão de pacientes com dispositivos recentemente implantados ou com eléctrodos não ligados (fragmentos), justifica-se um exame de RM em caso de necessidade absoluta (nenhum procedimento alternativo de imagem em fatias) após cuidadosa avaliação do risco/benefício mesmo em pacientes sem dispositivos adequados para RM e pode ser realizado a 1,5 Tesla com baixo risco de complicações, desde que tenha sido feita a preparação adequada.
Redução do risco de infecção durante a implantação do dispositivo
A infecção é provavelmente a complicação mais temida da implantação do dispositivo e está associada a custos económicos elevados e também ao aumento da mortalidade. Os factores de risco de infecções por dispositivos são reintervenções, febre e/ou ausência de profilaxia de infecção antibiótica [8]. Curiosamente, até um terço dos alojamentos ou eléctrodos de CDI são bacterialmente colonizados durante a substituição do CDI [9], o que pode estar relacionado com o aumento do risco de infecção após as reintervenções. O único ensaio controlado aleatório que compara a administração de antibióticos periintervencionais com placebo antes do implante do pacemaker teve de ser interrompido prematuramente após o recrutamento de dois terços dos doentes planeados, devido à vantagem clara da administração de antibióticos [10]. Num estudo de registo prospectivo recentemente publicado, foi demonstrado que a administração adicional de antibióticos no pós-operatório durante quatro dias leva a uma nova redução significativa das infecções por dispositivos, tanto na cirurgia inicial como nas reoperações [11]. Além disso, poucos mas promissores dados estão disponíveis para uma rede antibiótica absorvível recentemente disponível (Fig. 3) [12].

Esta malha, auto-absorvida após nove semanas e revestida com minociclina e rifampicina , conseguiu reduzir significativamente a taxa de infecção de 3 para 0,9% numa população de doentes seleccionada em comparação com um controlo histórico e é particularmente eficaz em doentes com elevado risco de infecção [12]. São necessários mais estudos e em curso (estudo CITADEL/CENTURION).
Perspectivas
As inovações técnicas mostram o esforço crescente para se afastar dos eléctrodos transcutaneamente inseridos, seja o CDI subcutâneo ou a estimulação sem sonda. Uma vez que ainda faltam grandes números de implantação e os dados dos parâmetros devem primeiro confirmar os resultados preliminares promissores, resta saber se e com que rapidez estas novas tecnologias irão encontrar o seu caminho para a utilização clínica diária. Relativamente à redução das taxas de infecção, especialmente após a mudança de tachyidevices, precisamos urgentemente de novos estudos que investiguem a administração de antibióticos peri- e pós-operatória. Foram publicadas provas retrospectivas de antibiose prolongada, e os dados positivos dos envoltórios embebidos em antibióticos apoiam o conceito de antibiose prolongada para prevenir a infecção.
Dr. med. Dr. scient. Roman Brenner, MD
David Altmann, MD
Prof. Dr. med. Peter Ammann
Literatura:
- Lee DS, et al: Avaliação de complicações precoces relacionadas com o implante do cardioversor desfibrilador De Novo a partir da base de dados do CDI de Ontário. J Am Coll Cardiol 2010; 55(8): 774-782.
- Leyva F, Nisam S, Auricchio A: 20 anos de terapia de ressincronização cardíaca. J Am Coll Cardiol 2014; 64(10): 1047-1058.
- Kleemann T, et al: Taxa anual de defeitos de chumbo de desfibrilação transvenosa em cardioversores-desfibriladores implantáveis durante um período de >10 anos. Circulação 2007; 115(19): 2474-2480.
- Eckstein J, et al: Necessidade de revisão cirúrgica de chumbo desfibrilador implantado a longo prazo: causas e gestão. Circulação 2008; 117(21): 2727-2733.
- Lambiase PD, et al: Experiência mundial com um desfibrilador implantável totalmente subcutâneo: resultados iniciais do registo EFFORTLESS S-ICD. Eur Heart J 2014; 35(25): 1657-1665.
- Poole JE, Gold MR: Quem deve receber o desfibrilador implantado subcutâneo?: O cardioversor desfibrilador implantável subcutâneo (CDI) deve ser considerado em todos os pacientes com CDI que não necessitem de estimulação. Circ Arrhythm Electrophysiol 2013; 6(6): 1236-1244; discussão 1244-1245.
- Brignole M, et al.: 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Desenvolvido em colaboração com a Associação Europeia do Ritmo Cardíaco (EHRA). Eur Heart J 2013; 34(29): 2281-2329.
- Klug D, et al: Factores de risco relacionados com infecções de pacemakers implantados e cardioversores-desfibrilhadores: resultados de um grande estudo prospectivo. Circulação 2007; 116(12): 1349-1355.
- Kleemann T, et al: Prevalência de colonização bacteriana de bolsas geradoras em pacientes com cardioversor desfibrilador implantável sem sinais de infecção submetidos a substituição de gerador ou revisão de chumbo. Europace 2010; 12(1): 58-63.
- De Oliveira JC, et al: Eficácia da profilaxia antibiótica antes do implante de marcapassos e cardioversores-desfibriladores: resultados de um ensaio grande, prospectivo, aleatório, duplo-cego, controlado por placebo. Circ Arrhythm Electrophysiol 2009; 2(1): 29-34.
- Senaratne JM, et al: Um estudo de 19 anos sobre infecções relacionadas com pacemaker: uma reivindicação para a utilização de antibióticos pós-operatórios. Pacing Clin Electrophysiol 2014; 37(8): 947-954.
- Mittal S, et al: Infecções por dispositivos electrónicos implantáveis cardíacos: incidência, factores de risco, e o efeito do envelope antibacteriano AigisRx. Ritmo cardíaco 2014; 11(4): 595-601.
CARDIOVASC 2015; 14(1): 17-20