As neoplasias mieloproliferativas clássicas (NMP) incluem policitemia vera, trombocitémia essencial e mielofibrose primária. Várias sessões no Congresso da EHA em meados de Junho abordaram a revisão das directrizes, notícias sobre a inibição JAK e o impacto prognóstico das mutações do condutor.
(ag) Ruben Mesa, MD, Arizona, falou sobre o actual diagnóstico de policitemia vera (PV): “Esta é uma doença heterogénea de células estaminais principalmente associada a um aumento dos glóbulos vermelhos. Como resultado, podem ocorrer eventos tromboembólicos. Há um risco de transição para mielofibrose ou leucemia aguda. A revisão dos critérios de diagnóstico da OMS proposta este ano [1] inclui três critérios ditos maiores e um menor. Para um diagnóstico de PV, devem ser preenchidos os três ou os dois primeiros critérios principais mais um critério menor”.
Os principais critérios incluem
- Valores de hemoglobina de >16,5 g/dl (homens) e
- >16 g/dl (mulheres) ou um hematócrito de > 49% (homens) e > 48% (mulheres)
- Descobertas de medula óssea compatíveis com os critérios da OMS com megacariócitos pleomórficos.
- Presença de uma mutação JAK2.
O critério menor listado na revisão é o nível sérico subnormal de eritropoietina. “Assim, os critérios de diagnóstico da PV estão em desenvolvimento. Propõe-se baixar o limiar de hemoglobina e acrescentar hematócrito como critério principal. Em última análise, isto conduzirá a uma simplificação. No entanto, é necessária uma biopsia à medula óssea”, concluiu Mesa.
“PV “mascarado
A influência da morfologia da medula óssea como instrumento de diagnóstico é também discutida na revisão das directrizes da OMS para a chamada PV “mascarada”, pois permite uma elevada reprodutibilidade do diagnóstico mesmo em casos que não atingem os limiares anteriores de hemoglobina e hematócrito. Isto é significativo porque a sobrevivência global em pacientes com PV “mascarada” parece ser pior do que a de pacientes com PV explícita (se os factores de risco independentes da idade > 65 anos e contagem de leucócitos >15× 109 / l forem incluídos). Sem estes dois factores de risco, as taxas de sobrevivência dos dois grupos são comparáveis, o que, segundo os autores, indica que alguns dos doentes que se encontram abaixo dos limiares anteriormente exigidos pelas directrizes da OMS devem ser considerados como doentes com PV aparente [2,3].
Prognóstico e sobrevivência em MPN
Quais são as mutações na mielofibrose primária (PMF) e na PV? Esta questão foi colocada pelo Prof. Alessandro Vannucchi, Florença. Em PV, aproximadamente 95% das mutações fenotípicas do condutor pertencem ao tipo JAK2-V617F e 4% ao tipo JAK2-Exon12. Em PMF, existem aproximadamente 60% JAK2-V617F, 20% CALR, 8% MPL-W515 e 10% as chamadas mutações “triplo-negativas”.
Segundo o Prof. Vannucchi, o prognóstico em PMF é influenciado por estas mutações fenotípicas do condutor na medida em que as mutações CALR mostram um melhor resultado de sobrevivência do que as mutações JAK2, MPL e “triple negative”.
Haifa Kathrin Al-Ali, MD, Leipzig, entrou em mais pormenores sobre prognóstico e sobrevivência em casos de NMP: “É evidente que a mielofibrose traz consigo a pior sobrevivência de todas as NMP: Enquanto de acordo com um estudo sueco [4] os doentes com trombocitemia essencial (ET) mostram uma sobrevida de 10 anos reduzida em 17% em comparação com a população normal, os doentes afectados por PV mostram uma sobrevida de 28% e os doentes com PMF um total de 81% pioraram a sobrevida. Para avaliar o risco de morte e trombose na MPN, estão disponíveis vários instrumentos de prognóstico, tais como as chamadas escalas Lille, IPSS, DIPSS e DIPSS Plus”.
Em relação à mielofibrose, existe apenas uma opção terapêutica curativa: o transplante alogénico de células estaminais hematopoiéticas. No entanto, o resultado após o transplante depende da classificação inicial na escala DIPSS [5].
Os dois ensaios COMFORT também mostraram que o ruxolitinib melhorou a sobrevivência a longo prazo em doentes MF (em comparação com placebo [6] e a melhor terapia disponível [7,8]). De acordo com estudos exploratórios, a utilização deste agente durante cinco anos poderia atrasar ou mesmo inverter a fibrose da medula óssea (isto novamente em comparação com a melhor terapia disponível) [9]. “É possível, então, que a inibição sustentada de JAK1&2 modifique a doença”, sugeriu o Dr. Al-Ali.
No campo da PV, os pacientes resistentes à hidroxiureia são particularmente afectados por uma elevada mortalidade. Estudos falam de um risco de morte 5,6 vezes maior em comparação com a população não-resistente. Segundo o Dr. Al-Ali, são urgentemente necessárias novas opções terapêuticas aqui: “O papel do ruxolitinib foi testado no ensaio RESPONSE. Os resultados são encorajadores em termos do parâmetro primário (controlo do número de glóbulos vermelhos e redução do volume do baço) e também em termos de menor carga de sintomas em comparação com a melhor terapia disponível [10]” .
O que se segue?
Claire Harrison, MD, Londres, descreveu o diagnóstico exacto como a pedra angular das terapias actualmente possíveis para NMP: “Em princípio, a aspirina de baixa dose apenas mostra boas provas na área da PV, mas não para PMF e ET. No entanto, é também utilizado como padrão na ET (excepto em doentes de alto risco). A consolidação da situação do estudo é urgentemente necessária aqui”. Além disso, todos os factores de risco vascular reversível precisam de ser tratados de forma agressiva. Deixar de fumar é fundamental.
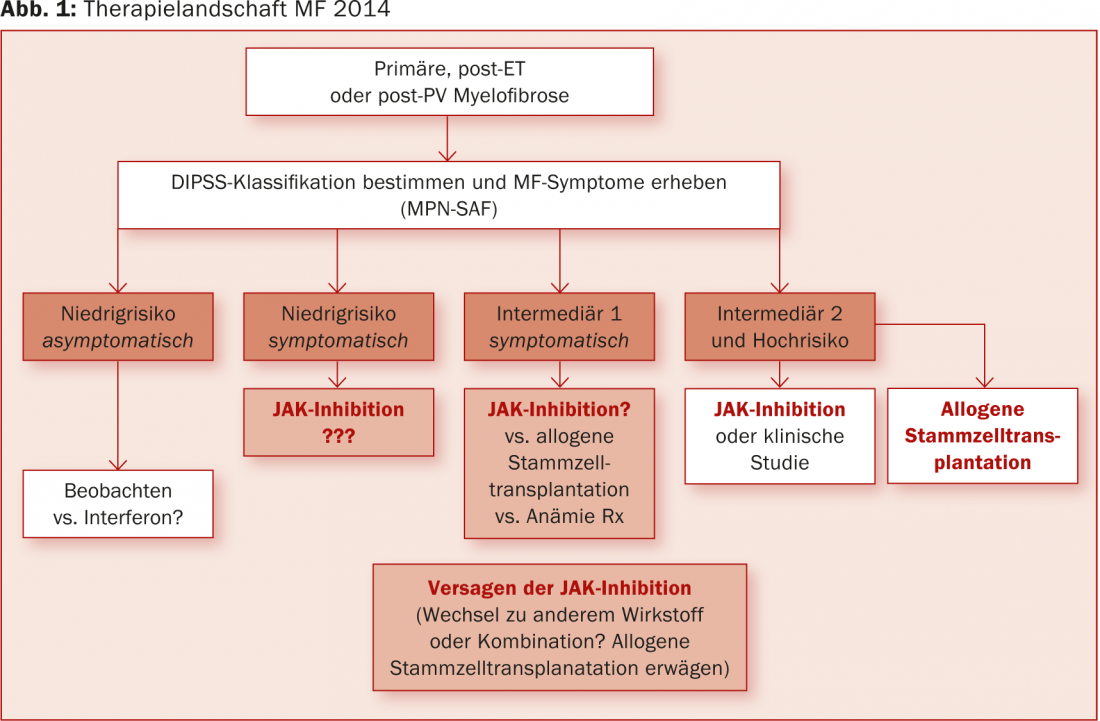
“Os inibidores JAK estão actualmente a mudar fundamentalmente o panorama terapêutico do MF. Está a surgir uma vantagem de sobrevivência a longo prazo sobre a melhor terapia disponível (actualização de 3,5 anos no Congresso da EHA de 2014 [8]). No entanto, é necessário primeiro examinar cuidadosamente se também podem ser considerados como agentes terapêuticos em pacientes com menor risco no futuro (Fig. 1)“.
O Dr. Harrison também abordou a possibilidade de modificação da doença através da utilização de ruxolitinibe: “Entre outras coisas, um relatório de caso [11] levantou sobrancelhas, no qual foi observada uma resolução completa da fibrose da medula óssea num doente MF (pós-PV) após três anos de inibição JAK1&2”.
Fonte: Congresso da EHA 2014, 12-15 de Junho de 2014, Milão
Literatura:
- Barbui T, et al: Repensar os critérios de diagnóstico da policitemia vera. Leucemia 2014 Jun; 28(6): 1191-1195.
- Barbui T, et al: Policitemia vera mascarada diagnosticada de acordo com a classificação da OMS e BCSH. Am J Hematol 2014 Fev; 89(2): 199-202.
- Barbui T, et al: Mascarada policitemia vera (mPV): resultados de um estudo internacional. Am J Hematol 2014 Jan; 89(1): 52-54.
- Hultcrantz M, et al: Patterns of survival among patients with myeloproliferative neoplasms diagnosed in Sweden from 1973 to 2008: um estudo baseado na população. J Clin Oncol 2012 Ago 20; 30(24): 2995-3001.
- Scott BL, et al: The Dynamic International Prognostic Scoring System for myelofibrosis prediz resultados após transplante de células hematopoiéticas. Sangue 2012 Mar 15; 119(11): 2657-2664.
- Verstovsek S, et al.: Long-Term Outcomes Of Ruxolitinib Therapy In Patients With Myelofibrosis: 3-Year Update From COMFORT-I. Sangue 2013; 122(21): 396.
- Cervantes F, et al: Resultados de três anos de eficácia, segurança e sobrevivência do COMFORT-II, um estudo de fase 3 comparando o ruxolitinibe com a melhor terapia disponível para a mielofibrose. Sangue 2013 Dez 12; 122(25): 4047-4053.
- Harrison C, et al: Resultados de uma actualização de 3,5 anos do COMFORT-II, um estudo de fase 3 comparando ruxolitinibe (rux) com a melhor terapia disponível (morcego) para o tratamento da mielofibrose. EHA 2014 #Abstract P403.
- Kvasnicka HM, et al: Effects Of Five-Years Of Ruxolitinib Therapy On Bone Marrow Morphology In Patients With Myelofibrosis And Comparison With Best Available Therapy. Sangue 2013; 122(21): 4055.
- Vannucchi A: Ruxolitinibe revela-se superior à melhor terapia disponível num estudo prospectivo, randomizado, fase 3 (resposta) em doentes com policitemia vera resistente a ou intolerante à hidroxiureia. EHA 2014 #Abstract LB2436.
- Wilkins BS, et al: Resolução da fibrose da medula óssea num doente que recebe tratamento inibidor de JAK1/JAK2 com ruxolitinibe. Haematologica 2013 Dez; 98(12): 1872-1876.
ESPECIAL KONRESS 2014; 2(5): 43-44