Se o tumor for primeiro diagnosticado durante a gravidez, existem procedimentos terapêuticos estabelecidos para o segundo e terceiro trimestres. Se a gravidez ocorrer após a terapia tumoral, é necessária uma monitorização cuidadosa. Partos prematuros iminentes e retardamento do crescimento fetal podem assim ser detectados numa fase precoce.
Na Suíça, mais de 38.500 pessoas são diagnosticadas com cancro todos os anos. 13% dos tumores ocorrem antes dos 50 anos de idade, ou seja, na sua maioria durante a fase fértil da vida. Todos os anos, cerca de 190 novos casos são registados em crianças. As mais comuns são leucemias (34%), tumores do sistema nervoso central (21%) e linfomas (11%). As hipóteses de cura melhoraram consideravelmente e atingem agora 80% [1].
As terapias citotóxicas (radio e quimioterapias) podem perturbar temporária ou definitivamente as funções testiculares e ovarianas. A extensão do dano gonadal depende do tipo e intensidade do tratamento, bem como de factores individuais tais como a idade biológica. Devido ao aumento das taxas de sobrevivência, cada vez mais pacientes são confrontados com consequências a longo prazo da quimioterapia ou radioterapia. Uma vez que as gónadas (ovários e testículos) são particularmente sensíveis a tais exposições, a questão dos efeitos sobre a gravidez também surge frequentemente.
Por outro lado, as estatísticas mostram que os pais são significativamente mais velhos quando nasce o seu primeiro filho do que eram há décadas atrás. Estamos, portanto, a deparar-nos cada vez mais com o problema de o planeamento familiar ainda não ter sido concluído na altura do diagnóstico ou tratamento do cancro. Por conseguinte, a frequência dos diagnósticos tumorais na gravidez também está a aumentar, com uma prevalência de um a dois casos por 1000 gravidezes [2].
Fertilidade feminina após terapia oncológica
Os tratamentos oncológicos podem incluir medidas cirúrgicas, radioterapia, quimioterapia, procedimentos endocrinológicos ou imunológicos, dependendo do tipo de tumor.
As considerações sobre a influência das terapias oncológicas num desejo posterior de ter filhos centram-se geralmente nas restrições da função gonadal, mas os efeitos sobre o útero, bem como as doenças maternas concomitantes, devem também ser tidos em conta. A radioterapia, por exemplo, pode causar fibrose, o que impede o desenvolvimento fetal atempado até à data de entrega prevista. A radioterapia do abdómen ou da pélvis pode aumentar o risco de aborto espontâneo por um factor de 1,5 a 2. Para além dos danos directos no endométrio, a fibrose do miométrio ou dos vasos sanguíneos fornecedores é discutida como uma causa possível [3].
A terapia tumoral também pode reduzir a resistência do organismo da mãe numa gravidez posterior, por exemplo diminuindo a função do coração, rins ou pulmões. Se, por exemplo, a terapia com antraciclinas leva à cardiomiopatia, a função circulatória materna é prejudicada durante a gravidez [4].
Se os ovários, útero ou testículos forem afectados por tumores, a remoção cirúrgica dos órgãos conduz inevitavelmente à perda de fertilidade. Nestes casos, apenas a doação de óvulos ou esperma, a substituição ou a adopção podem satisfazer o desejo de ter um filho.
A quimioterapia ou radioterapia pode afectar as gónadas ao destruir os folículos primordiais nos ovários ou a espermatogónia nos testículos. A toxicidade da quimioterapia é determinada pela substância activa, dose, forma de aplicação e combinação. A extensão da gonadotoxicidade está relacionada com a doença, idade, sexo e fertilidade antes da terapia tumoral. Também é possível danificar o eixo hipotálamo-hipófisico. O efeito local da radioterapia depende do campo de irradiação, da dose de radiação e do fraccionamento.
Os tratamentos endócrinos – como frequentemente utilizados para o carcinoma da mama – têm um impacto na função ovariana e no endométrio [5].
Até agora, quase não existem dados sobre os efeitos da imunoterapia na fertilidade [6].
Os medicamentos citostáticos são prejudiciais para as gónadas de diferentes formas. Se o planeamento familiar não tiver sido concluído, devem ser evitados fármacos citostáticos fortemente gonadotóxicos (tab. 1). Os medicamentos citostáticos com baixo risco de danos nos ovários incluem metotrexato, 5-fluorouracil, vincristina, vinblastina, bleomicina e actinomicina. O risco de amenorreia permanente varia muito consoante os diferentes regimes.
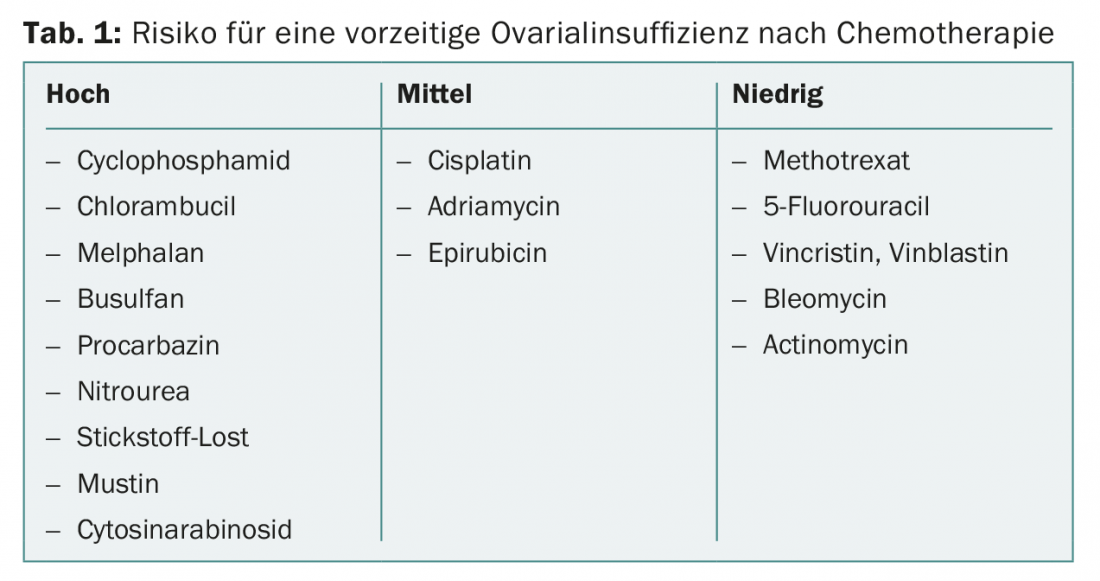
Os tratamentos que têm pelo menos 80% de probabilidade de causar amenorreia persistente ou azoospermia são considerados severamente gonadotóxicos. Estes incluem, por exemplo, a irradiação total do corpo como parte de um transplante de células estaminais. Nas mulheres com mais de 40 anos, pode esperar-se que a menopausa ocorra dentro de um ano em 40-100% após a quimioterapia com ciclofosfamida [7].
As terapias que levam à amenorreia em 40-60% dos casos são consideradas moderadamente gonadotóxicas. Isto inclui, por exemplo, a quimioterapia adjuvante para o cancro da mama em mulheres entre os 30 e 39 anos ou a quimioterapia de segunda linha para a doença de Hodgkin .
A quimioterapia de primeira linha de acordo com o regime ABVD para a doença de Hodgkin ( ), por exemplo, tem uma baixa gonadotoxicidade. 45% das mulheres com uma idade média de 26 anos e 53% dos homens com uma idade média de 28 anos conseguiram uma gravidez após a quimioterapia ABVD [8].
O número de folículos primordiais presentes ao nascimento diminui continuamente no organismo feminino até à menopausa. Este processo é acelerado por terapias citotóxicas, de modo que a perda da função ovárica ocorre mais cedo. Os sobreviventes a longo prazo de tumores malignos na infância chegam à menopausa muito mais cedo do que as suas irmãs e não devem, portanto, satisfazer um desejo existente de ter filhos demasiado tarde.
A probabilidade de perda completa da função ovárica aumenta com a idade. As mulheres com mais de 40 anos de idade têm uma reserva menor de oócitos, pelo que já se deve esperar uma perda permanente da sua função com radioterapia com doses entre 5 e 6 Gy. As mulheres mais jovens, por outro lado, podem ser capazes de tolerar até 20 Gy. A radioterapia para a pélvis na infância ou adolescência pode levar à redução do volume uterino, à redução da espessura endometrial ou à perda de elasticidade dos músculos uterinos.
A insuficiência ovariana aguda ocorreu em 215 (6,3%) de 3390 pacientes no Estudo de Sobrevivência do Cancro Infantil (CCSS) nos EUA [9]. Entre as 5149 mulheres sobreviventes com idades entre os 15-44 anos, a taxa de gravidez foi 19% mais baixa em comparação com os irmãos não afectados (RR 0,81; 95% CI 0,73-0,90).
Os ciclos irregulares indicam frequentemente um início precoce da menopausa. A baixa AMH (hormona anti-Müllerian) ou inibição B, bem como a elevada FSH no terceiro dia do ciclo e a falta de evidência sonográfica de folículos maduros indicam uma desordem da função ovariana e são adequados como critérios de diagnóstico.
Fertilidade masculina após terapia tumoral
Nos homens, a oligospermia temporária pode ocorrer mesmo com doses de radiação de 0,1 Gy. Doses mais elevadas levam frequentemente a uma interrupção completa da produção de esperma. No entanto, por vezes registou-se um retorno da fertilidade após anos. Doses de radiação superiores a 6 Gy causam frequentemente infertilidade permanente. Os dados sobre o nível de doses de radiação em caso de perda de fertilidade variam consideravelmente na literatura [10].
30% das terapias tumorais infantis levam a efeitos gonadotóxicos em rapazes com infertilidade permanente [11]. A extensão e duração dos danos dependem do medicamento citostático administrado e da dose total. Em particular, os alquilantes como o busulfan, cisplatina, ciclofosfamida, ifosfamida e procarbazina são conhecidos por causar infertilidade prolongada [12]. A maioria das quimioterapias na infância consiste em combinações de vários fármacos citostáticos, em que os efeitos sinérgicos podem levar à infertilidade mesmo em doses mais baixas das substâncias activas individuais.
Para além de espermiogramas patológicos, a baixa inibição B e FSH elevada atestam a extensão da fertilidade masculina prejudicada.
Protecção da fertilidade
Se forem necessárias terapias gonadotóxicas em doentes em idade fértil, hoje em dia deve ser fornecida uma explicação detalhada das opções para as medidas de conservação de fertilização.
As medidas de medicina reprodutiva com criopreservação de óvulos e espermatozóides devem, portanto, ser discutidas como parte do conceito terapêutico. Embora não haja problemas com o esperma, existem alguns problemas críticos com a criopreservação de embriões fertilizados após a fertilização in vitro: A estimulação hormonal do ovário para obter ovócitos não só atrasa a quimioterapia, como também pode possivelmente estimular o crescimento de tumores em tumores receptores de hormonas positivas.
Se o tratamento tumoral levou à azoospermia, o esperma pode também ser extraído cirurgicamente do tecido testicular usando a extracção de esperma testicular (TESE).
As medidas de preservação da fertilidade nas mulheres, por outro lado, são muito mais complicadas e encontram-se, em parte, apenas na fase experimental.
O benefício de proteger o ovário através da “imobilização” do eixo pituitário-ovariano durante a quimioterapia utilizando agonistas da LHRH é controverso [13].
O tratamento de estimulação ovariana para obtenção de oócitos e criopreservação de oócitos fertilizados são procedimentos de rotina estabelecidos no contexto da fertilização in vitro. Em centros especializados em medicina reprodutiva, é também realizada a criopreservação de ovos não fertilizados. O estímulo ovariano para obter oócitos pode ser realizado em mulheres pós-pubertal até à idade de cerca de 40 anos. A probabilidade de gravidez após criopreservação dos ovos fertilizados antes da terapia citotóxica é estimada em 40% em doentes entre os 18-25 anos, cerca de 35% aos 26-30 anos, cerca de 30% aos 31-35 anos e cerca de 25% aos 36-40 anos; estes números são taxas de gravidez cumulativas após vários ciclos de descongelação [14].
Em contraste, a remoção laparoscópica e a criopreservação do tecido ovariano é ainda uma técnica experimental para a preservação da fertilidade. As mulheres jovens com uma elevada reserva ovariana são particularmente adequadas para tal. No entanto, ao transplantar tecido ovariano, o risco potencial de transmissão de células malignas também deve ser considerado [15].
No caso da irradiação terapêutica da pélvis, a transposição cirúrgica dos ovários (ooforopexia) é uma opção para remover o tecido ovariano do campo de radiação imediata.
Taxas de gravidez após o diagnóstico de tumores
Existe frequentemente incerteza sobre o intervalo de tempo necessário entre o fim da quimioterapia e o início da gravidez. É frequentemente aconselhado um intervalo de dois anos após a conclusão da terapia tumoral, especialmente porque o risco de recidiva é maior pouco tempo após a terapia tumoral no caso de tumores agressivos.
Entre os antigos doentes oncológicos pediátricos com uma idade média de cerca de 24 anos, a taxa de fertilidade era de 77% em comparação com 90% na população geral com idade igualada. Neste contexto, os afectados expressaram receios de que a criança também pudesse desenvolver cancro ou que a sua própria doença pudesse voltar a aparecer [16].
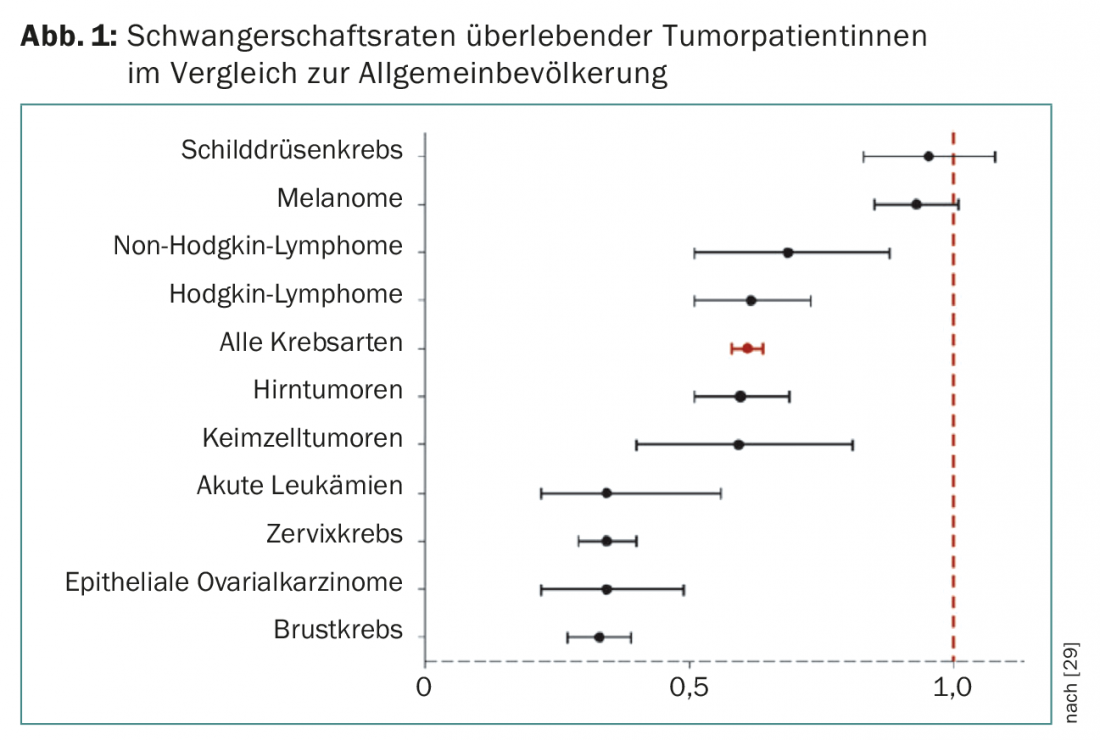
As taxas de gravidez de pacientes com tumores tratados com sucesso são, dependendo do tipo de tumor (Fig. 1) , significativamente inferiores aos dados da população geral comparável [17].
Prognóstico tumoral após a gravidez
Dependendo do tipo de tumor, as pessoas afectadas por vezes também estão preocupadas com a medida em que a gravidez pode piorar o prognóstico da doença materna subjacente. Obviamente, porém, uma gravidez posterior não tem qualquer influência negativa sobre o prognóstico. O mesmo se aplica aos tumores dependentes de hormonas, tais como o carcinoma da mama [18]. Num estudo recente, não foi observada qualquer diferença na sobrevivência sem doença em 333 doentes com cancro da mama receptor de estrogénio positivo e subsequente gravidez num seguimento de 7,2 anos, em comparação com uma população de controlo sem gravidez [19]. Uma meta-análise de 14 estudos sobre o prognóstico do carcinoma da mama mostrou uma taxa de mortalidade 41% mais baixa após o início da gravidez em comparação com as pacientes com cancro da mama sem gravidez [20]. No entanto, isto pode também dever-se ao facto de os pacientes com um bom prognóstico após a terapia tumoral terem mais probabilidades de ter a coragem de realizar o seu desejo de ter um filho.
Efeitos da terapia oncológica sobre a descendência
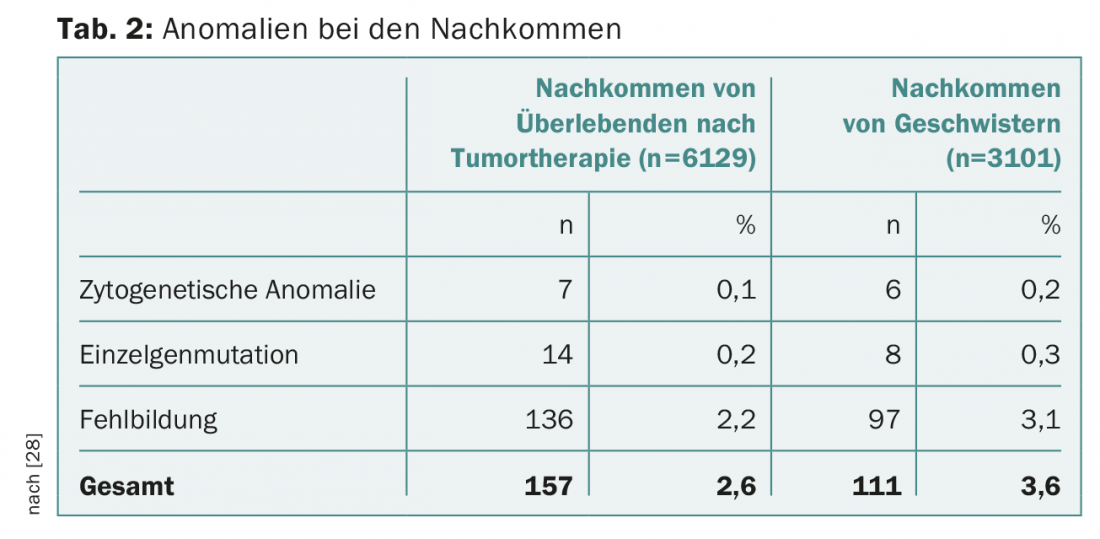
Após a terapia tumoral, os futuros pais são muitas vezes sobrecarregados por questões sobre possíveis danos para os seus descendentes. O risco de malformação das crianças não é aumentado após a quimioterapia parental, de acordo com os conhecimentos actuais. O seguimento de mais de 4000 gravidezes após a quimioterapia materna não mostrou qualquer aumento na taxa de malformações fetais [21]. A base de dados do Instituto Nacional Americano do Cancro contém mais de 10.000 pacientes com tumores malignos na infância ou adolescência que foram tratados entre 1970 e 1986. Um peso de nascimento abaixo do décimo percentil foi registado significativamente mais frequentemente, 18,2% vs. 7,8% (OU 4,0; 95% CI 1,6-9,8; p=0,003), especialmente após radioterapia uterina acima de 5 Gy [22]. No entanto, não houve aumento de anomalias de órgãos congénitos, síndromes citogenéticas ou defeitos genéticos na descendência (Tab. 2).
Um estudo de coorte retrospectivo com dados dos registos de cancro e nascimento de quatro regiões dos EUA analisou a descendência de 1898 doentes com tumores com um primeiro diagnóstico antes dos 20 anos (período: 1973-2000) em comparação com um grupo de controlo não afectado (n=14 278). Houve um aumento significativo de nascimentos prematuros (RR 1,54; 95% CI 1,30-1,83) e descendentes com um peso inferior a 2500 g (RR 1,31; 95% CI 1,10-1,57). No entanto, não foi observado aqui qualquer aumento nas taxas de malformação, morte fetal intra-uterina ou aberrações cromossómicas na descendência [23]. Uma avaliação correspondente das gravidezes de pacientes com tumores masculinos sobreviventes (n=470) não mostrou aumento de nascimentos prematuros, atraso no crescimento, taxas de malformação ou aberrações cromossómicas [24].
Uma revisão recente analisa o resultado reprodutivo após uma terapia bem sucedida para a leucemia e linfoma infantil e adolescente, incluindo 18 estudos relevantes [3]: Nenhum aumento de abortos espontâneos, diabetes ou anemia materna, nados-mortos, malformações fetais ou tumores na descendência foi encontrado nos sobreviventes a longo prazo. Contudo, a taxa de nascimentos vivos era mais baixa em comparação com uma população de controlo não exposta, enquanto os nascimentos prematuros e o baixo peso à nascença eram mais frequentes.
Terapia tumoral durante a gravidez
Se um tumor for diagnosticado pela primeira vez durante a gravidez, existem procedimentos terapêuticos que são toleráveis tanto para a mãe como para o feto. Ao escolher o tratamento, o bem-estar materno e fetal devem ser ponderados um contra o outro.
O carcinoma da mama, carcinoma cervical, malignidades hematológicas e melanomas são responsáveis por 70% de todos os diagnósticos de tumores na gravidez [25].
O início da terapia sistémica na gravidez depende da fase do tumor, da idade gestacional, do tipo de tumor, do benefício esperado e dos riscos a temer. Uma vez que os medicamentos citostáticos podem prejudicar a organogénese, há um risco de 10-20% de malformações durante a quimioterapia no primeiro trimestre. Em contraste, a taxa de aborto com a aplicação de medicamentos citostáticos no segundo e terceiro trimestres corresponde ao risco básico geral de 3-5% [26]. A maior experiência em gravidez está disponível para o carcinoma da mama: Os regimes terapêuticos com antraciclinas como a FEC (5-fluorouracil, epirubicina, ciclofosfamida) ou a FAC (5-fluorouracil, doxorubicina, ciclofosfamida) têm dado boas provas [27]. Os taxanos e compostos de platina também podem ser utilizados na gravidez.
Para as imunoterapias, ainda faltam actualmente provas suficientes na gravidez. A terapia hormonal deve ser evitada durante a gravidez. Em termos de resultados da gravidez, está a emergir um aumento moderado de nascimentos prematuros e restrições de crescimento.
Literatura:
- Instituto Federal de Estatística (FSO): Relatório Suíço sobre o Cancro 2015. Estado e evolução. Neuchâtel 2016.
- Eibye S, Kjaer SK, Mellemkjaer L: Incidência de cancro associado à gravidez na Dinamarca 1997-2006. Obsteto Gynecol 2013; 122: 608-617.
- Shliakhtsitsava K, et al: Gravidez e resultados de saúde infantil em doentes pediátricos e jovens adultos sobreviventes de leucemia e linfoma: uma revisão sistemática. Linfoma de Leuk 2018; 59(2): 381-397.
- Kort JD, et al: Questões de fertilidade na sobrevivência do cancro. CA Cancer J Clin 2014 Mar-Abr; 64(2): 118-134.
- Lambertini M, et al: Cancer and fertility preservation: international recommendations from an expert meeting. BMC Med 2016; 14: 1.
- Balachandren N, Davies M: Fertilidade, reserva ovárica e cancro. Maturitas 2017; 105: 64-68.
- Gadducci A, Cosio S, Genazzani AR: Função ovárica e problemas de gravidez nos sobreviventes do cancro da mama. Gynecol Endocrinol 2007; 23(11): 625-631.
- Boltezar L, Pintarić K, Jezeršek Novaković B: Fertilidade em doentes jovens após tratamento do linfoma de Hodgkin: um único inquérito central. J Assist Reprod Genet 2016; 33(3): 325-333.
- Metzger ML, et al: Saúde reprodutiva feminina após a infância, adolescentes, e jovens cancros adultos: directrizes para a avaliação e gestão de complicações reprodutivas femininas. J Clin Oncol 2013; 31(9): 1239-1247.
- Bruhn C: Gravidez após ou durante o cancro. Dtsch Med Wochenschr 2014; 139: 1146-1147.
- Green DM, et al: Fertility of male survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. J Clin Oncol 2010; 28(2): 332-339.
- Ginsberg JP: Documento educativo: o efeito da terapia do cancro na fertilidade, a avaliação da fertilidade e as opções de preservação da fertilidade para pacientes pediátricos. Eur J Pediatr 2011; 170(6): 703-708.
- Senra JC, et al: Agonistas hormonais libertadores de Gonadotropina para a protecção dos ovários durante a quimioterapia do cancro: revisão sistemática e meta-análise. Ultrasound Obstet Gynecol 2017 Oct 21. DOI: 10.1002/uog.18934 [Epub ahead of print].
- Wunder C, et al.: Recomendações suíças sobre a preservação da fertilidade para pacientes em idade fértil antes das terapias citotóxicas. Schweiz Med Forum 2012; 37: 708-709.
- American Society for Reproductive Medicine, Practice Committee: Ovarian tissue cryopreservation: a committee opinion. Fertil Steril 2014; 101(5): 1237-1243.
- Reinmuth S, et al: Ter filhos depois de sobreviver ao cancro na infância ou adolescência – resultados de um inquérito de Berlim. Clin Padiatr 2008; 220: 159-165.
- Stensheim H, et al: Gravidez após o cancro adolescente e adulto: um estudo de coorte baseado na população. Int J Cancer 2011; 129: 1225-1236.
- Partridge AH, Ruddy KJ: Fertilidade e tratamento adjuvante em mulheres jovens com cancro da mama. Peito 2007; 16(Suppl 2): S175-181.
- Lambertini M, et al: Long-term Safety of Pregnancy Following Breast Cancer Following Breast Cancer According to Estrogen Receptor Status. J Natl Cancer Inst 2017 Oct 26. DOI: 10.1093/jnci/djx206 [Epub ahead of print].
- Azim HA Jr, et al: Segurança da gravidez após diagnóstico de cancro da mama: uma meta-análise de 14 estudos. Eur J Cancer 2011; 47(1): 74-83.
- Hawkins MM: Resultado da gravidez e descendência após o cancro infantil. BMJ 1994; 309(6961): 1034.
- Green DM, et al: Falha dos ovários e resultados reprodutivos após tratamento do cancro infantil: resultados do Estudo de Sobrevivência do Cancro Infantil. J Clin Oncol 2009; 27(14): 2374-2381.
- Mueller BA, et al: Resultados da gravidez em mulheres sobreviventes de cancro na infância e adolescência: uma análise de registo de cancro ligado ao nascimento. Arch Pediatr Adolesc Adolesc Med 2009; 163(10): 879-886.
- Chow EJ, et al: Reproductive outcomes in male childhood cancer survivors: a linked cancer-birth registry analysis. Arch Pediatr Adolesc Med 2009; 163(10): 887-894.
- Boere I, et al: O cancro na gravidez: segurança e eficácia das terapias sistémicas. Curr Opinião Oncol 2017; 29(5): 328-334.
- Ngu SF, Ngan HY: Quimioterapia na gravidez. Melhor Pract Res Clin Obstet Gynaecol 2016; 33: 86-101.
- Shachar SS, et al: Gestão Multidisciplinar do Cancro da Mama durante a Gravidez. Oncologista 2017; 22(3): 324-334.
- Green DM, et al: Fertility of female survivors of childhood cancer: a report from the childhood cancer survivor study. J Clin Oncol 2009; 27(16): 2677-2685.
- Peccatori FA, et al: Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24(Suppl 6): vi160-170.
InFo ONCOLOGy & HEMATOLOGy 2017; 5(6): 27-30











