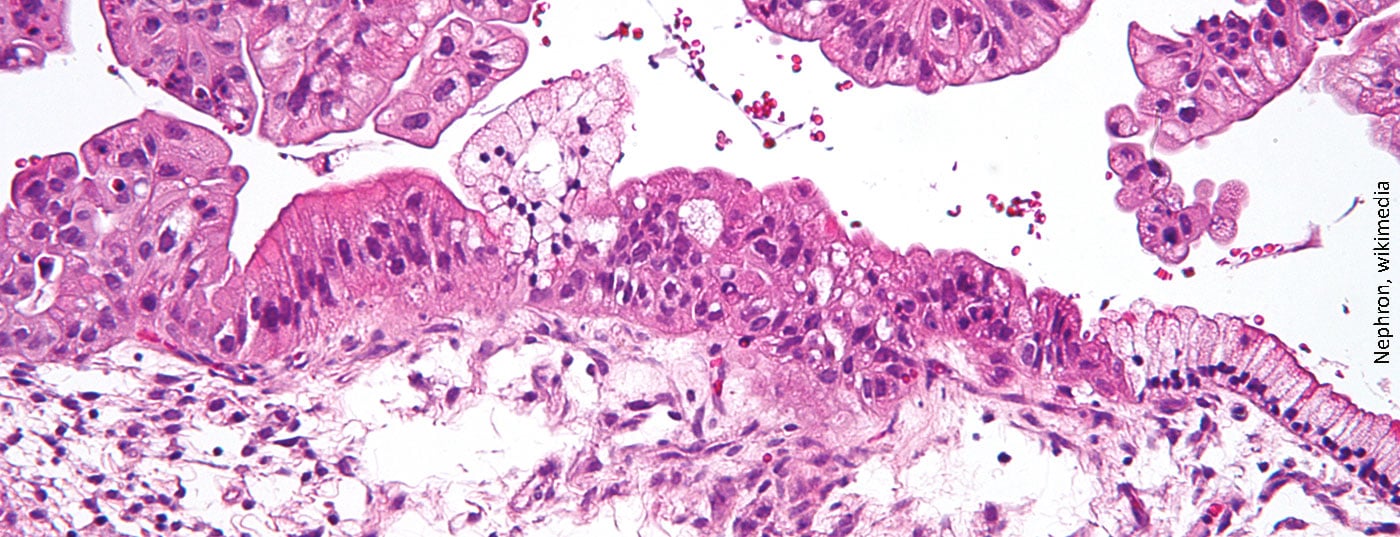
Morrem mais mulheres de cancro dos ovários do que de qualquer outro tumor – principalmente porque é normalmente detectado muito tardiamente. Os inibidores PARP foram desenvolvidos para o tratamento do cancro recorrente dos ovários e demonstraram aumentar a sobrevivência sem progressão (PFS) como terapia de manutenção.
Todos os anos, cerca de 580 mulheres são diagnosticadas com cancro nos ovários na Suíça. Quase 75% dos doentes não sobrevivem a esta doença. Uma razão é que em cerca de três quartos das pessoas afectadas, o tumor é detectado numa fase muito tardia, devido aos sintomas inespecíficos. Devido ao curso agressivo do cancro, isto está associado a um prognóstico muito pobre. Cerca de 80% dos pacientes sofrem uma recidiva nos três anos seguintes à cirurgia e à quimioterapia.
Faltam opções de detecção precoce
O risco de desenvolver cancro nos ovários é influenciado pela idade, obesidade, falta de filhos, menarca precoce, menopausa tardia e história familiar. É também significativamente aumentada se houver uma mutação nos genes BRCA. Depois, a prevalência ao longo da vida aumenta vinte vezes. Actualmente, não existem métodos de rastreio fiáveis para identificar a doença a tempo. Na altura do diagnóstico, o cancro já se propagou frequentemente aos órgãos próximos. Contudo, quanto mais tarde for feito o diagnóstico, mais limitadas são as opções de tratamento. Se a cirurgia, os citostáticos e os inibidores da angiogénese não funcionarem e houver uma recaída, os inibidores PARP podem agora ser utilizados.
Estes interferem com o mecanismo de reparação do ADN e levam à apoptose do tumor por meio da instabilidade genómica. As células tumorais utilizam enzimas PARP para reparar os seus danos no ADN. Isto também inclui danos causados por drogas citostáticas. Os inibidores PARP já não podem reparar quebras de uma só corda. As quebras de dupla corda que ocorrem durante a divisão celular seguinte levam então à morte celular em células com reparação de dupla corda de ADN perturbada.
A terapia de manutenção convence
Num ensaio aleatório, duplo-cego e controlado por placebo de fase III, o inibidor PARP niraparib foi comparado ao placebo no tratamento de 733 pacientes com cancro do ovário de fase III ou IV após quimioterapia à base de platina. Actualmente, o medicamento é aprovado na Suíça, independentemente do estado de mutação BRCA, como terapia de manutenção para o cancro de ovário recorrente sensível à platina após resposta à quimioterapia baseada na platina, tendo em conta a limitação. Foi avaliada a eficácia do inibidor PARP como terapia de manutenção, tal como medida pelo PFS, em pacientes com tumores homólogos deficientes de recombinação e em pacientes da população em geral, tal como determinado por testes hierárquicos.
Os resultados de um estudo de fase III provam a sua eficácia
Foi incluído um total de 373 pacientes (50,9%) com tumores com deficiência de recombinação homóloga. Entre os pacientes desta categoria, a sobrevida mediana sem progressão foi significativamente mais longa no grupo niraparibe do que no grupo placebo (21,9 meses vs. 10,4 meses; p<0,001). Na população total, o PFS correspondente foi de 13,8 meses e 8,2 meses (HR, 0,62; 95% CI, 0,50 a 0,76; p<0,001) (Fig. 1). Numa análise intercalar de 24 meses, a taxa de sobrevivência global foi de 84% no grupo verum e 77% no grupo placebo (HR, 0,70; 95% CI, 0,44 a 1,11). As reacções adversas de grau 3 ou superior mais comuns foram anemia (em 31,0% dos doentes), trombocitopenia (em 28,7%) e neutropenia (em 12,8%).
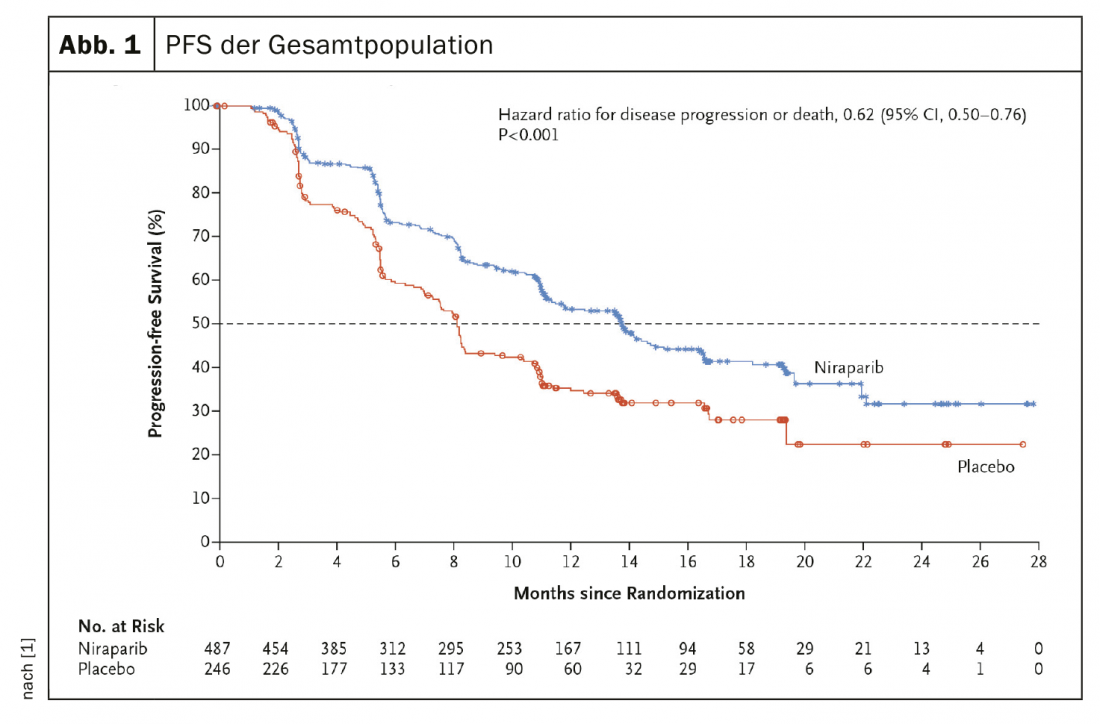
O inibidor PARP leva a PFS significativamente melhorado
Os peritos resumiram que entre os doentes com cancro de ovário avançado recentemente diagnosticado que responderam à quimioterapia à base de platina, aqueles que receberam o inibidor PARP tiveram uma sobrevivência sem progressão significativamente mais longa do que aqueles que receberam placebo. Este resultado foi independente da deficiência de recombinação homóloga.
Leitura adicional:
- González-Martín A, et al: Niraparib in atients with Newly Diagnosed Advanced Ovarian Cancer, NEJM 2019; Online first. DOI: 10.1056/NEJMoa1910962.
Fonte: European Society for medical Oncology (ESMO) 2019
InFo ONCOLOGY & HEMATOLOGY 2019; 7(5): 28 (publicado 17.10.19, antes da impressão).