O carcinoma da próstata é o cancro mais comum nos homens. Nem todos os cancros da próstata são iguais (palavra-chave estratificação de risco). Nem todos os carcinomas da próstata precisam de ser tratados (palavra-chave “sobreterapia”). Dependendo do perfil de risco, estão disponíveis várias opções terapêuticas curativas para o tratamento do carcinoma da próstata localizado.
Na Suíça, cerca de 6100 homens são diagnosticados com cancro da próstata todos os anos. Isto faz do carcinoma da próstata o tipo de cancro mais comum de todos. Na maior parte dos casos, a fase inicial do tumor é localizada ou definida pelo órgão. Neste caso, o urologista de tratamento tem uma variedade de opções de tratamento à sua disposição. Estes variam desde a vigilância activa até à prostatectomia radical.
Antes de decidir a favor ou contra uma forma de terapia, a condição geral, a esperança de vida e as características do tumor (estratificação do risco) devem ser avaliadas para cada paciente. A esperança de vida desempenha um papel mais importante do que a idade biológica ao considerar as modalidades de tratamento. Com a idade avançada do paciente ou a esperança de vida reduzida, as comorbilidades do paciente reduzem o risco de morrer de cancro da próstata: Os pacientes morrem assim com o carcinoma da próstata, mas não com o carcinoma da próstata.
Estratificação de risco
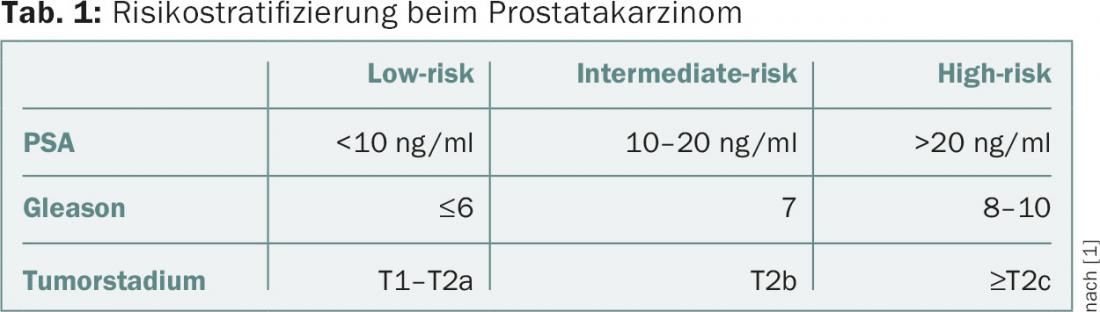
A estratificação do risco no cancro da próstata baseia-se no valor de PSA, na pontuação bióptica de Gleason e na fase clínica. Uma classificação comum é de acordo com D’Amico et al. [1]. Aqui, os doentes com carcinoma da próstata localizado estão divididos em três grupos de risco (tab. 1).
Vigilância activa
O desequilíbrio entre a incidência e a mortalidade no cancro da próstata localizado sugere que alguns pacientes não beneficiam de tratamento (tratamento excessivo). Os homens que não procuram tratamento imediato podem optar pela vigilância activa (AS) na presença de um tumor de baixo risco [2]. O estado local e o valor do PSA são controlados e as rebiopsias são realizadas de acordo com um calendário. AS tem dois objectivos: Em primeiro lugar, os homens com um carcinoma de próstata localizado não devem receber terapia curativa imediatamente, mas sim a tempo em caso de progressão. Segundo, para reduzir os riscos de complicações induzidas pelo tratamento (por exemplo, disfunção eréctil, incontinência) em homens com carcinomas de baixo risco.
Com uma boa selecção de doentes, os resultados são promissores. A sobrevivência global dos pacientes no curso a longo prazo é a mesma que a dos pacientes que receberam directamente a terapia curativa. Cerca de 25% dos pacientes sob AS são submetidos a terapia curativa durante o período de observação. A carga psicológica por vezes elevada dos pacientes e um possível agravamento do prognóstico com terapia retardada falam contra o conceito de AS. Por exemplo, existem dados que indicam que os pacientes que esperaram mais de 180 dias por terapia após o diagnóstico de carcinoma da próstata tinham um risco de recidiva pós-operatória que era 2,7 vezes superior ao dos pacientes que tinham sido submetidos a uma prostatectomia radical nos primeiros três meses [3].
AS tem, sem dúvida, um lugar no tratamento do carcinoma da próstata localizado, mas faltam ainda actualmente preditores fiáveis para a estimativa segura do prognóstico. Por conseguinte, os pacientes devem ser informados e educados sobre as respectivas vantagens e desvantagens do SA.
Braquiterapia de baixa taxa de dose
Na braquiterapia de baixa taxa de dose (LDR), os pinos metálicos radioactivos (sementes) são inseridos na próstata através do períneo utilizando agulhas ocas sob controlo de ultra-sons. As sementes permanecem na glândula da próstata e entregam aí a dose radioactiva necessária. O procedimento é realizado sob anestesia e demora cerca de duas horas e meia a três horas, incluindo todos os preparativos, com uma estadia de internamento normalmente de apenas uma noite após a operação.
De grande importância para a braquiterapia é a selecção dos pacientes. Devido à situação de dados heterogéneos, a braquiterapia LDR é apenas uma opção de tratamento para pacientes com um carcinoma de baixo risco (ou seja, pacientes que também se qualificam para AS), um tamanho de próstata <50 cm3 e sem sintomas relevantes de micturição (IPSS ≤12). A sobrevivência sem doenças após cinco anos é de 71-93%, após dez anos 65-85% [4]. Até à data, nenhum estudo randomizado comparou a braquiterapia com qualquer outra terapia curativa para o cancro da próstata localizado.
Radioterapia externa
A radioterapia percutânea externa (“radioterapia por feixe externo”, EBRT) é uma alternativa terapêutica para o carcinoma da próstata confinado a órgãos. Em comparações retrospectivas, a EBRT mostra resultados oncológicos comparáveis à prostatectomia radical em tumores bem diferenciados; a prostatectomia radical tem vantagens em tumores mal diferenciados. O EBRT é realizado como radiação individual guiada por imagem (CT, MRI, PET-CT) utilizando fotões com utilização óptima do órgão alvo, poupando o máximo possível os órgãos de risco circundantes. A duração da EBRT é de várias semanas (por exemplo 78 Gy dose total com doses individuais de 2 Gy = 39 fracções = oito semanas de terapia).
Dependendo do grupo de risco, de acordo com D’Amico et al. os pacientes com EBRT recebem ou terapia neoadjuvante, concomitante ou adjuvante de privação de androgénio (ADT). Portanto, devido à dependência hormonal do cancro da próstata, os resultados da EBRT são difíceis de comparar com os resultados de outras modalidades de terapia curativa. Se ocorrer uma recorrência após a EBRT primária, esta também pode, em princípio, ser tratada e curada por prostatectomia de salvamento radical, mas o procedimento está associado a um risco significativamente aumentado de complicações graves (incontinência em 56%, disfunção eréctil em 81%) [5]. Continua a não ser claro se e com que frequência ocorrem os segundos cancros após o EBRT.
Prostatectomia radical da próstata
Na prostatectomia radical (RP), toda a glândula prostática com as vesículas seminais e as ampolas dos canais deferentes são removidas. Nos centros de tratamento, o procedimento é actualmente realizado de preferência num procedimento minimamente invasivo assistido por robô (RARP) utilizando o sistema da Vinci. Estudos recentes relatam menor morbilidade perioperatória e melhor função eréctil pós-operatória utilizando o sistema da Vinci em comparação com a técnica aberta [6,7]. Em contraste, as observações iniciais a longo prazo com um seguimento de dez anos indicam uma eficácia oncológica equivalente da cirurgia assistida por robô e aberta [8].
Dependendo das características do tumor e da função sexual do paciente, a RP é realizada quer para preservar a função eréctil (para preservar a função eréctil), quer para a função não nervosa. Dependendo do perfil de risco, é realizada uma linfadenectomia pélvica ao mesmo tempo que a RP. Dos vários métodos curativos para o tratamento do carcinoma da próstata localizado, a RP é o único para o qual existe um nível de evidência I no que diz respeito ao controlo de tumores. Outra vantagem potencial da RP em relação à EBRT é que em caso de recorrência após a RP, uma proporção substancial de doentes pode ser curada com morbilidade aceitável (incontinência em 13%, disfunção eréctil em 61%) por radiação aditiva (a chamada radioterapia de salvamento) [5].
Outros tratamentos
Para além das modalidades de tratamento estabelecidas já descritas, existe uma variedade de outras formas de terapia. Estas incluem crioterapia, ultra-som de alta intensidade focalizado (HIFU), braquiterapia intersticial da próstata de alta dose e terapias combinadas (por exemplo, EBRT e braquiterapia intersticial da próstata). Uma avaliação científica destes procedimentos está ainda pendente e, por conseguinte, não permite quaisquer recomendações claras.
Conclusão
Aos homens com um carcinoma de próstata recentemente diagnosticado, localmente limitado e com uma elevada esperança de vida podem agora ser oferecidos todos os métodos estabelecidos (EBRT, RP, LDR braquiterapia da próstata ou AS), dependendo do perfil de risco. A escolha do procedimento ideal para o paciente individual é um desafio e requer uma estreita cooperação entre todas as disciplinas envolvidas. Isto pode ser melhor realizado no âmbito de um quadro interdisciplinar de tumores.
Literatura:
- D’Amico AV, et al: Resultado bioquímico após prostatectomia radical, radioterapia por feixe externo, ou radioterapia intersticial para o cancro da próstata clinicamente localizado. JAMA 1998; 280(11): 969-974.
- Klotz L: Vigilância activa: selecção de doentes. Curr Opinião Urol 2013; 23(3): 239-244.
- Lellig K, et al: [Active surveillance of low risk prostate cancer]. Urologista A 2014; 53(7): 1031-1039.
- Mottet N, et al: Directrizes sobre o cancro da próstata. Associação Europeia de Urologia. Directrizes sobre o cancro da próstata. Associação Europeia de Urologia 2015.
- van der Poel HG, et al: Tratamento sequencial para o cancro da próstata localizado recorrente. Journal of Surgical Oncology 2008; 97(5): 377-382.
- Ficarra V, et al: Revisão sistemática e meta-análise de estudos que relatam a recuperação da continência urinária após prostatectomia radical assistida por robot. Eur Urol 2012; 62(3): 405-417.
- Haglind E, et al: Urinary Incontinence and Erectile Dysfunction After Robotic Versus Open Radical Prostatectomy: A Prostatectomy Radical Prospective, Controlled, Nonrandomised Trial. Eur Urol 2015; 68(2): 216-225.
- Diaz M, et al: Resultados oncológicos aos 10 anos após a prostatectomia radical robótica da próstata. Eur Urol 2015; 67(6): 1168-1176.
InFo ONCOLOGY & HEMATOLOGY 2015; 3(11-12): 8-10