O AVC é uma das principais causas de deficiência. A deficiência cognitiva que ocorre após o AVC tem sido bastante negligenciada durante muitos anos. A revisão concentra-se na incidência e prevalência do declínio cognitivo após o AVC, nos principais factores predisponentes, nos factores de imagem e nos potenciais biomarcadores candidatos.
O AVC é uma das principais causas de deficiência [1]. Embora a maior parte da investigação e das intervenções se tenha centrado nas deficiências físicas [2], a deficiência cognitiva que ocorre após um AVC tem sido bastante negligenciada durante muitos anos [3,4]. Sabe-se actualmente que mesmo pequenas pinceladas podem afectar o funcionamento diário e a cognição e, consequentemente, influenciar a qualidade de vida [5]. O derrame isquémico pode facilitar o início da demência vascular, bem como agravar o declínio cognitivo pré-existente. O início do declínio cognitivo pode manifestar-se imediatamente após o início de um AVC isquémico, mas muitas vezes há um atraso no desenvolvimento do declínio cognitivo após um AVC [6]. Ambos os mecanismos neurodegenerativos e vasculares são activados e provavelmente resultam em processos sobrepostos dentro da unidade neurovascular [7]. Na presente revisão, vamos concentrar-nos na incidência e prevalência do declínio cognitivo após o AVC, nos principais factores predisponentes, nos factores de imagem e nos potenciais biomarcadores candidatos.
Epidemiologia
Os sobreviventes de AVC correm um risco acrescido de desenvolver uma deficiência cognitiva. As estimativas reportadas da prevalência da demência são consistentes em vários estudos: 10% dos doentes apresentam demência antes do primeiro AVC, 10% desenvolvem nova demência após o primeiro AVC, e mais de um terço têm demência após um AVC recorrente [8,9].
A forte associação da demência pós-acidente vascular cerebral (AVC) com os AVC múltiplos realça o papel causal central do AVC e, portanto, o efeito provável dos cuidados óptimos com os AVC agudos e a prevenção secundária na redução da carga da demência [8]. A prevalência de perturbações cognitivas nos sobreviventes de AVC varia em função do cenário, da população, dos critérios de exclusão (demência pré-acidente vascular cerebral, AVC recorrente, afasia), dos critérios utilizados para o diagnóstico de perturbações cognitivas e do intervalo de tempo desde o AVC [10]. A prevalência de demência pós-acidente vascular cerebral no primeiro ano após o AVC varia entre 7% em estudos populacionais de primeiro AVC, excluindo demência pré-acidente vascular cerebral, e 41% em estudos hospitalares, incluindo AVC recorrente e demência pré-acidente cerebral [8). O risco de demência pós-acidente vascular cerebral foi considerado mais elevado nos primeiros meses após o AVC, o que pode ser parcialmente devido a uma deficiência cognitiva não reconhecida antes do AVC [10]. Após a incidência inicial de demência pós-acidente, a incidência acumulada aumenta linearmente a uma taxa de 3% e 1,7% por ano em estudos hospitalares e populacionais, respectivamente [11]. Poucos estudos utilizaram resultados a longo prazo: o período de observação mais longo foi de 25 anos num estudo baseado na população que encontrou uma incidência acumulada de demência pós-choque de 48% no ano 25 [12].
A deficiência cognitiva também pode ocorrer após a AIT. Numa recente revisão sistemática que incluiu 1167 doentes, a prevalência de uma ligeira deficiência cognitiva pós-TIA variou entre 29 e 68%. Foi encontrada uma deficiência cognitiva grave em 8-22% dos doentes. Estudos que utilizam um instrumento de rastreio cognitivo e os realizados pouco tempo depois da AIT ou vários anos mais tarde, relataram as frequências mais elevadas de deficiência [13].
Definições
A demência vascular é a segunda causa mais comum de declínio cognitivo após a doença de Alzheimer e inclui a demência pós-choque. Por conseguinte, os termos PSD e demência vascular não são sinónimos. A demência vascular representa um conceito que inclui não só múltiplos enfartes corticais e/ou subcorticais, mas também enfartes estratégicos únicos, lesões não infecciosas da matéria branca, hemorragias, e hipo perfusão como possíveis causas de demência. Além disso, deve salientar-se que nem todos os casos de demência pós-choque são de origem vascular. Consequentemente, o termo de demência pós-acidente vascular cerebral (DSP) é utilizado para qualquer demência que se desenvolva na sequência de um evento clínico cerebrovascular. Desta forma, o termo PSD não sugere um processo neuropatológico particular. Além disso, o reconhecimento do estado cognitivo pré-acidente é essencial para permitir uma classificação adequada. Um doente com deficiência cognitiva pré-existente que apresente um AVC menor não deve ser rotulado como PSD. Além disso, a avaliação temporal da deficiência cognitiva é outro factor de diagnóstico relevante. As deficiências agudas nos resultados dos testes cognitivos são frequentemente observadas após um AVC e os testes de repetição após várias semanas revelam frequentemente melhorias [10]. Por conseguinte, recomenda-se que o diagnóstico final do PSD seja adiado para pelo menos seis meses após o evento.
Deve ainda notar-se que o termo “pós-acidente vascular cerebral” inclui não só acidentes vasculares cerebrais e pequenos acidentes vasculares cerebrais, mas também ataques isquémicos transitórios (AIT), uma vez que as provas emergentes sugerem que as AIT também podem estar associadas a prognósticos cognitivos adversos [13].
Testes de rastreio
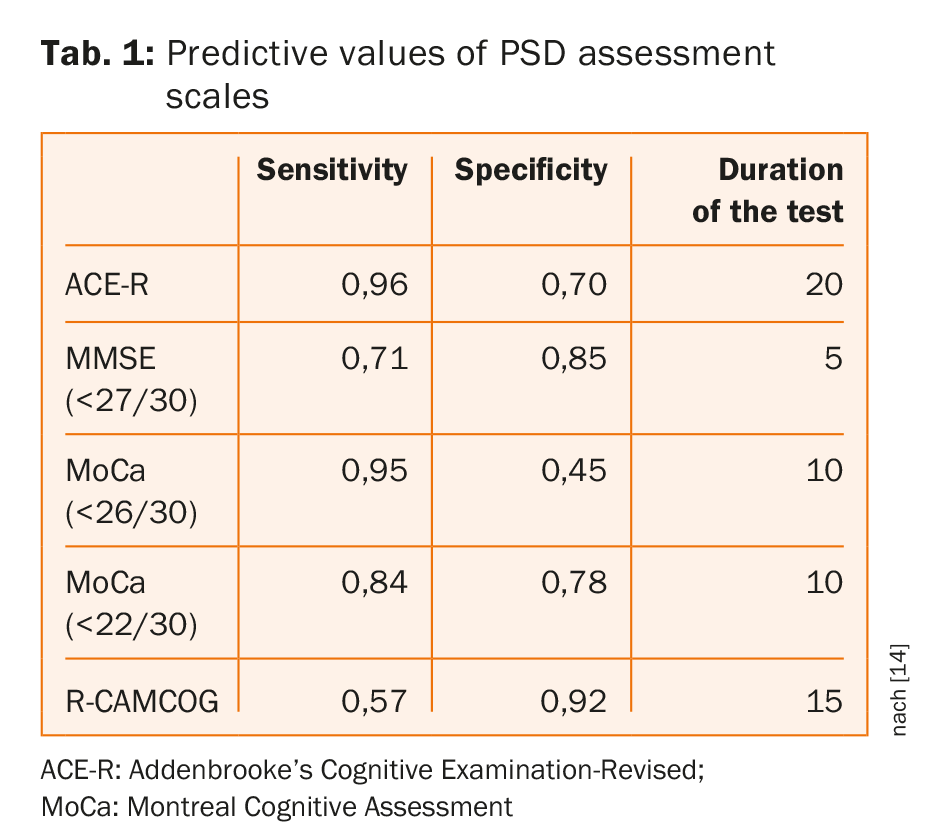
As ferramentas de rastreio cognitivo comummente utilizadas têm uma precisão semelhante para a detecção de demência/multi-domínio, sem qualquer teste claramente superior e sem provas de que as ferramentas de rastreio com tempos de administração mais longos tenham um melhor desempenho [14]. Como se mostra no quadro 1, o MoCA no limiar habitual oferece um tempo de avaliação curto com elevada sensibilidade mas ao custo da especificidade; cortes adaptados melhoraram a especificidade sem sacrificar a sensibilidade [14].
Factores de risco para demência pós-choque
Os principais factores de risco para a demência pós-acidente vascular cerebral estão listados no quadro 2 . De facto, estes parâmetros actuam em níveis distintos, uns mais sobre o pré-acidente vascularização, enquanto outros sobre a condição pós-acidente. Numa revisão sistemática e meta-análise incluindo 7511 pacientes, Pendlebury e colegas mostraram que a atrofia do lobo temporal medial, o sexo feminino, e uma história familiar de demência estavam fortemente associados à demência pré-acidente vascular cerebral, enquanto as características e complicações do AVC e a presença de lesões múltiplas no tempo e no local estavam mais fortemente associadas à demência pós-acidente vascular cerebral [8].
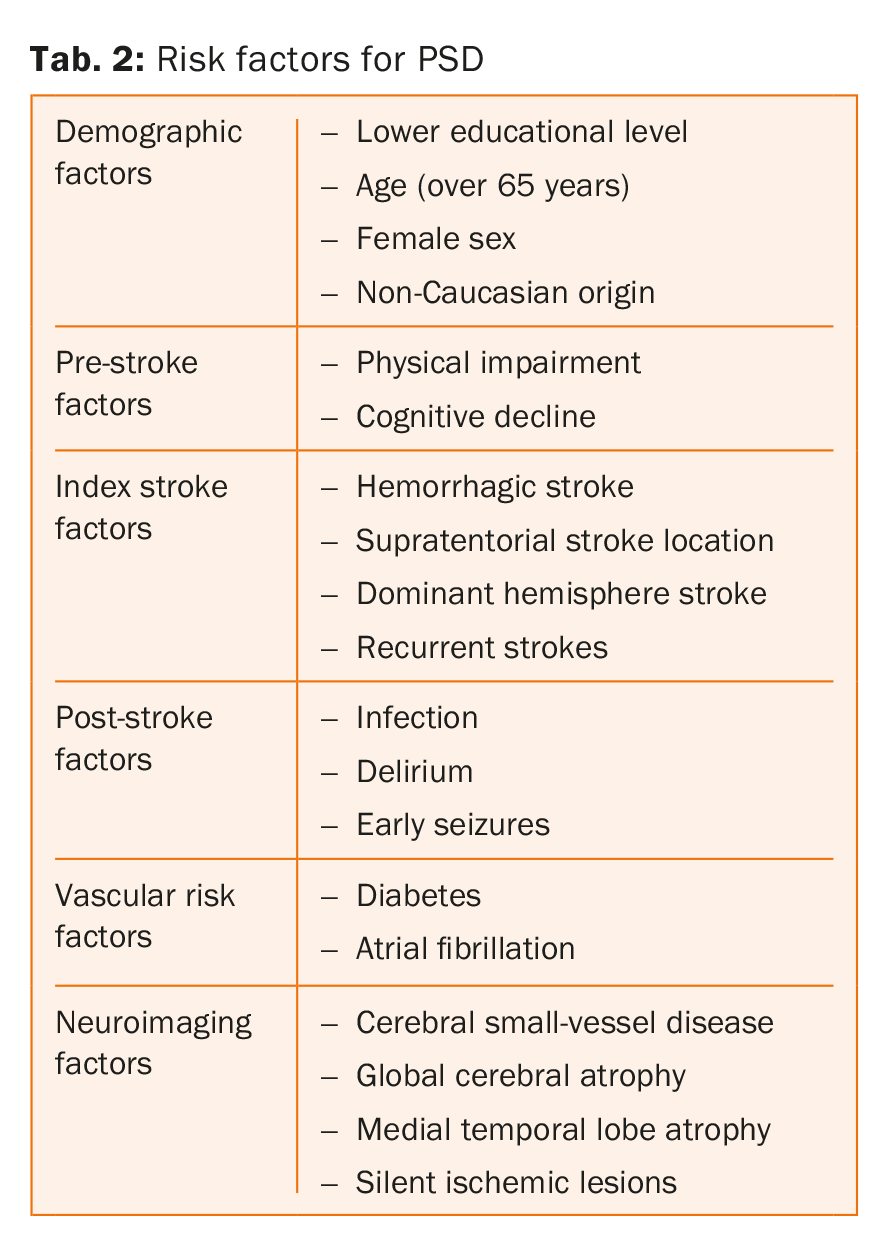
É também digno de nota o facto de factores de risco vascular, como a diabetes e a fibrilação atrial, estarem associados a um risco acrescido de demência pós-acidente vascular cerebral, independentemente da deficiência cognitiva pré-acidente, ao passo que tal não foi encontrado para dois outros factores de risco bem estabelecidos, a hipertensão e o tabagismo [8,15-18]. Esta descoberta está, no entanto, em contradição com os resultados de outros estudos que mostram que a hipertensão arterial é um determinante importante da deficiência cognitiva [19,20]. Finalmente, faltam provas de que os factores de risco vascular relacionados com o estilo de vida, tais como a inactividade física e uma dieta pouco saudável, são também factores de risco independentes para a DSP [21].
Subtipos de AVC
Pensa-se geralmente que os acidentes vasculares cerebrais lacunares podem ser menos susceptíveis de afectar a cognição do que os acidentes vasculares cerebrais mais graves e de maior dimensão, embora os acidentes vasculares cerebrais lacunares estejam geralmente associados a doenças cerebrais de pequenos vasos, uma causa comum de défice cognitivo e demência, especialmente nos idosos [22]. Numa meta-análise recente, Makin e colegas de trabalho, comparou a incidência de perturbações cognitivas em conformidade com os diferentes subtipos de AVC [23]. Os autores demonstraram entre 7575 pacientes, incluindo 2860 com AVC lacunar, que 24% tinham uma ligeira deficiência cognitiva (ICM) ou DSP. A prevalência de demência após acidente vascular cerebral lacunar (seis estudos, n=1421) foi de 20% (95% CI 9 a 33) e a incidência de ICM ou demência (quatro estudos, n=275) foi de 37% (95% CI 23 a 53). Os autores concluíram que a deficiência cognitiva parecia ser comum após acidentes vasculares cerebrais lacunares, apesar do seu pequeno tamanho, sugerindo que a SVD associada pode aumentar o seu impacto. Não foi observada qualquer diferença significativa relativamente à prevalência de PSD entre acidentes vasculares cerebrais lacunares e não-lacunares.
Neuroimagem
A neuroimagem é um importante instrumento de diagnóstico no PSD. A ressonância magnética (MRI) é a principal modalidade de neuroimagem que produz uma alta sensibilidade e especificidade para a detecção de alterações patológicas, incluindo a doença de pequenos vasos. Para o diagnóstico de doenças em pequenos vasos e declínio cognitivo pós-choque, a RM deve ser utilizada com várias sequências. As normas de neuroimagem são recomendadas com uma terminologia amplamente aceite, permitindo a comparação de resultados [26].
A tomografia por emissão de positrões (PET) permite a imagiologia das perturbações metabólicas localizadas e/ou difusas responsáveis pela deficiência cognitiva e demência, e é eficaz para diferenciar a demência vascular da degenerativa, como a doença de Alzheimer (diminuição do metabolismo no córtex temporo-mesial, córtex têmporo-parietal e cingulo posterior, metabolismo preservado no córtex frontal e visual, na região central e nos gânglios basais). Pode também detectar alterações inflamatórias e a sua interacção com depósitos amilóides para o desenvolvimento de demências mistas após um AVC [27].
Preditores de imagem
Algumas características de imagem de ressonância magnética têm um valor preditivo relativamente à ocorrência de PSD. Num estudo recente, 294 pacientes com SVD foram avaliados três a cinco anos após a apresentação inicial de um AVC subcortical de tipo lacunar [28]. No seguimento, foi detectada uma deficiência cognitiva vascular (VCI) de qualquer tipo em 188 (63,9%) dos doentes verbitas, com 65 (22,1%) a preencherem os critérios para demência vascular. A análise de regressão logística multivariada ajustada por idade e sexo identificou a gravidade global das hiperintensidades de matéria branca (tARWMC HR 1,42, 95% CI 1,01-2,00; p0,043) e o número total de enfartes lacunares (HR 3,06, 95% CI 1,71-5,50, p < 0,001) como preditores independentes do declínio cognitivo. Outro estudo comparou o valor prognóstico da atrofia do lobo temporal medial e as características da SVD numa coorte de 234 doentes com AVC ou TIA [29]. Foi explorada a relação entre as características radiológicas sugestivas da doença de Alzheimer e SVD e foi investigada a associação de cada uma destas características com o estado cognitivo a um ano. As características SVD foram associadas independentemente com MTA (p<0,001). Após ajustamento para idade, sexo, incapacidade após AVC, hipertensão e diabetes mellitus, a atrofia temporal medial foi a única característica radiológica independentemente associada à deficiência cognitiva, definida usando limiares de estado mental mini (MMSE) ≤26 (odds ratio 1,94; 95% CI1,28-2,94) e MMSE ≤23 (odds ratio 2,31; 95% CI1,48-3,62).
Biomarcadores
Biomarcadores para PSD podem incluir mediadores metabólicos, genéticos e inflamatórios. O alelo e4 da apolipoproteína E (APOE4) é um conhecido factor de risco para a doença de Alzheimer [30,31]. APOE4 está também associado a doenças cardiovasculares e enfartes cerebrais [31]. Existem dados contraditórios relativamente à associação do polimorfismo APOE4 com demência vascular e PSD [32–35]. O sistema renina-angiotensina, tanto através de efeitos metabólicos como vasculares, está alegadamente envolvido na patogénese da demência [36,37]. A enzima conversora da angiotensina (ACE) é uma das enzimas do sistema renina-angiotensina. Os pacientes com genótipo ACE têm níveis elevados de ACE no plasma e correm maior risco de comorbidade cardiovascular [38–40]. Estudos anteriores mostraram uma associação entre o alelo ACE e o declínio cognitivo. Este efeito pode ser mais forte na presença do APOE4 [41,42]. Contudo, os estudos que investigam a ACE como preditor do declínio cognitivo pós-acidente terminaram com dados contraditórios [42,43]. Outros biomarcadores como a enzima B secretase (BACE1) e níveis receptores do produto final da glicação avançada (sRAGE) foram sugeridos para correlacionar com a deficiência cognitiva imediatamente após o AVC (avaliado duas semanas após o AVC) [39]. Os níveis de homocisteína, vitamina B12 e ácido fólico estavam ligados ao declínio cognitivo e ao AVC, e podiam desempenhar um papel no PSD. Contudo, no ensaio VITATOPS a suplementação com vitaminas B não teve qualquer efeito sobre a incidência de défice cognitivo ou declínio cognitivo [44]. Um ambiente inflamatório excessivo no cérebro poderia agravar os danos pós isquémicos. Portanto, os indivíduos com elevada resposta inflamatória ao insulto isquémico podem ser mais vulneráveis a mais danos nos tecidos e ao desenvolvimento de PSD.
Sabe-se que a inflamação sistémica e os marcadores inflamatórios estão associados à deficiência cognitiva [45], particularmente à demência degenerativa como a doença de Alzheimer [46–48]. Estudos longitudinais mostraram uma correlação entre uma maior concentração de base de interleucina 6 (IL-6) [48] e a proteína C-reactiva (CRP) [49] e o declínio cognitivo. No entanto, a associação entre inflamação e PSD ainda não está estabelecida. Vários estudos recentes têm investigado a relação entre os marcadores inflamatórios e o PSD. A taxa de sedimentação de eritrócitos (ESR) [50], CRP e IL-6 [51] foram sugeridos como preditores do PSD.
Tratamento farmacológico e prevenção
Existem várias intervenções farmacológicas para a prevenção do declínio cognitivo pós-choque. A redução da tensão arterial a longo prazo após o AVC com perindopril foi associada a um declínio cognitivo reduzido e a uma tendência para uma menor demência no ensaio PROGRESS [52].
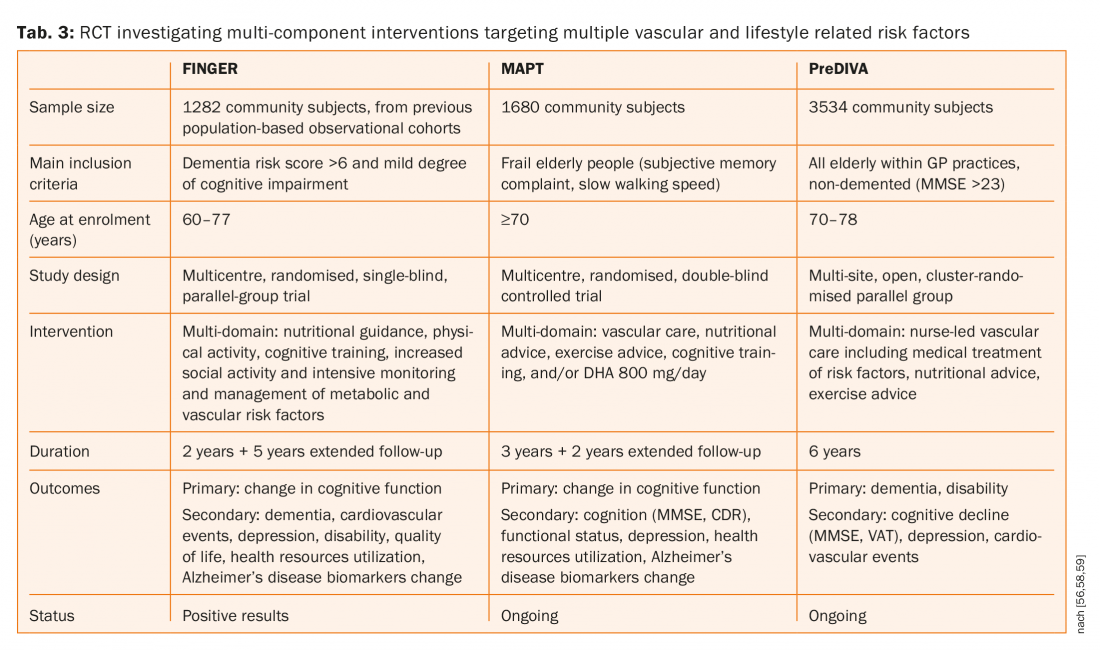
Além disso, foi demonstrado que as estatinas reduzem tanto o primeiro derrame como o recorrente, mas nem a sinvastatina nem a pravastatina tiveram qualquer influência na cognição [53,54]. Três grandes ensaios controlados aleatorizados (FINGER, MAPT e préDIVA), tab. 3) investigação de intervenções multicomponentes que visem múltiplos factores de risco vasculares e relacionados com o estilo de vida versus conselhos gerais de saúde (grupo de controlo) para prevenir o declínio cognitivo e a demência [55–58]. Um destes três estudos (FINGER) publicou os seus resultados e sugeriu que uma intervenção multi-domínio poderia melhorar ou manter o funcionamento cognitivo em pessoas idosas em risco [55,56]. Foram atribuídos aleatoriamente 1260 pacientes ao grupo de intervenção (n=631) ou ao grupo de controlo (n=629). 591 (94%) participantes no grupo de intervenção e 599 (95%) no grupo de controlo tiveram pelo menos uma avaliação pós-base e foram incluídos na análise de intenção de tratamento modificada. A alteração média estimada da pontuação da bateria de testes neuropsicológicos aos dois anos foi de 0,20 no grupo de intervenção e de 0-16 no grupo de controlo. A diferença entre grupos na mudança da pontuação total da bateria de testes neuropsicológicos por ano foi de 0,022 (95% CI 0,002-0,042; p=0,030).
Conclusão
Uma proporção importante de pacientes sofrerá de demência ou de formas mais suaves de deterioração cognitiva após um AVC ou mesmo uma AIT. Um certo número de parâmetros clínicos e radiológicos pode prever a ocorrência de PSD. Embora o risco seja reportado como sendo mais elevado no período imediato após o AVC, continuará a ser elevado mesmo após vários anos. A presença deste atraso entre o tempo do AVC e o início da demência permite ainda mais a utilização de uma janela de tempo terapêutico para intervenção. Estudos farmacológicos mostraram que a redução da tensão arterial a longo prazo após o AVC estava associada a um declínio cognitivo reduzido. Recentemente, um grande ensaio randomizado controlado mostrou que uma intervenção multi-domínio poderia melhorar ou manter o funcionamento cognitivo em pessoas idosas em risco. Estes resultados sugerem ainda a influência positiva de intervenções multicomponentes que visam múltiplos factores de risco vasculares e relacionados com o estilo de vida na ocorrência de demência pós-acidente vascular.
Take-Home-Messages
- Os sobreviventes de AVC correm um risco acrescido de desenvolver uma deficiência cognitiva.
- A demência pós-acidente vascular cerebral (PSD) está associada a vários factores que indicam, por um lado, uma reduzida reserva cognitiva, incluindo o declínio cognitivo pré-acidente vascular cerebral, incapacidade pré-mórbida, doença da matéria branca e atrofia cerebral e, por outro lado, aspectos específicos do acidente vascular cerebral.
- A ressonância magnética (MRI) é a principal modalidade de neuroimagem.
- Embora um grande número de biomarcadores tenha sido proposto para o PSD, nenhum parâmetro específico foi ainda provado para prever com robustez o PSD.
- Estudos farmacológicos mostraram que a redução da tensão arterial a longo prazo após o AVC estava associada a um declínio cognitivo reduzido.
- Um grande ensaio randomizado e controlado sugeriu recentemente que uma intervenção multi-domínio poderia melhorar ou manter o funcionamento cognitivo em pessoas idosas em risco.
Referências:
- Strong K, Mathers C, et al..: Prevenir o AVC: salvar vidas em todo o mundo. Lancet Neurol. 2007; 6: 182–187.
- Lees R, Fearon P, Harrison JK, et al: Avaliação cognitiva e do humor na investigação do AVC: revisão focalizada dos estudos contemporâneos. AVC. 2012; 43: 1678–1680.
- McKevitt C, Fudge N, et al: Auto-relatadas necessidades a longo prazo após acidente vascular cerebral. AVC. 2011; 42: 1398–1393.
- Pollock A, St George B, et al: As dez principais prioridades de investigação relacionadas com a vida após o AVC. Lancet Neurol. 2012; 11: 209.
- Fride Y, Adamit T, et al: Quais são os correlatos da cognição e da participação para voltar ao trabalho após o primeiro golpe suave de sempre? Reabilitação do AVC de topo. 2015;22(5): 317–325.
- Ballard C, Rowan E, et al: Estudo de seguimento prospectivo entre 3 e 15 meses após o AVC: melhorias e declínio da função cognitiva entre os sobreviventes de AVC sem demência >75 anos de idade. Stroke 2003; 34: 2440-2444.
- Kalaria RN: Doença cerebrovascular e mecanismos de comprometimento cognitivo: evidências de estudos clinicopatológicos em humanos.Stroke 2012; 43: 2526-2534.
- Pendlebury ST, Rothwell PM: Prevalência, incidência e factores associados à demência pré e pós-costomose: uma revisão sistemática e meta-análise. Lancet Neurol. 2009; 8: 1006–1018.
- Pendlebury ST, Chen PJ, et al: Estudo Vascular de Oxford. Factores metodológicos na determinação do risco de demência após ataque isquémico transitório e AVC: (I) impacto do viés de selecção da linha de base. AVC. 2015; 46: 641–646.
- Henon H, Pasquier F, Leys D: Demência pós-choque. Cerebrovasc Dis 2006; 22: 61-70.
- Mijajlović MD, Pavlović A, et al..: Demência pós-inflamatória – uma revisão abrangente. BMC Med. 2017 Jan 18; 15(1):11.
- Kokmen E, Whisnant JP, et al..: Demência após acidente vascular isquémico: um estudo populacional em Rochester, Minnesota (1960-1984). Neurologia 1996; 46: 154-159.
- Van Rooij FG, Kessels RP, et al..: Deficiência cognitiva em pacientes com ataque isquémico transitório: uma revisão sistemática. Cerebrovasc Dis. 2016; 42(1–2): 1–9.
- Lees R, Selvarajah J et al.:Testar a exactidão dos testes de rastreio cognitivo para o diagnóstico de demência e de perturbações cognitivas multidomínio no AVC. AVC. 2014 Out; 45(10): 3008-3018.
- Gottesman RF, Hillis AE: Preditores e avaliação de disfunções cognitivas resultantes de AVC isquémico. Lancet Neurol 2010; 9: 895-905.
- Pasquier F, Hénon H, Leys D: Factores e mecanismos de risco de demência pós-choque. Rev Neurol. 1999; 155(9): 749–753.
- Chaudhari TS, Verma R, et al..: Preditores clínico-radiológicos da deficiência cognitiva vascular (VCI) em doentes com AVC: um estudo observacional prospectivo. J Neurol Sci. 2014 15 de Maio; 340(1-2): 150-158.
- Arba F, Quinn T, et al..: Colaboração VISTA. Determinantes da deficiência cognitiva pós-choque: análise da VISTA. Acta Neurol Scand. 2017 de Junho; 135(6): 603–607.
- Iulita MF, Girouard H: Treating Hypertension to Prevent Cognitive Decline and Dementia (Tratar a Hipertensão para Prevenir o Declínio Cognitivo e a Demência): Reabrir o Debate. Adv Exp Med Biol. 2017; 956: 447–473.
- Kalaria RN: Factores de risco e mecanismos neurodegenerativos na demência relacionada com acidentes vasculares cerebrais. Panminerva Med. 2012 Set; 54(3):139-148.
- Teuschl Y, Matz K, Brainin M: Prevenção do declínio cognitivo pós-choque: uma revisão centrada nas intervenções no estilo de vida. Eur J Neurol. 2013 Jan; 20(1): 35–49.
- Wardlaw JM, Smith EE, et al..: Normas de neuroimagem para a investigação de doenças em pequenos vasos e a sua contribuição para o envelhecimento e a neurodegeneração. Lancet Neurol 2013; 12: 822-838.
- Makin SD, Turpin S, et al..: Deficiência cognitiva após AVC lacunar: revisão sistemática e meta-análise da incidência, prevalência e comparação com outros subtipos de AVC. J Neurol Neurosurg Psychiatry. 2013 Ago; 84(8): 893-900.
- Schmidt R, Ropele S, et al..: Imagem ponderada pela difusão e cognição na leucoariose e deficiência no estudo sobre idosos. Stroke 2010; 41: e402-e408.
- Blair GW, Hernandez MV, et al..: Neuroimagem Avançada da Doença Cerebral de Pequenos Vasos. Opções de Tratamento da Moeda Cardiovasc Med. 2017 Jul; 19(7): 56.
- Wardlaw JM, Smith EE, et al..: Normas de neuroimagem para a investigação de doenças em pequenos vasos e a sua contribuição para o envelhecimento e a neurodegeneração. Lancet Neurol. 2013; 12: 822–838.
- Heiss W-D, Zimmermann-Meinzingen S: imagens PET no diagnóstico diferencial da demência vascular. J Neurol Sci 2012; 322: 268-273.
- Pavlovic AM, Pekmezovic T, et al: Preditores de base do declínio cognitivo em doentes com doença cerebral dos pequenos vasos. J Alzheimers Dis. 2014; 42 Suppl 3: 37-43.
- Arba F, Quinn T, et al..: VISTA. Colaboração. Doença cerebral em pequenos vasos, atrofia do lobo temporal medial e estado cognitivo em doentes com AVC isquémico e ataque isquémico transitório. Eur J Neurol. 2017 Fev; 24(2): 276-282.
- Bu G: Apolipoproteína E e os seus receptores na doença de Alzheimer: vias, patogénese e terapia. Nat Rev Neurosci 2009; 10: 333-344.
- Davidson Y, Gibbons L et al..: Apolipoproteína E epsilon4 frequência alélica na demência vascular. Dement Geriatr Cogn Disord 2006; 22: 15-19.
- Hsiung G-YR, Sadovnick AD, Feldman H: genótipo Apolipoproteína E epsilon4 como factor de risco de declínio cognitivo e demência: dados do Estudo Canadiano sobre Saúde e Envelhecimento. CMAJ 2004; 171: 863-867.
- Mortimer JA, Snowdon DA, Markesbery WR: O efeito do APOE-epsilon4 na demência é mediado pela neuropatologia de Alzheimer. Alzheimer Dis Assoc Disord 2009; 23: 152-157.
- Rippon GA, Tang MX, et al..: Doença familiar de Alzheimer em latinos: interacção entre APOE, AVC, e substituição de estrogénio. Neurologia 2006; 66: 35-40.
- Jin YP, Østbye T, et al..: Efeito conjunto de AVC e APOE 4 no risco de demência: o Estudo Canadiano sobre Saúde e Envelhecimento. Neurologia 2008; 70: 9-16.
- Qian L, Ding L, et al..: Biomarcadores precoces para a deficiência cognitiva pós-choque. J Neurol 2012; 259: 2111-2118.
- Kolsch H, Jessen F, et al..: O polimorfismo ACE I/D é um factor de risco de doença de Alzheimer, mas não de demência vascular. Neurosci Lett 2005; 377: 37-39.
- Hassan A, Lansbury A, et al..: O genótipo de inserção/delecção de angiotensina conversora está associado à leucoaraiose em síndromes lacunares. J Neurol Neurosurg Psychiatry 2002; 72: 343-346.
- Szolnoki Z, Maasz A, et al..: A coexistência do receptor A1166C de angiotensina II tipo 1 e da enzima conversora de angiotensina D/D polimorfismo sugere susceptibilidade para o derrame isquémico associado a pequenos vasos. Neuromolecular Med 2006; 8: 353-360.
- Bartres-Faz D, Junque C, et al..: Angiotensina II, que converte o polimorfismo enzimático em humanos com perturbações da memória associadas à idade: relação com o desempenho cognitivo. Neurosci Lett 2000; 290: 177-180.
- Richard F, Berr C, et al..: Efeito da enzima de conversão da angiotensina I/D polimorfismo no declínio cognitivo. O Grupo de Estudo EVA. Envelhecimento do Neurobiol 2000; 21: 75-80.
- Bour AMJ, Rasquin SMC, et al..: O efeito do alelo APOE-epsilon4 e do polimorfismo ACE-I/D sobre a cognição durante um seguimento de dois anos em pacientes com o primeiro AVC. Dement Geriatr Cogn Disord 2010; 29: 534-542.
- Bour AMJJ, Rasquin SMC, et al: O efeito do alelo APOE-epsilon4 e do polimorfismo ACE-I/D sobre a cognição durante um seguimento de dois anos em pacientes com o primeiro AVC. Dement Geriatr Cogn Disord 2010; 29: 534-542.
- Baum L, Chen X, et al..: Polimorfismos e deficiência cognitiva vascular após acidente vascular cerebral isquémico. J Geriatr Psychiatry Neurol 2007; 20: 93-99.
- Póia GJ, Ford AH et al..: Efeito das vitaminas B e da diminuição da homocisteína no comprometimento cognitivo em doentes com AVC prévio ou ataque isquémico transitório: uma análise secundária pré-especificada de um ensaio aleatório, controlado por placebo e meta-análise. Stroke 2013; 44: 2232-2239.
- Karlsson H, Ahlborg B, et al..: Associação entre a taxa de sedimentação de eritrócitos e o QI em homens suecos de 18-20 anos. Brain Behav Immun 2010; 24: 868-873.
- Craft S: O papel das perturbações metabólicas na doença de Alzheimer e na demência vascular: duas estradas convergiram. Arch Neurol 2009; 66: 300-305.
- Eikelenboom P, van Exel E, et al: Neuroinflamação – um acontecimento inicial tanto na história como na patogénese da doença de Alzheimer. Neurodegener Dis 2010; 7: 38-41.
- Schram MT, Euser SM et al..: Marcadores sistémicos de inflamação e declínio cognitivo na velhice. J Am Geriatr Soc 2007; 55: 708-716.
- Hoth KF, Haley AP, et al..: A proteína C reativa elevada está relacionada com o declínio cognitivo em adultos idosos com doenças cardiovasculares. J Am Geriatr Soc 2008; 56: 1898-1903.
- Kliper E, Bashat DB et al: Declínio cognitivo após acidente vascular cerebral: relação com biomarcadores inflamatórios e volume hipocampal. AVC 2013; 44: 1433-1435.
- Rothenburg LS, Herrmann N, et al: A relação entre os marcadores inflamatórios e o défice cognitivo pós-acidente vascular cerebral. J Geriatr Psychiatry Neurol 2010; 23: 199-205.
- Tzourio C, Anderson C, et al..: Efeitos da diminuição da pressão arterial com a terapia de perindopril e indapamida na demência e declínio cognitivo em doentes com doença cerebrovascular. Arch Intern Med 2003; 163: 1069–1075.
- Collins R, Armitage J: Grupo Colaborativo de Estudo de Protecção do Coração. Efeitos da redução do colesterol com sinvastatina sobre o AVC e outros eventos vasculares importantes em 20536 pessoas com doença cerebrovascular ou outras condições de alto risco. Lancet 2004; 363: 757-767.
- Shepherd J, Blauw GJ, et al..: Pravastatina em indivíduos idosos em risco de doença vascular (PROSPER): um ensaio aleatório controlado. Lancet 2002; 360: 1623-1630.
- Kivipelto M, Solomon A, et al..: The Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability (FINGER): study design and progress. Alzheimers Dement 2013; 9: 657-665.
- Ngandu T, Lehtisalo J, et al..: Uma intervenção multidomínio de 2 anos de dieta, exercício, treino cognitivo, e monitorização do risco vascular versus controlo para prevenir o declínio cognitivo em idosos em risco (FINGER): um ensaio aleatório controlado. Lanceta. 2015 Jun 6; 385(9984): 2255-2263.
- Carrie I, van Kan GA, et al: Estratégias de recrutamento para ensaios preventivos. O estudo MAPT (MultiDomain Alzheimer Preventive Trial). J Nutr Saúde Envelhecimento 2012; 16: 355-359.
- Richard E, Van den Heuvel E, et al..: Prevenção da demência por cuidados vasculares intensivos (PreDIVA): um ensaio aleatorizado em curso. Alzheimer Dis Assoc Disord 2009; 23: 198-204.
InFo NEUROLOGIE & PSYCHIATRIE 2018; 16(1): 31–37