Cada operação pode levar a problemas com a circulação, o coração ou os pulmões no pós-operatório. Evitar tais complicações e o seu tratamento é de grande importância, pois caso contrário o risco perioperatório aumenta significativamente. Isto exige que uma equipa de tratamento de cirurgia torácica esteja consciente dos riscos intra e pós-operatórios e seja proficiente na gestão das complicações que surgem no processo.
Qualquer operação pode levar a problemas com a circulação, o coração ou os pulmões no pós-operatório. Evitar tais complicações e o seu tratamento é de grande importância, pois caso contrário o risco perioperatório aumenta significativamente. Isto exige que uma equipa de tratamento de cirurgia torácica esteja consciente dos riscos intra e pós-operatórios e seja proficiente na gestão das complicações que surgem no processo.

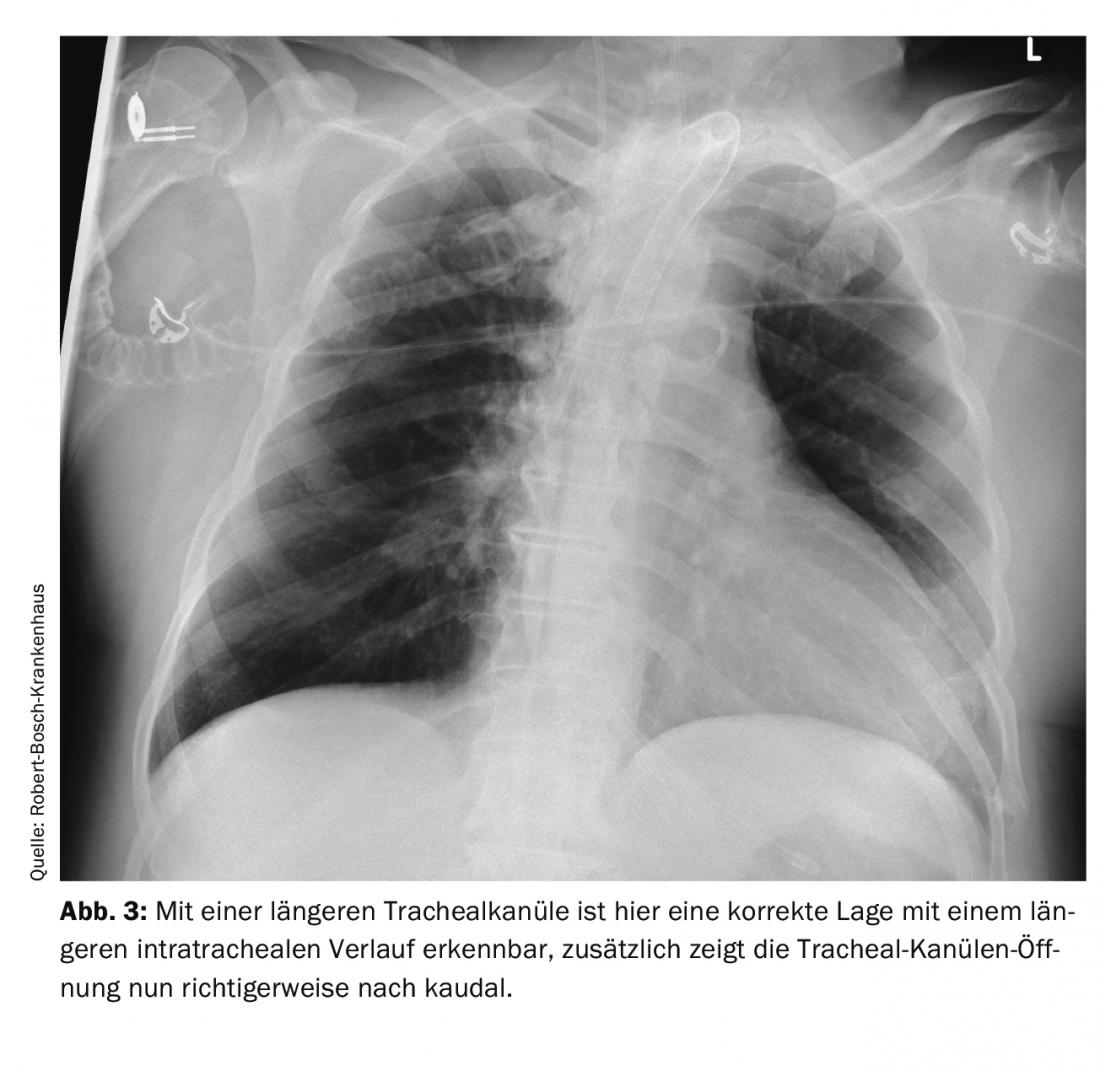
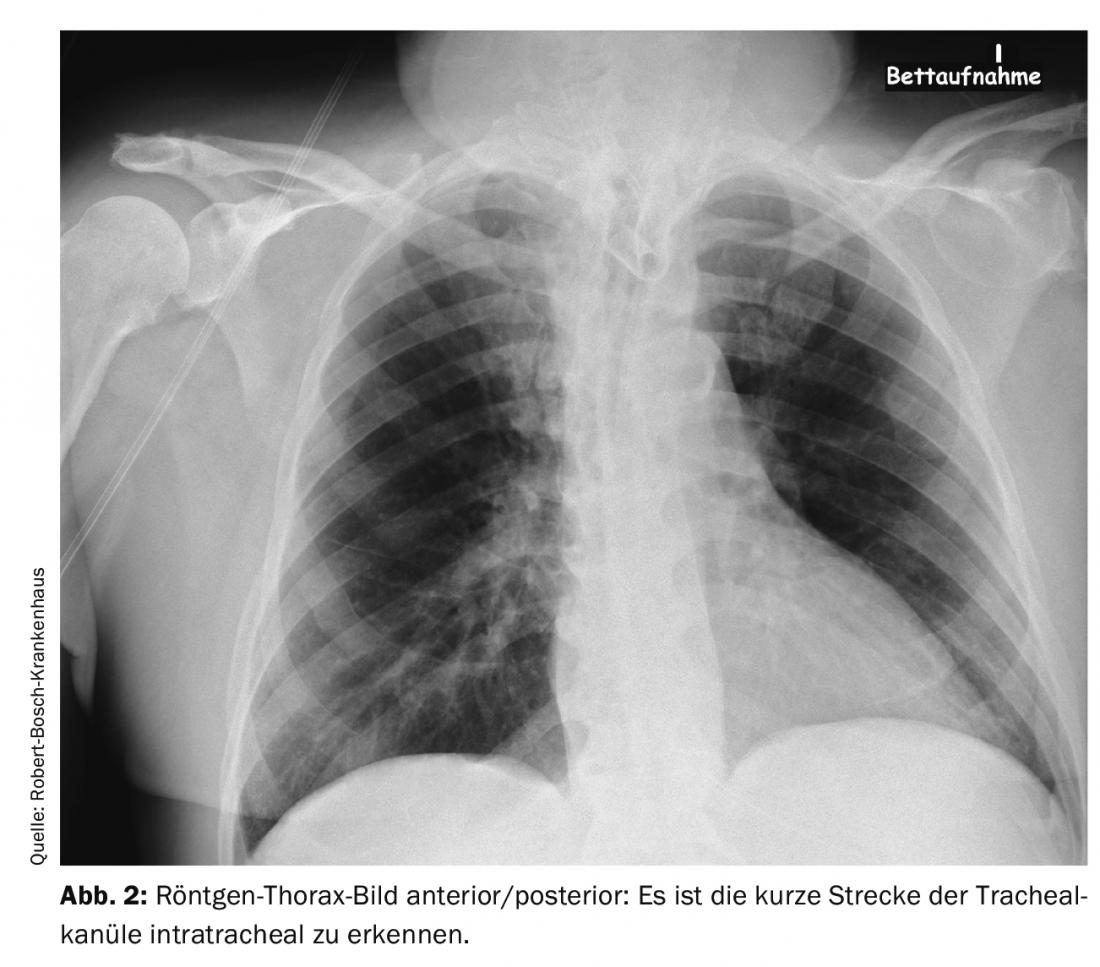
Mesmo um procedimento relativamente menor, tal como a criação de um traqueostoma, pode levar a que um paciente se encontre em perigo vital após o procedimento: Num paciente de 66 anos, foi tentada pela primeira vez uma traqueostomia dilatada. Como isto não teve sucesso, foi realizada uma traqueostomia plástica. Pouco tempo depois, o paciente foi transferido para outro hospital. Durante os dias seguintes, houve dificuldades recorrentes com a ventilação e hipercapnia. Pensava-se que a causa era o broncoespasmo e a descompensação relacionada com o stress devido à redução da sedação para desmame do ventilador. Os diagnósticos por imagem foram realizados várias vezes. A causa foi uma cânula traqueal mal posicionada. A cânula era demasiado curta e, portanto, só se encontrava com a ponta intratraqueal e com a abertura directamente na parede traqueal posterior. Isto levou a uma obstrução intermitente das vias aéreas. No raio-X – imagem do tórax e tomografia computadorizada do tórax, se conhecer os sinais, pode ver esta má posição. Nas imagens das figuras 1 e 2 pode ver-se a posição da cânula traqueal que se abre directamente na parede traqueal com a única distância curta intratraqueal e após correcção por uma cânula traqueal mais longa na figura 3. A forma mais fácil de detectar este problema é através do controlo traqueoscópico com um broncoscópio. Em tal situação, mesmo um problema facilmente corrigível pode levar a uma perturbação grave com hipoxia e hipercapnia se não se tiver cuidado com os pormenores do diagnóstico e, portanto, o problema real da perturbação das vias respiratórias não for reconhecido.
A fim de reduzir o risco de complicações pós-operatórias, os seguintes pontos devem ser sempre verificados quando um paciente é transferido para uma unidade de monitorização ou de cuidados intensivos após uma operação: consciência, profundidade de sedação, se necessário, se estão presentes reflexos protectores em pacientes extubados, parâmetros de respiração ou ventilação espontânea, posição do tubo ou cânula traqueal, ventilação lateral dos pulmões, posição e taxa de fluxo dos drenos torácicos, regulação da sucção nos drenos e parâmetros de circulação. Um procedimento padrão é útil aqui, por exemplo, um procedimento que utiliza o esquema ABCDE para verificar sinais vitais. Recomenda-se também uma entrega com medidas operacionais documentadas por escrito, as particularidades intra-operatórias e os problemas encontrados. Aqui, recomenda-se um protocolo de entrega com o conceito SBAR para evitar erros [1]. O ajuste da aspiração nos drenos torácicos é de particular importância. Se houver perda de ar no parênquima pulmonar, é necessária uma pressão negativa nos drenos da cavidade torácica para evitar o pneumotórax, mas uma sucção demasiado elevada pode aumentar a perda de ar. No caso de uma pneumectomia, o estabelecimento de uma sucção negativa (mais forte do que menos cinco mbar) está contra-indicado, uma vez que esta pressão negativa pode levar a um deslocamento do mediastino (efeito semelhante a um pneumotórax de tensão) e, portanto, a complicações cardiopulmonares graves. A hemorragia pós-operatória pode ser detectada pela quantidade de perda de drenagem, pela determinação da hemoglobina no sangue do paciente e, se necessário, no fluido de drenagem, pela imagem ultrassonográfica do espaço pleural e, em fases avançadas, por uma reacção circulatória devido à falta de volume. Se estas medidas não fornecerem informação suficiente, uma tomografia computorizada do tórax ajuda frequentemente. Para além de verificar os parâmetros de coagulação e, se necessário, tomar medidas para melhorar a coagulação, faz sentido informar o departamento cirúrgico/cirurgia torácica sobre uma eventual revisão cirúrgica necessária. Outras complicações mais raras cirurgicamente induzidas, tais como insuficiência brônquica do coto (reconhecível por volumes mais elevados de fístulas de ar através dos drenos torácicos) ou torção do retalho (primeiro sinal frequentemente uma atelectasia na imagem do tórax de raios X) podem ser frequentemente verificadas com uma broncoscopia e, se necessário, adicionalmente uma TAC (com meio de contraste para imagem vascular) e requerem uma revisão cirúrgica.
Pneumectomia com maior risco perioperativo
Nas grandes cirurgias torácicas, as perturbações respiratórias e cardíacas são mais frequentes perioperatoriamente. Por exemplo, após a pneumonectomia, o risco de enfarte do miocárdio ou morte cardiovascular nos primeiros 30 dias após a cirurgia é superior a 5% [2]. Por conseguinte, faz sentido esclarecer os factores de risco cardiopulmonar do paciente antes da operação e realizar sempre uma avaliação de risco. Para a lobectomia videotoracoscopicamente assistida, a classificação ASA tem sido descrita como um método útil [3]. Para uma avaliação geral do risco pré-operatório, a história médica, um exame físico, valores laboratoriais (com análise de gases sanguíneos) e imagens (raio-X torácico ou TAC) são úteis. Um ECG em repouso raramente fornece novos conhecimentos pré-operatórios, mas pode ser muito útil como comparação em problemas pós-operatórios causados por arritmias cardíacas ou isquemia. Exames funcionais tais como um electrocardiograma de exercício, uma espiroergometria, um teste de caminhada de 6 minutos, a estimativa do equivalente metabólico e a indicação de quantos pisos são possíveis ao andar têm um valor informativo significativamente melhor do que os chamados valores de repouso medidos. A cirurgia planeada, a cirurgia videotoracoscópica ou toracotomia, e quantos segmentos do pulmão são ressecados são outros factores na avaliação do risco perioperatório. A função pulmonar pós-operatória após ressecções pode ser estimada utilizando a seguinte fórmula: valor da função pré-operatória (por exemplo, VEF1) × número de segmentos pulmonares pós-operatórios / número de segmentos pulmonares pré-operatórios [4].
A fibrilação atrial ocorre com uma frequência de 13 – 46% em grandes cirurgias torácicas [5]. Em termos de cirurgia, a maior incidência é com uma pneumectomia. É também um factor que aumenta o risco global da cirurgia. A terapia depende do efeito sobre a circulação do paciente. Quanto mais instável for a circulação, mais provável é que a cardioversão seja útil e necessária no caso de um novo início de fibrilação atrial. A amiodarona é mais eficaz para a conversão do ritmo cardíaco. Se o objectivo é o puro controlo da taxa, os beta-bloqueadores e o digitalis são uma opção de tratamento. Além disso, é sempre aconselhável verificar os electrólitos (especialmente o nível de potássio) e, se necessário, substituir o potássio e o magnésio. Existem várias abordagens à terapia profiláctica com medicamentos, com beta-bloqueadores e amiodarona a revelarem-se os mais eficazes.
Saturação venosa central acima de 70% se possível
A insuficiência cardíaca intra ou pós-operatória deve ser diagnosticada rapidamente. A ecocardiografia transoesofágica intra-operatória (ETE) pode ser útil; no pós-operatório, sistemas semi-invasivos como a monitorização com o sistema Picco® ou a ecocardiografia trans-torácica (ETE) e, em determinadas circunstâncias, um exame ETE são úteis. A ecocardiografia também é boa na detecção de derrames pericárdicos hemodinamicamente eficazes e tamponamento pericárdico. O tratamento da insuficiência cardíaca grave (Índice cardíaco inferior a 1,5 l/min/m2 KÖF) é com catecolaminas, inibidores de fosfodiesterase-3 ou levosimedan. A insuficiência cardíaca direita é normalmente mais difícil de tratar do que a insuficiência cardíaca esquerda. Na insuficiência cardíaca direita, o aumento da resistência vascular pulmonar pode ser o problema; a terapia com por exemplo sildenafil ou epoprostenol inalado pode ser útil aqui. Se o estado volumétrico do paciente não for claramente identificável, poderá ser necessário um exame TTE ou uma imagem sonográfica da veia cava inferior. As medições ultra-sonográficas, os exames TTE e TEE são métodos dependentes da experiência do examinador e devem estar disponíveis para ressecções pulmonares prolongadas. Além disso, podem ser utilizadas técnicas de monitorização circulatória semi-invasiva para fornecer informações sobre o estado do volume, por exemplo, a variação do volume do AVC pode ser utilizada para avaliar o volume na presença do ritmo sinusal [6]. Um valor laboratorial simples para estimar um fornecimento adequado de oxigénio é a medição da saturação venosa central, este valor deve (com um valor normal de hemoglobina) ser preferencialmente superior a 70%. Pós-operatoriamente, monitorizar o estado do volume, equilibrando as importações e exportações. Demasiado volume prejudica principalmente a função pulmonar, muito pouco volume intravascular leva a problemas com a circulação e secundariamente a disfunções orgânicas. Normalmente os rins são afectados em primeiro lugar e em situações de deficiência de volume acentuada há um aumento do nível de lactato (principalmente devido ao aumento do metabolismo anaeróbico ou mais raramente devido à redução da degradação do fígado).
A hemorragia intra-operatória com choque hemorrágico deve ser evitada, se possível. O conhecimento dos riscos e a preparação para estes problemas é aqui de grande benefício. Durante uma mediastinoscopia, por exemplo, o risco de hemorragia grave é baixo, inferior a 1% [7]. No entanto, se houver uma grande perda de sangue, é extremamente útil estabelecer acessos venosos de 1 a 2 grandes lúmenes mesmo antes do início da operação. Para operações com maior risco de hemorragia, deve ser fornecido um número apropriado de concentrados de eritrócitos compatíveis para o receptor, dependendo do nível de hemoglobina antes da operação. É sempre recomendado um conceito de “Gestão do Sangue dos Pacientes”.
A incidência de insuficiência respiratória aguda após uma grande cirurgia torácica é relatada na literatura como sendo entre 2-7% [8]. A mortalidade por insuficiência respiratória grave nas primeiras 48 horas após uma pneumectomia varia de 26% a 80%, dependendo da literatura. O principal problema reside na troca de gás, que está agora limitada a apenas um pulmão. Se esta função for prejudicada, o paciente entra muito rapidamente em áreas vitais perigosas de hipercapnia e hipoxia. Por conseguinte, é importante determinar o fornecimento de volume com precisão e muitas vezes limitar o fornecimento de volume em quantidade. O trauma da operação, a anestesia, a dor, etc., levam a um comprometimento da função pulmonar no pós-operatório. Broncoconstrição, secreção e aspiração favorecem a formação de atelectasias e pneumonia. A ventilação intra-operatória durante a ventilação de um único pulmão com volumes correntes reduzidos (5 ml/kgKG) e PEEP moderado (5 – 8 cm H2O) pode melhorar as trocas gasosas pós-operatórias e reduzir os riscos [9]. A mobilização precoce (fora do leito), a fisioterapia e respiratória e a boa gestão da dor (por exemplo, com um cateter peridural torácico) melhoram a situação [10]. Ventilação não invasiva, aspiração broncoscópica em respiração espontânea, ventilação invasiva com posicionamento abdominal se necessário e, no caso de um curso prolongado, uma traqueostomia são medidas necessárias para o tratamento no caso de trocas gasosas pulmonares e atelectasias significativamente restritas.
O risco de pneumonia aumenta com a duração da ventilação
O risco de pneumonia aumenta proporcionalmente à duração da ventilação invasiva [11]. Para a maioria dos pacientes após a cirurgia torácica, a restauração rápida da respiração espontânea e a extubação precoce são úteis. No entanto, se uma hipercapnia relevante para o pH, uma oxigenação insuficiente, uma circulação instável ou, após uma atelectasia prolongada de um pulmão, uma ventilação insuficiente do segmento pulmonar afectado puder ser alcançada, é aconselhável uma ventilação pós-operatória. Em doentes com doença pulmonar obstrutiva crónica pronunciada, pode por vezes ser necessário extubar e fornecer apoio precoce à mecânica respiratória com ventilação não invasiva, apesar dos níveis elevados de paCO2 (se estiverem presentes reflexos protectores, a consciência adequada e a cooperação do doente estão disponíveis). Se um tubo de duplo lúmen for utilizado intra-operatoriamente, recomenda-se mudar para um tubo normal no pós-operatório, a fim de reduzir a irritação causada pela posição do tubo endobrônquico e de conseguir uma melhor gestão da secreção. Se houver ou tiver havido uma dificuldade na intubação orotraqueal, recomenda-se a utilização de uma “vareta de cozedura” (cateter de troca de via aérea) quando se muda o tubo.
O posicionamento de pacientes entubados com a parte superior do corpo elevada em cerca de 40° reduz a incidência de pneumonia associada à ventilação mecânica. Os cuidados orais regulares e o controlo regular da pressão do punho também são úteis. Após a ocorrência de pneumonia, são necessárias determinações microbiológicas de amostras (a partir das secreções traqueais ou brônquicas, sempre antes do início da antibioticoterapia) e antibioticoterapia suficiente. Devem ser esperados agentes patogénicos Gram-positivos e Gram-negativos; menos frequentemente, os fungos ou agentes patogénicos atípicos são os desencadeadores da pneumonia. A terapia antibiótica pode precisar de ser adaptada ao espectro patogénico específico do hospital. Durante a terapia, deve ser dada atenção a uma dosagem adequada e à duração correctamente seleccionada da terapia. Na maioria dos casos, uma duração terapêutica de uma semana é suficiente. Os doentes submetidos a tratamento imunossupressor ou neoadjuvante têm um risco acrescido de infecção e são mais difíceis de tratar. Muitas vezes, os doentes com pneumonia também beneficiam de broncoespasmólise com medicação e terapia respiratória sistemática.
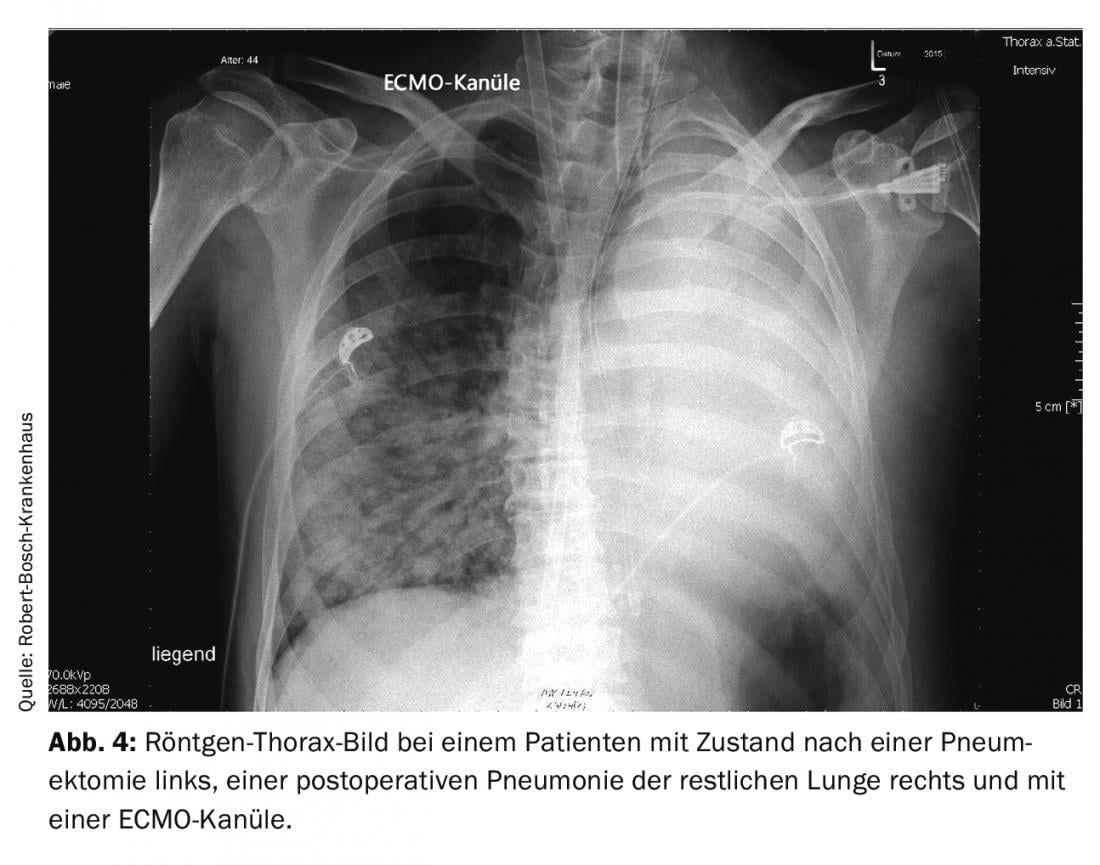
Se todas as medidas convencionais falharem em caso de falha pulmonar, poderá ser necessária terapia com oxigenação de membrana extracorporal veno-venosa (ECMO). Num doente com uma condição pós-pneumectomia, a pneumonia no pulmão restante pode rapidamente tornar-se uma ameaça à vida devido à redução cirurgicamente induzida da área de superfície de troca de gases. Se as condições gerais estiverem correctas (sem contra-indicações e um paciente suficientemente estável nas outras funções vitais), a terapia ECMO pode trazer vantagens claras em tal curso. A figura 4 mostra um raio-X de um paciente de 44 anos com pneumonia após pneumectomia e uma cânula ECMO colocada através da veia jugular interna direita. Neste caso, a terapia com ECMO foi concluída com sucesso após dez dias. Como este procedimento extracorporal não é isento de riscos, deve haver uma indicação clara para este tratamento e deve haver experiência suficiente com este procedimento na equipa de tratamento. A anticoagulação necessária, as lesões causadas pela colocação dos cateteres de grande lúmen e uma infecção nosocomial são os principais riscos do procedimento.
O edema de reexpansão do pulmão como causa adicional de perturbação das trocas gasosas pós-operatórias pode ocorrer após o alívio de um grande derrame pleural ou de um pneumotórax pronunciado e também após ventilação pulmonar simples (separação pulmonar através de tubo de duplo lúmen ou bloqueador de brônquios) durante um longo período de tempo. Assume-se um processo multifactorial como sendo a causa fisiopatológica. O desenvolvimento da acumulação de fluidos no interstício e nos alvéolos devido ao aumento da permeabilidade dos fluidos é suposto ser causado pela libertação de mediadores, perda do tensioactivo e danos na membrana alveolar por oxidases. Patofisiologicamente semelhante é o edema pós-pneumectomia, que ocorre 24 -72 horas após a pneumonectomia ou raramente após a lobectomia. O tratamento consiste na ingestão restritiva de líquidos, ventilação não invasiva ou invasiva com PEEP e aumento da concentração inspiratória de oxigénio, que é normalmente necessária. Está associada a uma mortalidade significativa, semelhante à SDRA grave, e infelizmente pode ocorrer mesmo com uma ingestão de líquidos muito reduzida perioperatoriamente.
Em geral, é necessário um acompanhamento atento, um reconhecimento rápido e correcto e um tratamento rápido no caso das doenças vitais ameaçadoras mencionadas. Isto torna possível alcançar um bom resultado para o paciente, mesmo em procedimentos que estão associados a um risco perioperatório considerável.
Mensagens Take-Home
- Uma avaliação do risco perioperatório para mortalidade e letalidade ajuda a evitar complicações pós-operatórias em grandes cirurgias torácicas. Os testes funcionais sistemáticos são aqui úteis.
- As complicações respiratórias e cardíacas ocorrem com frequência relevante durante estes procedimentos.
- A monitorização circulatória semi-invasiva ou invasiva é recomendada para condições cardiovasculares instáveis; os valores da tensão arterial e do ritmo cardíaco por si só são frequentemente insuficientes.
- Mobilização, elevação da parte superior do corpo, terapia respiratória e fisioterapia, juntamente com ambientes ventilatórios, são pedras angulares da prevenção e tratamento de complicações respiratórias. Na maioria dos casos, a respiração espontânea precoce e a extubação rápida são úteis para estes pacientes.
- Em situações individuais, a terapia ECMO pode ser necessária no pós-operatório.
Literatura:
- von Dossow V, Zwißler B: Transferência de doentes estruturada na fase perioperatória – O conceito SBAR. Anaesth Intensivmed 2016; 57: 88-90.
- Kristensen SD, Knuuti J, Saraste A, et al: 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur J Anaesthesiol 2014; 31(10): 517-573.
- Zhang R, Kyriss T, Dippon J, et al: G. American Society of Anesthesiologists status físico facilita a estratificação do risco de pacientes idosos submetidos a lobectomia toracoscópica. Eur J Cardiothorac Surg 2018; 53(5): 973-979.
- Smulders SA, Smeenk FW, Janssen-Heijnen ML, et al: Alterações pós-operatórias reais e previstas na função pulmonar após pneumonectomia: Uma análise retrospectiva. Peito 2004; 125: 1735-1741.
- Zhao BC, Huang TY, Deng QW, et al: Profilaxia contra a Fibrilação Atrial após Cirurgia Torácica Geral: Análise Sequencial de Ensaios e Meta-Análise de Rede. Peito 2017; 151(1): 149-159.
- Hansen M: Monitorização hemodinâmica – Monitorização avançada [Invasive and minimally invasive hemodynamic monitoring]. Anasthesiol Intensivmed Notfallmed Schmerzther 2016; 51(10): 616-625.
- Schirren M, Sponholz S, Oguhzan S, et al: Sangramento intra-operatório durante cirurgia torácica: estratégias de prevenção e conceitos de tratamento cirúrgico]. Chirurg 2015; 86(5): 453-458.
- Kösek V, Wiebe K: Insuficiência respiratória pós-operatória e seu tratamento [Postoperative respiratory insufficiency and its treatment]. Cirurgião 2015; 86(5): 437-443.
- Marret E, Cinotti R, Berard L, et al: A ventilação protectora durante a anestesia reduz as principais complicações pós-operatórias após a cirurgia do cancro do pulmão: um ensaio aleatório controlado duplamente cego. Eur J Anaesthesiol 2018; 35(10): 727-735.
- Rogers LJ, Bleetman D, Messenger DE, et al: The impact of enhanced recovery after surgery (ERAS) protocol compliance on morbidity from resection for primary lung cancer. J Thorac Cardiovasc Surg 2018; 155(4): 1843-1852.
- Wunder C: Infecções nosocomiais nos cuidados intensivos. Anesth Intensivmed 2020; 61: 215-222.
InFo PNEUMOLOGIA & ALERGOLOGIA 2021; 3(1): 9-13