O uso de antibióticos de forma poupada e orientada ajuda a minimizar o risco de resistência aos antibióticos. Cada administração de antibióticos deixa também danos colaterais no nosso microbioma. Em geral, a terapia deve ser tão curta quanto necessário e tão alta doseada quanto possível.
Os antibióticos ajudaram a tornar as doenças infecciosas que costumavam ser graves e muitas vezes fatais e tratáveis, perdendo assim o seu antigo horror. Por exemplo, em comparação com a era pré-antibiótica, a mortalidade da pneumonia foi reduzida de cerca de 23% para cerca de 7%, a da endocardite de 100% para 25% e a da meningite bacteriana de >80% para <20% [1]. A introdução de antibióticos trouxe um impulso de desenvolvimento à medicina moderna de alto desempenho. Sem antibióticos eficazes, os cuidados intensivos, a cirurgia, especialmente endopróteses e transplantes, bem como as quimioterapias, são inconcebíveis [2].
Resistência antibiótica
Após a introdução de um novo antibiótico, normalmente são necessários apenas alguns anos para que as bactérias se tornem resistentes a ele. Os antibióticos exercem pressão de selecção sobre as variantes de bactérias resistentes pré-existentes, que têm assim uma vantagem de sobrevivência sobre as bactérias sensíveis e se enriquecem.
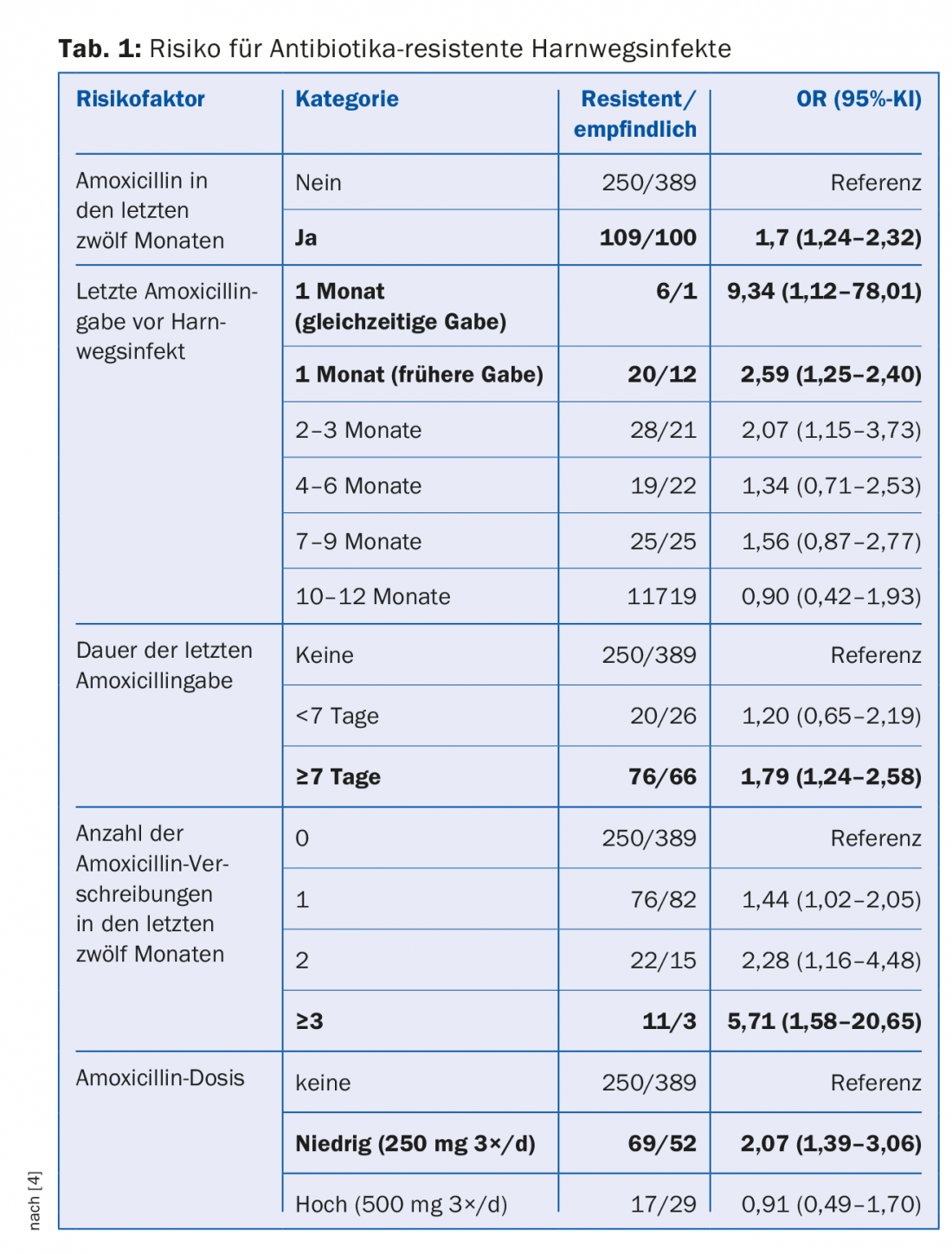
A resistência aos antibióticos está presente na natureza há milhões de anos, mas é claramente o uso de antibióticos na agricultura e na medicina, em última análise humana, que é a força motriz. Quanto mais antibióticos forem prescritos numa população, maior será o risco de bactérias resistentes aos antibióticos [3]. Num estudo de caso-controlo de doentes com infecções do tracto urinário, foram encontrados vários factores de risco: administração frequente de antibióticos, longa duração da terapia, dose baixa (Tab. 1) [4]. O risco de colonização com pneumococos resistentes à penicilina aumentou 4% nas crianças australianas por cada dia que tinham recebido antibióticos β-lactam nos seis meses anteriores [5]. Aproximadamente 60-90% dos antibióticos humanos são prescritos no sector ambulatório e destes, aproximadamente 75-85% são prescritos para infecções respiratórias virais comuns. No entanto, globalmente cerca de 80% de todos os antibióticos são utilizados na pecuária, principalmente como “promotores de crescimento” para engorda de gado.
A resistência aos antibióticos pode surgir e propagar-se de diferentes formas. Podem ser intrínsecos (ou seja, uma bactéria é sempre resistente a este antibiótico), surgir de novo por mutação espontânea e tornar-se seleccionados devido à pressão de selecção exercida pelo antibiótico, ser transferidos de uma bactéria para outra por transferência horizontal de genes (por exemplo, por meio de plasmídeos, que frequentemente contêm diferentes genes de resistência ao mesmo tempo) e também ser transmitidos entre pacientes por má higiene (das mãos).
A resistência aos antibióticos tem consequências relevantes, tais como o aumento da mortalidade, estadias hospitalares mais longas e custos mais elevados (visão geral 1) . As previsões sombrias prevêem um aumento de aproximadamente 25.000 mortes na UE e aproximadamente 700.000 em todo o mundo devido a infecções com agentes patogénicos resistentes a antibióticos em 2014 para até 390.000 e 10 milhões, respectivamente, em 2050. Receia-se que isto seja um retrocesso para uma era pré-antibiótica com infecções intoleráveis – já uma realidade em muitos países – e custos indirectos de um inimaginável 100 triliões de dólares americanos (amr-review.org).

Na Suíça, os dados sobre a resistência aos antibióticos são recolhidos com vigilância nacional e podem ser consultados em www.anresis.ch numa base de dados interactiva. Aqui, podem ser vistos êxitos consideráveis na contenção do Staphylococcus aureus resistente à meticilina (MRSA). Menos de 3% dos pneumococos são resistentes à penicilina, em parte devido à vacinação pneumocócica em crianças. Infelizmente, a resistência aos antibióticos está a espalhar-se constantemente entre os agentes patogénicos Gram-negativos, especialmente através das beta-lactamases de espectro alargado (ESBL), que são cada vez mais responsáveis por infecções abdominais e do tracto urinário. Por exemplo, cerca de 10% de todos os Escherichia coli na Suíça são formadores de ESBL e cerca de 20% são resistentes à ciprofloxacina.
Efeitos dos antibióticos sobre o microbioma
Além da selecção da resistência, efeitos secundários indesejáveis, reacções alérgicas e custos dos medicamentos, cada utilização de antibióticos tem um impacto relevante na nossa microbiota (totalidade de todos os organismos do nosso organismo) e no nosso microbioma (microbiota bem como o seu genoma) que dura até vários anos [6]. O mais conhecido é a predisposição após antibióticos para adiarreia associada ao Clostridium difficile, mas os antibióticos também aumentam o risco de, entre outras coisas, sepsis no curso, o desenvolvimento de obesidade, diabetes mellitus, asma e alergias [7]. A maior influência é sobre o desenvolvimento da microbiota da criança, razão pela qual se deve prestar atenção ao uso mais restritivo possível de antibióticos, particularmente em mulheres grávidas e crianças (especialmente nos primeiros dois anos de vida) [8].
Acima de tudo, as bactérias anaeróbias da flora do local no cólon contribuem para uma resistência à colonização por agentes patogénicos, razão pela qual a terapia antibiótica dirigida contra os anaeróbios predispõe a outras infecções. É interessante notar que após uma viagem a uma área endémica, o risco de nova colonização com Enterobacteriaceae multi-resistente em comparação com viajantes saudáveis era duas vezes maior em pessoas que tiveram diarreia durante a viagem e mais de quatro vezes maior em pessoas que tomaram um antibiótico β-lactam durante a viagem (disbiose da flora intestinal) [9]. Este é um argumento importante contra uma profilaxia antibiótica demasiado generosa contra a diarreia dos viajantes.
Regras básicas para o uso de antibióticos
Os seguintes aspectos devem ser tidos em conta com qualquer terapia antibiótica:
Indicação: Qualquer administração de antibióticos só deve ser feita após indicação rigorosa. A utilização de biomarcadores pode ser útil para isso. Como o risco de infecção bacteriana está correlacionado com o nível de procalcitonina (PCT), sem aumento do risco de complicações, a utilização de algoritmos de PCT pode reduzir o consumo de antibióticos em 35-45% nos doentes com uma exacerbação da doença pulmonar obstrutiva crónica (DPOC) e em aproximadamente 65% nos doentes com infecções do tracto respiratório superior [10]. Em doentes com sintomas virais típicos em infecções do tracto respiratório superior ou bronquite aguda (conjuntivite, rinite, artralgia, exantema), os antibióticos devem ser evitados. Um estudo britânico mostrou que a utilização restritiva de antibióticos para infecções das vias respiratórias superiores poderia poupar mais de 2000 prescrições de antibióticos durante dez anos, numa prática com 7000 doentes por ano [11]. Complicações temíveis ocorrem muito raramente como resultado (cerca de dez episódios de pneumonia e menos de um abcesso peritonsilar ao longo de dez anos). Deve-se notar que as vias respiratórias superior e inferior não são estéreis e, portanto, a detecção de bactérias não indica automaticamente a terapêutica antibiótica.
A bacteriúria assintomática só deve ser procurada durante a gravidez e antes de procedimentos urológicos que envolvam lesões mucosas, e só então deve ser tratada com antibióticos. Caso contrário, a antibioticoterapia em bacteriúria assintomática está associada a um risco acrescido de desenvolvimento de pielonefrite (presumivelmente novamente através da disbiose da microbiota) e a um maior desenvolvimento de resistência [12,13]. O mesmo se aplica aos utilizadores assintomáticos de cateteres permanentes, que têm uma taxa de colonização de cerca de 8%/d, o que não deve conduzir a uma terapia antibiótica na ausência de sintomas claros.
A sinusite aguda tem normalmente uma etiologia viral. Apenas 0,5-2% dos adultos e até 5% das crianças desenvolvem uma superinfecção bacteriana. Os antibióticos só são recomendados para sintomas persistentes ou falta de melhoria após pelo menos dez dias, sintomas graves (febre ≥39°C ou expectoração purulenta) durante pelo menos três a quatro dias, ou agravamento ou curso bifásico após pelo menos três a quatro dias. O tratamento de escolha é amoxicilina 1 g a cada oito horas durante cinco a sete dias; em casos graves ou com factores de risco, amoxicilina/ácido clavulânico 1 g a cada doze horas durante cinco a sete dias.
A antibioticoterapia imediata só é indicada para otites médias agudas bilaterais (AOM) em crianças com menos de dois anos de idade ou AOM perfurada. Caso contrário, recomenda-se “espera vigilante” durante 24-48 horas em crianças com menos de dois anos de idade ou 48-72 horas em pessoas com mais de dois anos de idade, uma vez que a terapia antibiótica tem pouco efeito na duração dos sintomas ou na taxa de complicações no AOM, que normalmente é inicialmente viral. A terapia de escolha é a amoxicilina, em caso de recaída ou falta de resposta após 72 horas de amoxicilina/ácido clavulânico.
Em doentes com mais de três anos de idade, a pontuação Centor (um ponto cada para o exsudado nas amígdalas; febre >38°C; gânglios linfáticos anteriores cervicais dolorosos e inchados; ausência de tosse) deve ser calculada se houver suspeita de faringite não-viral. Apenas se isto resultar em ≥3 pontos deverá ser realizado um teste rápido para Streptococcus pyogenes. E apenas se isto for positivo, a antibioticoterapia deve ser iniciada dentro de nove dias para minimizar o risco de febre reumática aguda. A terapia de escolha é amoxicilina 1 g a cada doze horas durante seis dias (até agora, S. pyogenes é sempre sensível à penicilina, mas a amoxicilina tem uma biodisponibilidade superior à penicilina).
Vários estudos recentes demonstraram que, na diverticulite aguda sem complicações, a terapia antibiótica não é melhor do que placebo em termos de alívio dos sintomas, taxa de complicações, necessidade de cirurgia e taxa de recidivas [14].
Na gastroenterite aguda (diarreia vómita/diarreia aquática) sem febre com/sem antecedentes de viagem, a terapia sintomática é geralmente suficiente. Os antibióticos só devem ser utilizados em casos de diarreia sanguínea ou febril ou de toxicidade sistémica.
Espectro de agentes patogénicos: Qualquer terapia antibiótica empírica deve ter em conta o espectro patogénico esperado. Tanto os agentes patogénicos mais comuns como alguns agentes patogénicos raros associados a um curso particularmente severo devem ser tratados. Dependendo da infecção, é indicado um diagnóstico microbiológico patogénico. Se for detectado um agente patogénico, a terapia deve ser cónica (desescalonamento). Isto é feito em particular para minimizar possíveis danos colaterais ao microbioma e à selecção da resistência aos antibióticos. Por exemplo, foi demonstrado que os pacientes com pneumonia pneumocócica bacterémica tiveram uma mortalidade mais baixa quando descalibrados para a penicilina ou monoterapia com amoxicilina durante o curso [15].
Modo de administração: Os antibióticos com elevada biodisponibilidade oral devem ser administrados principalmente por via oral, por exemplo trimetoprim-sulfametoxazol, metronidazol, clindamicina, quinolonas. As excepções são pacientes em que a absorção enteral é prejudicada ou infecções que requerem níveis muito elevados no local de acção (por exemplo, infecções muito graves, infecções endovasculares, infecções ósseas iniciais, infecções do SNC).
Dosagem: A dose depende da concentração inibitória mínima (MIC) do agente patogénico, da carga germinal, da gravidade da infecção, dos níveis de tecido a esperar (na sua maioria baixos na próstata, SNC) e da gama terapêutica do antibiótico (alta para os antibióticos de β-lactam, baixa para os aminoglicosídeos). A dose inicial deve ser escolhida o mais alta possível, uma vez que a maior carga germinativa está aqui presente e uma dose de carga é frequentemente também necessária para atingir níveis activos suficientes o mais rapidamente possível. As dosagens ideais são frequentemente superiores às recomendadas no compêndio (ver, por exemplo, www.guidelines.ch). Em caso de insuficiência hepática ou renal, pode ser necessária uma extensão do intervalo, mas a dose de carga permanece a mesma. β-lactam antibióticos (penicilinas, cefalosporinas) têm um efeito dependente do tempo no qual o nível activo deve permanecer acima do MIC do agente patogénico durante o máximo de tempo possível através da dosagem o mais frequente possível (intervalos curtos). Em contraste, os macrolídeos, aminoglicosídeos ou quinolonas têm um efeito dependente da concentração e alcançam um efeito óptimo em concentrações máximas elevadas. Para estes antibióticos, a dose deve ser tão alta quanto possível com um longo intervalo de dose.
Duração: A duração da terapia deve ser tão longa quanto necessário e tão curta quanto possível. O pano de fundo é que deve ser exercida a menor pressão de selecção possível para o aparecimento e propagação da resistência aos antibióticos. Este conceito está também a ganhar cada vez mais atenção a nível internacional, e na maioria das infecções relevantes para a prática geral, a curta duração da terapia está agora bem estabelecida. Deve ser feita aqui referência a dois artigos de muito boa síntese [16,17]. Visão Geral 2 fornece uma visão geral.

História de alergias: De todas as alergias a antibióticos, a alergia à penicilina é a mais comum nos doentes. Contudo, provavelmente menos de 10% destes doentes têm uma verdadeira alergia à penicilina e em menos de 2% os doentes verdadeiramente alérgicos à penicilina têm uma alergia cruzada às cefalosporinas de terceira geração [18]. Note-se que as penicilinas e outros antibióticos β-lactam são normalmente a classe de substâncias mais eficaz e a sua retenção devido a uma suposta alergia leva ao aumento da morbilidade e mortalidade dos doentes “rotulados” desta forma. Por conseguinte, as alergias devem ser sempre diferenciadas das reacções adversas e a suspeita de uma alergia a antibióticos deve ser esclarecida a nível alergológico.
Reparação da microbiota danificada: Tal como um cirurgião é responsável pela sua ferida, as consequências (especialmente a selecção da resistência e os danos colaterais no que diz respeito ao microbioma) também devem ser consideradas com cada prescrição de antibióticos. O objectivo deve ser o de minimizar ou “compensar” os mesmos. Contudo, os estudos futuros devem primeiro fornecer as provas sobre qual o probiótico que melhor se adequa a cada situação. Várias espécies de Lactobacillus e Bifidobacillus, que estão contidas em vários iogurtes ou suplementos alimentares comercialmente disponíveis, são recomendados para restaurar a microbiota danificada por antibióticos [6].
Mensagens Take-Home
- 60-90% dos antibióticos são prescritos na prática e destes, cerca de 75-85% são para infecções respiratórias na sua maioria viróticas.
- Para cada terapia antibiótica, devem ser considerados os seguintes aspectos: Indicação, espectro patogénico esperado, modo de aplicação, dosagem, duração.
- A utilização de antibióticos da forma mais parcimoniosa e selectiva possível ajuda a minimizar o risco de desenvolvimento de resistência aos antibióticos, efeitos secundários, alergias e custos.
- Cada administração de antibióticos deixa danos colaterais no nosso microbioma com efeitos múltiplos e ainda incompletamente conhecidos sobre o risco de várias doenças (diarreia associada ao Clostridium difficile, sepsis, obesidade e síndrome metabólico, alergias, etc.).
- Regra geral da terapia antibiótica: Tão curta quanto necessário e uma dose tão alta quanto possível.
Literatura:
- Spellberg B, et al: Combater a resistência antimicrobiana: recomendações políticas para salvar vidas. Clin Infect Dis 2011; 52(Suppl 5): S397-428.
- Marston HD, et al: Resistência antimicrobiana. JAMA 2016; 316(11): 1193-1204.
- Albrich WC, Monnet DL, Harbarth S: Pressão de selecção antibiótica e resistência em Streptococcus pneumoniae e Streptococcus pyogenes. Emergente Infect Dis 2004; 10(3): 514-517.
- Hillier S, et al: antibióticos anteriores e risco de infecção do tracto urinário adquirido pela comunidade resistente aos antibióticos: um estudo de caso-controlo. J Antimicrob Chemother 2007; 60(1): 92-99.
- Nasrin D, et al: Effect of beta lactam antibiotic use in children on pneumococcal resistance to penicillin: prospective cohort study. BMJ 2002; 324(7328): 28-30.
- Kahlert C, Müller P: Microbioma – a descoberta de um órgão. Swiss Med Forum 2014; 14(16-17): 342-344.
- Willing BP, Russell SL, Finlay BB: Shifting the balance: antibiotic effects on host-microbiota mutualism. Nat Rev Microbiol 2011; 9(4): 233-243.
- Blaser MJ: A teoria do desaparecimento da microbiota e as epidemias de doenças crónicas. Nature reviews Immunology 2017; 17(8): 461-463.
- Ruppe E, et al: Alta Taxa de Aquisição mas Curta Duração de Transporte de Enterobactérias Multi-Resistentes após Viagem aos Trópicos. Clin Infect Dis 2015; 61(4): 593-600.
- Schuetz P, et al.: Less is more: antibiotic therapy individualised by measuring procalcitonin. Swiss Med Forum 2012; 12(46): 887-892.
- Gulliford MC, et al: Segurança da prescrição de antibióticos reduzidos para infecções autolimitadas do tracto respiratório nos cuidados primários: estudo de coorte utilizando registos de saúde electrónicos. BMJ 2016; 354: i3410.
- Cai T, et al: O papel da bacteriuria assintomática em mulheres jovens com infecções recorrentes do tracto urinário: tratar ou não tratar? Clin Infect Dis 2012; 55(6): 771-777.
- Cai T, et al: O tratamento de bacteriúria assintomática está associado a uma maior prevalência de estirpes resistentes a antibióticos em mulheres com infecções do tracto urinário. Clin Infect Dis 2015; 61(11): 1655-1661.
- Chabok A, et al: Ensaio clínico aleatório de antibióticos em diverticulite aguda não complicada. The British journal of surgery 2012; 99(4): 532-539.
- Cremers AJ, et al: Efeito da racionalização dos antibióticos no resultado do paciente na bacteremia pneumocócica. J Antimicrob Chemother 2014; 69(8): 2258-2264.
- Llewelyn MJ, et al: O curso de antibióticos já teve o seu dia. BMJ 2017; 358: j3418.
- Dawson-Hahn EE, et al: tratamento com antibióticos orais de curta duração versus longa duração para infecções tratadas em regime ambulatório: uma revisão de revisões sistemáticas. Prática familiar 2017; 34(5): 511-519.
- Trubiano JA, Adkinson NF, Phillips EJ: A alergia à penicilina não é necessária para sempre. JAMA 2017; 318(1): 82-83.
PRÁTICA DO GP 2018; 13(4): 11-14