Estima-se que aproximadamente 1,8 milhões de neurónios são perdidos por minuto no decurso de danos isquémicos causados por um fornecimento de sangue reduzido. Assim, no caso de um AVC agudo, as coisas têm de acontecer rapidamente. Os diagnósticos por imagem de emergência permitem um diagnóstico precoce e têm uma influência decisiva na terapia.
A cada 30 minutos, alguém na Suíça sofre um AVC. Cerca de 25% das pessoas afectadas morrem devido às consequências imediatas, e cerca de um terço permanece incapacitado em graus variáveis ao longo das suas vidas [1]. Em 87% dos casos, um AVC é o resultado de uma redução aguda do fornecimento de sangue no contexto de uma oclusão de um vaso tromboembólico ou de uma estenose vascular hemodinamicamente relevante, e em 13% o resultado de uma hemorragia intracraniana ou subaracnoídea [2]. Estima-se que aproximadamente 1,8 milhões de neurónios são perdidos por minuto no decurso de danos isquémicos causados por um fornecimento de sangue reduzido [3]. No caso de um AVC agudo, as coisas têm de ser feitas rapidamente, e são necessários esclarecimento e terapia diagnóstica imediata. Os diagnósticos por imagem de emergência permitem um diagnóstico precoce e têm uma influência decisiva na terapia.
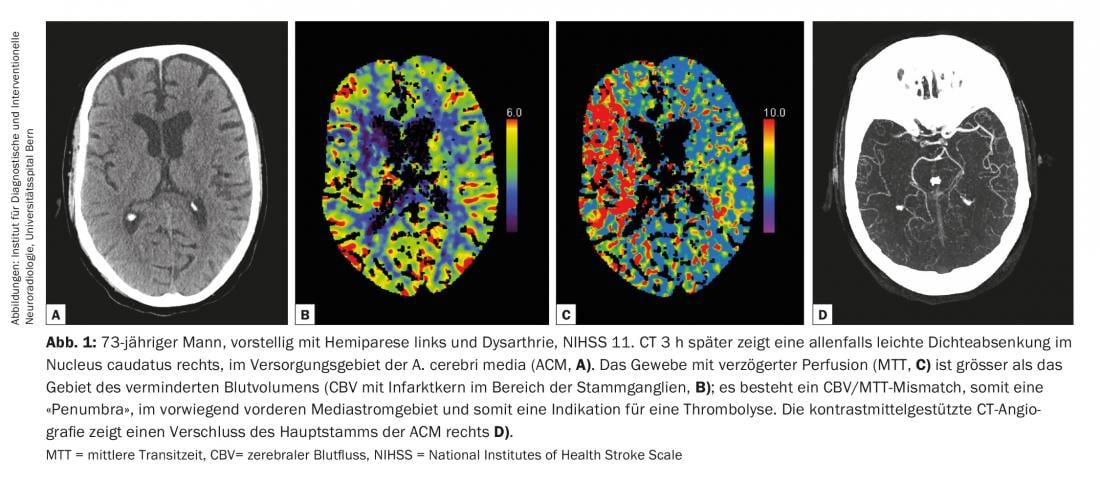
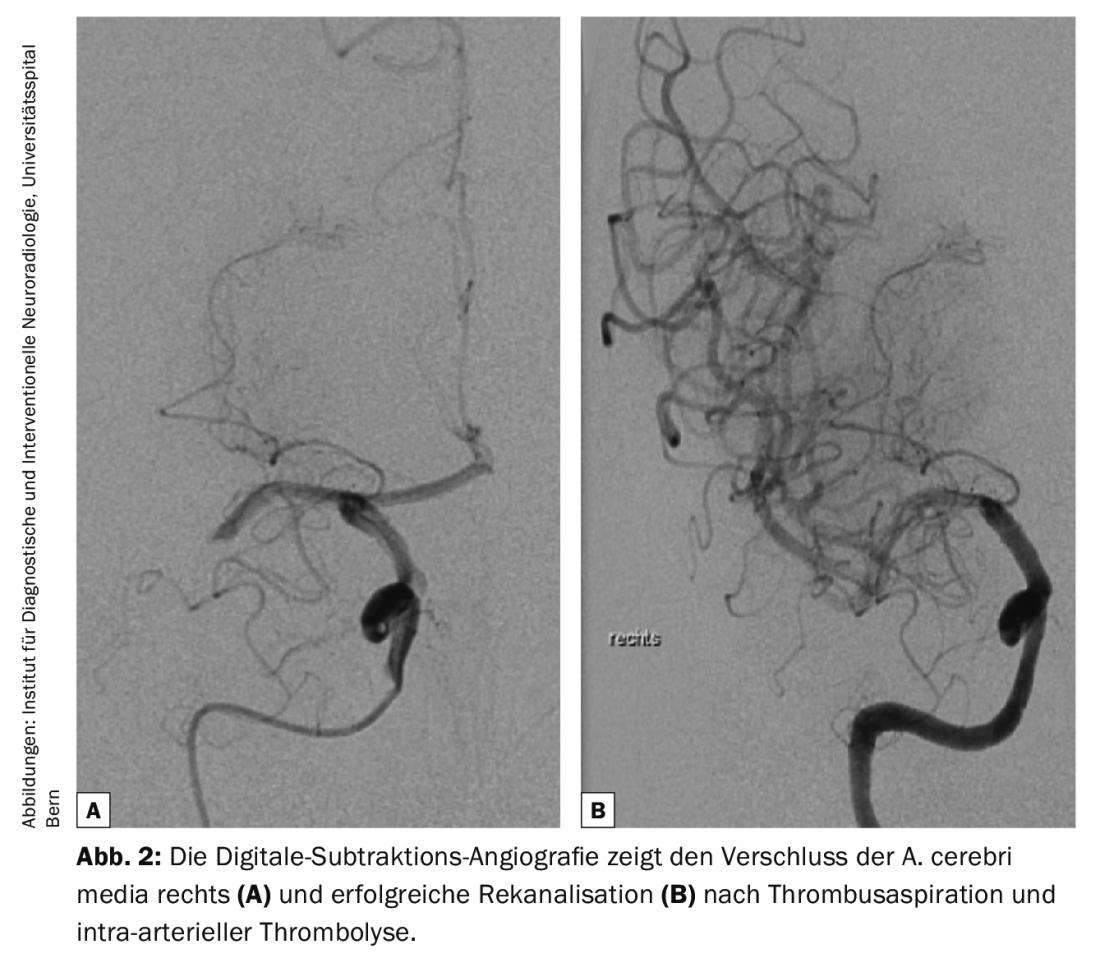
As directrizes de diagnóstico de doenças cerebrovasculares são continuamente actualizadas pelo American College of Radiology (ACR) e pela American Heart Association/American Stroke Association (AHA/ASA) [2,4]. Todas as modalidades desde a tomografia computorizada (TC) e a ressonância magnética (RM) à ultra-sonografia (US) e a angiografia de subtracção digital (DSA) têm o seu lugar no diagnóstico de doenças cerebrovasculares [2] (Fig. 1-3). A TC e a ressonância magnética são predominantemente utilizadas no âmbito do diagnóstico de AVC agudos. As seguintes perguntas devem ser respondidas de forma fiável e rápida:
- Hemorragia intracraniana?
- Fechamento do navio?
- Núcleo do enfarte?
- Parênquima cerebral potencialmente salvável (“penumbra isquémica” ou “tecido em risco”)?
- “Mímica do AVC”?
A indicação para trombólise ou terapia interventiva é feita com conhecimento da janela temporal desde o início dos sintomas e dos sintomas actuais, incluindo a Escala de AVC dos Institutos Nacionais de Saúde (NIHSS), bem como os diagnósticos secundários relevantes, tais como factores de risco cardiovascular.
Tomografia computorizada (CT)
O TAC está disponível 24 horas por dia na maioria dos hospitais e torna possível excluir rápida e facilmente a hemorragia intracraniana aguda. A hemorragia intracraniana aguda já é hiperdensa em imagens nativas (60-90 HU, portanto mais brilhante ou mais densa do que tecido cerebral saudável) e é uma contra-indicação absoluta para a trombólise intravenosa [4].
No caso de isquemia causada pela redução do fornecimento de sangue (definido como fluxo sanguíneo cerebral [CBF] <10 ml/100 g/min), o transporte de iões falha devido à falta de energia e ao afluxo de água para as células (edema citotóxico) [5]. O aumento do conteúdo de água no tecido isquémico leva a uma redução da densidade da área afectada e torna-se visível como diferenciação medular-cortical abolida (principalmente no córtex insular como “sinal de fita insular”) ou como hipodensidade nos gânglios basais e no campo medular. Esta redução da densidade deve ser interpretada como um núcleo de enfarte no sentido de danos parenquimatosos irreversíveis. No entanto, a detecção de alterações tão precoces e frequentemente subtis requer muita experiência e tem uma sensibilidade média de 66% (variação, 20% a 87%) nas primeiras três horas após o aparecimento dos sintomas [2].
Um trombo intravascular, que é exibido hiperdenso, também pode ser visível na imagem nativa. Este chamado “sinal arterial hiperdenso” é altamente específico, mas não muito sensível para uma oclusão vascular e, como outras estenoses ou oclusões vasculares, pode ser visualizado mais precisamente com a ajuda da angiografia por TC com contraste. A angiografia CT permite a avaliação de todas as artérias aferentes do cérebro desde o arco aórtico até ao vértice e assim também permite a avaliação da circulação colateral ou anomalias vasculares que podem complicar a intervenção endovascular.
O parênquima cerebral potencialmente salvável, também chamado “penumbra” ou “tecido em risco”, é a área de hipoperfusão crítica (CBF 10-20 ml/100 g/min) [5]. Os neurónios da “penumbra” são disfuncionais, embora a disfunção seja reversível com reperfusão atempada. Com a oclusão persistente, verifica-se uma perda gradual da “penumbra”. A imagem de perfusão é necessária para visualizar o núcleo do enfarte, a “penumbra” (“tecido em risco”) e a oligemia benigna adjacente (“tecido sem risco”, CBF >20 ml/100 g/min, norma 60-80 ml/100 g/min). A perfusão por TC é uma técnica de imagiologia dinâmica com contraste melhorado que fornece informação sobre parâmetros temporais tais como o tempo médio de trânsito (MTT), o tempo para o pico da curva tempo-intensidade do sinal (TTP) e o tempo máximo da chamada função residual (Tmax), ou sobre parâmetros semi-quantitativos tais como o fluxo sanguíneo cerebral (CBF) e o volume sanguíneo cerebral (CBV). A perfusão retardada é manifestada por parâmetros de perfusão temporal prolongada. A redução do CBF na “penumbra” leva à auto-regulação vasogénica dependente de energia; o MTT e o TTP são prolongados, o CBV é normal ou mesmo ligeiramente aumentado. Estes mecanismos compensatórios não estão presentes no núcleo do enfarte, onde se verifica uma queda na VFC [6]. No CT, a penumbra potencialmente salvável é tradicionalmente estimada através de uma chamada “incompatibilidade CBV/MTT”.
Ressonância magnética (MRI)
Nos centros de AVC, a RM está disponível 24 horas por dia e é frequentemente preferida à TC porque fornece mais informação adicional. O protocolo de exame de RM de rotina inclui imagem de difusão (DWI), “FLAIR” ou sequência de ecos de spin ponderado T2, angiografia de RM arterial “tempo de voo” (TOF-MRA), sequência ponderada de susceptibilidade (SWI) ou sequência de ecos de gradiente T2* (T2*GRE), ressonância magnética de perfusão, angiografia de contraste dos vasos de alimentação do cérebro e uma sequência ponderada em T1 após administração de contraste.
As sequências sensíveis aos produtos de degradação do sangue (SWI ou T2*GRE) também permitem a visualização de um possível trombo intravascular. O comprimento do trombo, medido por RM ou TAC, tem relevância prognóstica, com um comprimento superior a 8 mm associado a uma má recanalização após lise i.v. [7].
Um aumento da quantidade de deoxi-hemoglobina leva a uma depressão mais proeminente do sinal de RM da cortical, leptomeníngea (“sinal de vaso cortical”) e artérias medulares profundas (“sinal de pincel”) na sequência ponderada de susceptibilidade, permitindo assim uma estimativa da área hipoperfusada [8].
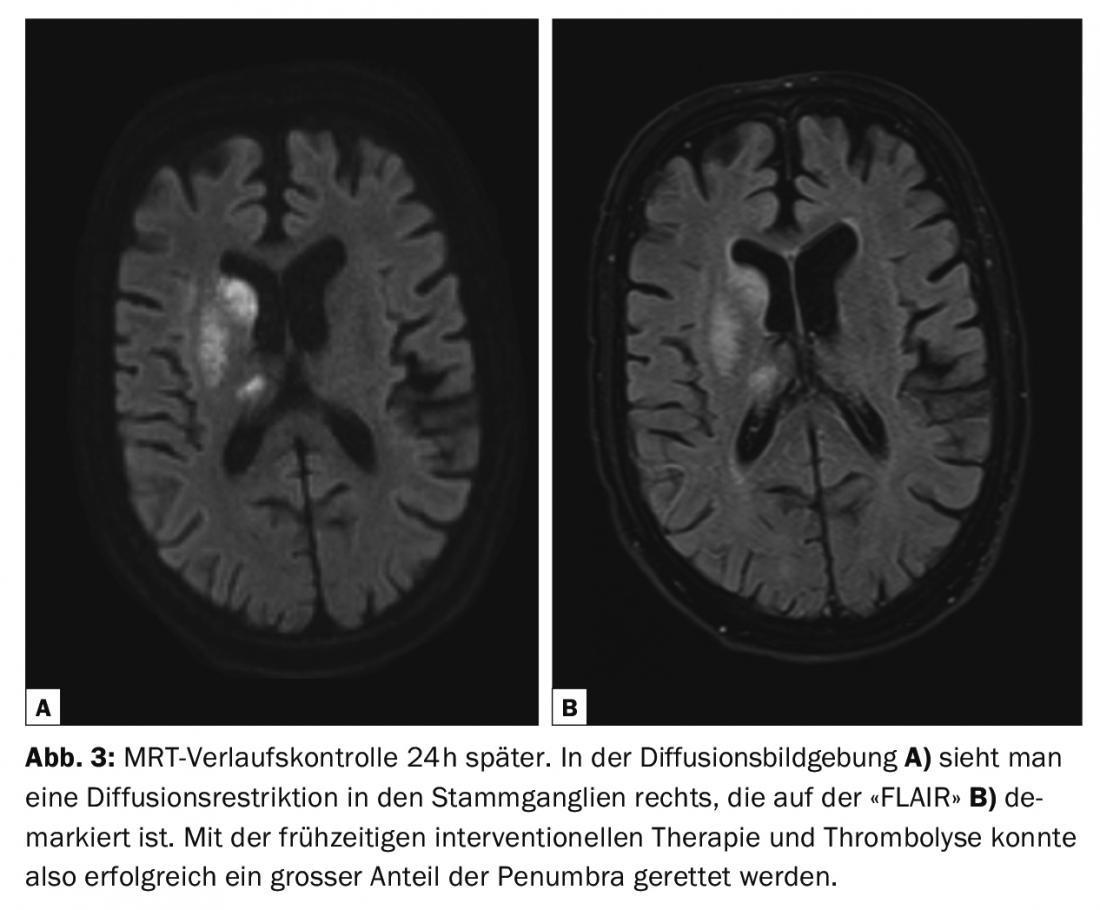
Em AVC agudo e AVC de despertar (tempo de início de sintomas desconhecido), a comparação de imagens ponderadas por difusão e FLAIR permite a classificação temporal. O edema citotóxico, que corresponde em grande parte ao núcleo do enfarte mas também contém algumas partes reversíveis da “penumbra”, já pode ser delineado após alguns minutos na imagem de difusão (sensibilidade 88-100%, especificidade 95-100%), mas apenas após cerca de 6 h post-ictus como melhoria do sinal no “FLAIR”/T2 [2,9]. A sequência ponderada em T1 após administração de contraste permite uma classificação temporal adicional; é de esperar uma hiperaemia meníngea no período entre 24 h e 3-4 dias, uma ruptura da barreira do parênquima cerebral enfarte no período entre 24 h e várias semanas ou mesmo meses [9].
Com a angiografia TOF, a RM oferece a possibilidade de imagens vasculares sensíveis ao fluxo sem administração de meios de contraste e alta resolução espacial, para além da angiografia suportada por meios de contraste. A perfusão por RM, tal como a perfusão por TC, também fornece informação sobre parâmetros temporais (MTT, TTP, Tmax) e semi-quantitativos (CBV, CBF) após administração de um bolo de contraste. Na RM, a “penumbra” isquémica é definida por uma diferença entre o distúrbio de perfusão nos mapas MTT ou TTP e o distúrbio de difusão, como um chamado “distúrbio de difusão-perfusão” [2].
Que imagem é apropriada?
Nas actuais directrizes de 2018 [4], as Associações Americanas de Cardiologia e AVC (AHA/ASA) recomendam que qualquer paciente com suspeita de AVC agudo seja submetido principalmente a uma TAC craniana nativa para excluir a hemorragia intracraniana. A imagem das artérias carótidas e vertebrais extra e intracranianas é apropriada em potenciais candidatos à trombectomia mecânica para planear o procedimento, mas não deve atrasar a administração de alteplase intravenosa, se indicado.

Além disso, em doentes com grandes oclusões proximais na circulação anterior e na janela temporal entre 6-24 h desde o início dos sintomas, a perfusão por TC ou RM é recomendada para a indicação de uma possível trombectomia mecânica. Hoje em dia, a imagem pode ser feita a alta velocidade. Além disso, os candidatos à trombectomia não podem ser identificados com suficiente fiabilidade clínica. Por conseguinte, utilizamos um protocolo de ressonância magnética no paciente com AVC agudo com imagens de perfusão e difusão, bem como imagens dos vasos de fornecimento do cérebro. Para administrar o bolo de lise i.v., o exame de ressonância magnética pode ser brevemente interrompido depois de ter sido excluída a possibilidade de hemorragia. Na prática clínica diária, a escolha da imagem depende principalmente da infra-estrutura disponível e da experiência no respectivo centro.
Contudo, a avaliação inicial por ressonância magnética oferece algumas vantagens: Com a DWI, a RM oferece uma visualização sensível muito precoce do parênquima isquémico do cérebro e é claramente superior à TC a este respeito. A RM é também claramente superior à TC por suspeita clínica de infartos infractores no tronco cerebral e no cerebelo [10]. Os doentes com défices neurológicos difíceis de classificar clinicamente podem assim ser diferenciados de forma fiável em doentes com isquemia aguda ou com um “acidente vascular cerebral mímico”, como a enxaqueca hemiplégica, a paralisia de Todd ou a doença do nervo craniano [11]. Para a detecção de outras causas raras de AVC, tais como dissecção vascular, displasia fibromuscular ou sinusal ou trombose venosa cerebral, a RM é preferível. A classificação temporal superior do enfarte na ressonância magnética permite uma decisão mais diferenciada em relação à terapia intervencionista. Os efeitos potencialmente nocivos das radiações ionizantes e do agente de contraste CT contendo iodo é outro factor importante na escolha adequada da imagem. As principais desvantagens da RM são o tempo de exame mais longo de cerca de 15 min em comparação com a TC multimodal com cerca de 5 min, bem como a viabilidade mais difícil com pacientes que requerem monitorização e pacientes inquietos. Se a adequação da RM do paciente for questionável, deve ser realizada uma TC nesta situação aguda.
Mensagens Take-Home
- A informação relevante do ponto de vista terapêutico é a da imagem: Exclusão de hemorragia, detecção de isquemia ou núcleo de enfarte, “penumbra” se necessário, oclusão do vaso e comprimento do trombo. O TAC e a RM respondem a estas questões e são utilizados na prática clínica diária, dependendo principalmente da infra-estrutura existente e da experiência da respectiva clínica.
- A RM é muito útil na avaliação de doentes com défices neurológicos que são difíceis de classificar clinicamente e com suspeita de isquemia do tronco cerebral.
- Os doentes com défices neurológicos regressivos também devem receber um trabalho completo de AVC e de imagiologia. A experiência mostra que estes pacientes podem deteriorar-se clinicamente rapidamente.
- De acordo com as novas directrizes AHA/ASA, um protocolo de AVC ou ressonância magnética deve incluir séries nativas para excluir hemorragias e/ou detectar isquemia, bem como imagens vasculares. Contudo, esta última não deve atrasar a trombólise intravenosa, se indicada.
Literatura:
- Gabinete Federal de Saúde Pública, Indicadores de qualidade dos hospitais agudos suíços, Indicadores de qualidade número de casos: B1.1.M HD Stroke todas as formas (idade >19), 2015 (www.bag.admin.ch/bag/de/home/service/zahlen-fakten/zahlen-fakten-zu-spitaelern/qualitaetsindikatoren-der-schweizer-akutspitaeler/qualitaetsindikatoren-fallzahl.exturl.html/aHR0cDovL3d3dy5iYWctYW53LmFkbWluLmNoLzIwMTZfdGFnbG/FiLzIwMTZfc3BpdGFsc3RhdGlzdGlrL3BvcnRhbC5waHA_cD1x/aWZhbGx6Jmxhbmc9ZGUmYmFza2V0PSU3Q2IxLjElN0MwJnF5PT/IwMTY=.html)
- DeLaPaz RL, et al: ACR Critérios de Adequação em Doença Cerebrovascular. J Am Coll Radiol 2011; 8(8): 532-538.
- Saver JL: O tempo é cérebro – quantificado. Stroke 2006; 37: 263-266.
- Powers WJ, et al: 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association / American Stroke Association. Stroke 2018; 49: e46-e110. doi: 10.1161/STR.0000000000000158.
- Astrup J, et al: Thresholds in cerebral ischemia – a penumbra isquémica. Stroke 1981; 12(6): 723-725.
- Knash M, et al: O baixo volume de sangue cerebral é preditivo de restrição de difusão apenas em derrame hiperagudo. AVC 2010; 41(12): 2795-2800.
- Riedel CH, et al.: A importância do tamanho: a recanalização bem sucedida por trombólise intravenosa no AVC anterior agudo depende do comprimento do trombo. AVC 2011; 42(6): 1775-1777.
- Morita N, et al: Descobertas isquémicas de RM de 3-tesla T2* em doentes com AVC agudo. Cerebrovasc Dis 2008; 26(4): 367-375.
- Allen LM, et al: Descobertas de imagens de MR específicas da sequência que são úteis na datação de traços isquémicos. Radiografias 2012; 32(5): 1285-1297.
- Wintermark M, et al: Imaging Recommendations for Acute Stroke and Transient Ischemic Attack Patients: A Joint Statement by the American Society of Neuroradiology, the American College of Radiology and the Society of NeuroInterventional Surgery. J Am Coll Radiol 2013; 10(11): 828-832.
- Birenbaum D, Bancroft LW, Felsberg GJ: Imaging in stroke. West J Emerg Med 2011; 12(1): 67-76.
CARDIOVASC 2018; 17(2): 16-19