A pleura está envolvida em cerca de 30% de todas as doenças que afectam o sistema respiratório. Isto é frequentemente caracterizado pelo aparecimento de uma efusão. A incidência total de efusões pleurais nos países industrializados ocidentais é de aproximadamente 300/100.000.
A pleura está envolvida em cerca de 30% de todas as doenças que afectam o sistema respiratório. Isto é frequentemente caracterizado pelo aparecimento de uma efusão. A incidência total de efusões pleurais é elevada, cerca de 300/100.000 nos países industrializados ocidentais. As doenças concomitantes do coração, fígado e rins são geralmente transudadas com uma quota de 40-46%. Estima-se que os exsudados que necessitam de clarificação sejam até 60% numa população mista de doentes com medicina interna. Estes estão divididos em 40-45% de causas inflamatórias-microbianas, 20-30% de derrames malignos e 10-18% de derrames reactivos, por exemplo, no tromboembolismo. O restante inclui causas raras e efusões idiopáticas.
Básico
O espaço pleural mede cerca de 5-30 µm. Normalmente, encontram-se até 15 ml de líquido pleural na cavidade pleural, um filtrado microvascular da pleura parietal. A pressão pleural resulta da força de expansão da parede torácica, da força de retracção elástica do pulmão, bem como da pressão hidrostática capilar e da pressão oncótica. O resultado é um ligeiro influxo de fluido para o espaço pleural. O fluido é trocado através dos vasos linfáticos da pleura parietal, normalmente cerca de 15-30 ml por 24 h e por hemitórax. Isto pode ser aumentado para 500 ml. Alterações nas taxas de pressão, taxas de drenagem ou aumento da produção no contexto de processos inflamatórios ou malignos conduzem, em última análise, ao desenvolvimento de uma efusão pleural, resultando a primeira geralmente num transudado, a segunda num exsudado.
A ultra-sonografia torácica como procedimento disponível em quase todo o lado ou a tomografia computorizada pode mostrar melhor as alterações pleurais, muito melhor do que a imagem panorâmica do tórax. Permitem uma classificação descritiva. O carácter e extensão das alterações pleurais, presença de efusão, o seu tamanho, câmara, relação de alterações na parede pulmonar e torácica são registados. Além disso, pode ser realizada uma biópsia orientada com a ajuda de técnicas de imagem. Contudo, também podem revelar pistas etiológicas, tais como trombos centrais como pista para embolia pulmonar.
W. Frank sugeriu quatro questões-chave para estabelecer o diagnóstico: (1) tem de ser realizada uma toracocentese? (2) é um transudado ou um exsudado? (3) qual é a etiologia subjacente da efusão em caso de exsudado? (4) Quando são indicadas quais as técnicas biópticas? Já o diagnóstico de efusão conduz com grande probabilidade a um esclarecimento (até 75% dos casos). A adição de procedimentos endoscópicos-biópicos leva a um aumento para mais de 90%. Esta é a base para o algoritmo apresentado.
Perfuração pleural – Toracentese
A toracocentese é indicada quando a efusão está presente e as considerações clínicas não são claramente a favor do transudado. Hoje em dia, a punção é normalmente realizada com apoio sonográfico. As agulhas não devem ser subdimensionadas para poderem remover material viscoso se necessário. A anestesia local pode ser útil, mas nem sempre tem de ser realizada, uma vez que a punção pura do teste dificilmente excede a extensão da punção anestésica. Podem ser necessárias múltiplas perfurações para as câmaras, mas também podem produzir resultados diferentes. As efusões bilaterais geralmente não requerem trabalho invasivo de ambos os lados, uma vez que se correlacionam predominantemente com os parâmetros-chave. Uma colecção de 20-30 ml de efusão é suficiente para o diagnóstico. A retirada de maiores quantidades é geralmente feita para indicação terapêutica a fim de reduzir o desconforto respiratório e é frequentemente uma medida de emergência.
Primeiras etapas de avaliação
Primeiro, a efusão é avaliada visualmente. Distinguem-se efusão clara ou turva e pus (empiema), bem como efusão sanguinolenta ou chyle. O cheiro é também um critério importante. O mau cheiro caracteriza frequentemente o empiema. A sedimentação e a centrifugação podem revelar turbidez devido aos detritos celulares. A determinação de hemoglobina ou hematócrito permite a diferenciação entre efusão hemorrágica e hematotórax. O diagnóstico diferencial entre efusões quilosas e pseudoquílicas é possível através da determinação dos triglicéridos na efusão.
Análise química
O passo seguinte é a análise do conteúdo proteico. A classificação em transudado ou exudado é feita de acordo com os critérios de luz. Se existe uma doença claramente explicativa para um transudado, a doutrina geral é que não há necessidade de proceder a mais diagnósticos. Um derrame maligno é também largamente excluído se estiver presente um transudado. Os transudados passivos foram descritos na carcinomatose da pleura por linfangiose ou no linfoma maligno da pleura, pelo que ocasionalmente o diagnóstico também deve ser alargado no caso de transudados. Os furos repetidos e as terapias como os medicamentos diuréticos também podem levar a uma mudança. A determinação adicional de LDH pode ser útil para detectar transudados cujo conteúdo proteico só é aumentado devido à terapia diurética. No entanto, no caso do exsudado, são normalmente necessários mais esclarecimentos.
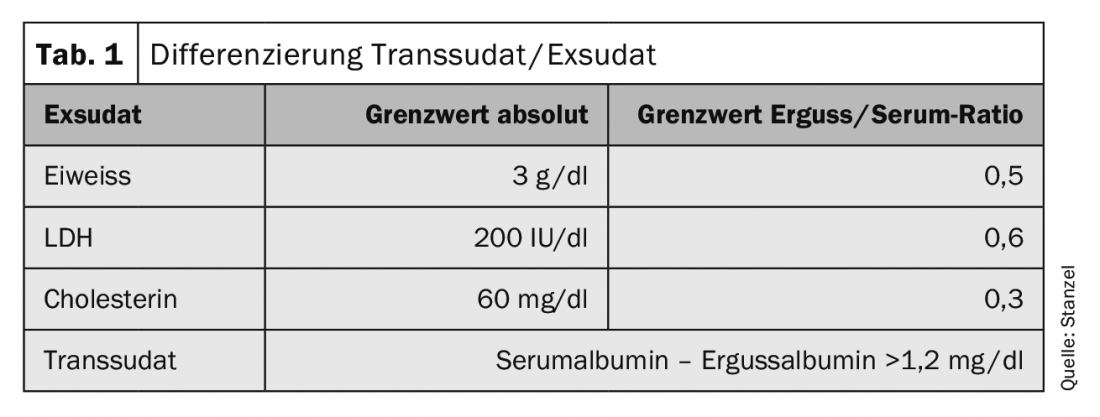
Um passo decisivo é a determinação das proteínas no líquido pleural (tab. 1) . O significado é melhorado através da avaliação do valor pleural em relação ao valor do soro. Uma análise adicional do nível de LDH na efusão pleural em relação ao valor do soro melhora a sensibilidade. A determinação do colesterol pode contribuir para uma maior diferenciação. No caso de efusão quilosa, para além dos resultados das características visuais, a determinação dos triglicéridos ou dos quilómeros leva ao diagnóstico. A demarcação de “pseudoexudados” pode ser difícil. Estes são transudados crónicos ou transudados modificados por terapia diurética. A determinação da amilase na efusão pode revelar uma associação com pancreatite aguda e crónica ou perfuração de esófago. Outros parâmetros também podem ser incluídos no diagnóstico. Dependendo da doença subjacente, a determinação dos neutrófilos, pH, NT-proBNP ou factor reumatóide ou outros parâmetros podem ser úteis.
A determinação do valor do pH é importante tanto em derrames parapneumónicos como malignos. Um pH ≤7.30 é normalmente encontrado apenas em empiema, raramente em derrame tuberculoso ou derrame pleural maligno avançado. Em combinação com a diminuição da glicose, isto indica espessamento pleural e inibição da transferência entre a circulação sanguínea e o espaço pleural. Para a determinação do pH, o fluido obtido é analisado como uma análise de gases sanguíneos. O pH e a depressão da glucose são uma medida da gravidade e extensão de um processo pleural.
O diagnóstico de efusão tuberculosa é particularmente desafiante. Uma linfocitose pronunciada na efusão, valores elevados de proteínas e LDH com glicose simultaneamente reduzida podem ser indicações de uma etiologia tuberculosa. A detecção microscópica e cultural da tuberculose não é fácil e só é bem sucedida em cerca de 25% dos casos, em média. A sensibilidade pode ser aumentada pela determinação da deaminase adenosina (ADA), uma enzima inflamatória associada a macrófagos e células T, com um corte de 47 U/ml no ensaio da enzima. As técnicas de amplificação de ADN para detectar sequências de ADN específicas para Mycobacterium tuberculosis são úteis. Estes podem permitir a detecção rápida da pleurisia tuberculosa. No entanto, as sensibilidades e especificidades variam mais. O diagnóstico nunca deve, portanto, basear-se apenas numa única descoberta.
Citologia
O exame citológico do derrame é um procedimento muito simples e amplamente utilizado e já deve ser incluído no exame inicial do derrame pleural, excepto no caso do transudado. A malignidade pode já ser provada por um achado citológico positivo, seja devido a infiltração maligna da pleura ou envolvimento pleural por metástase. No entanto, os resultados dos estudos variam muito, dependendo da doença tumoral e da sua extensão. Os doentes com um derrame maligno e um pH de derrame inferior a 7,30 tiveram resultados citológicos positivos em 78%. Com um pH de efluente superior a 7,30, este valor caiu para apenas 51%. Os métodos de biologia molecular e celular permitem novas abordagens. Tanto marcadores inflamatórios como oncológicos estão agora estabelecidos. A imunocitologia em particular permite um diagnóstico mais precoce e mais sensível. Além disso, a utilização de um painel de diversos marcadores facilita o diagnóstico diferencial entre mesotelioma e adenocarcinoma.
Biópsia com agulha
Adicionar uma biópsia da pleura se um exame citológico inicial não esclarecesse a situação é agora controverso e quase nunca utilizado. Apenas a biopsia pleural contribui significativamente para a clarificação da pleurisia tuberculosa. Num estudo de 254 pacientes, os granulomas caseiros foram detectáveis em biópsias de agulhas em 79,8% dos pacientes; os outros puderam ser confirmados por exames culturais. A taxa de esclarecimento depende do número de biópsias e atinge o óptimo quando são feitas seis ou mais biópsias ou quando é detectado tecido pleural em pelo menos duas das biópsias. No caso de uma elevada incidência de tuberculose, a combinação de determinação de ADA, predominância de linfócitos e biópsia com agulha dá a maior taxa de diagnóstico de exsudado inexplicável.
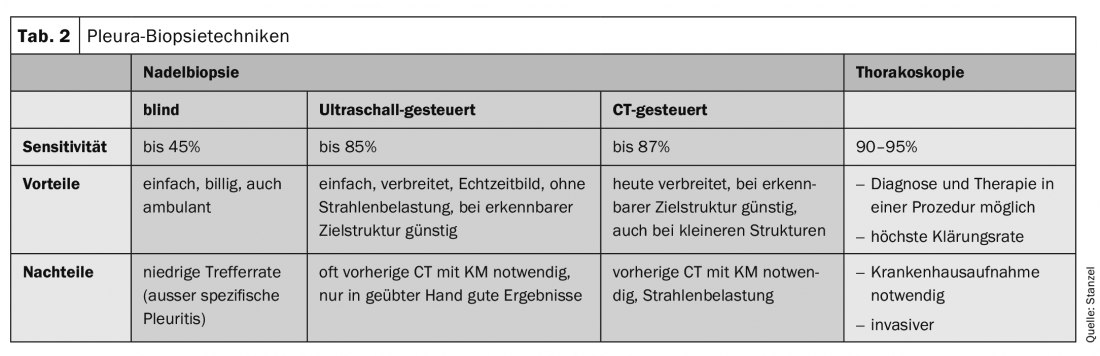
Em derrames malignos, a biopsia com agulha cega é muito menos sensível do que a citologia dos derrames. Em comparação com a toracoscopia, a biopsia com agulha é também claramente inferior (36% vs. 87%). Em conjunto com as modernas técnicas de imagem, tais como a sonografia do tórax ou a TC, os diagnósticos definitivos são feitos com maior frequência. A qualidade das biópsias obtidas com a agulha de corte automático é excelente porque são normalmente obtidas sem artefacto e correspondem a cilindros perfuradores cortados suavemente. A biópsia com agulha sob controlo sonográfico ou guiada por TC produz bons resultados, especialmente quando se detecta espessamento pleural ou nodularidade, que pode ser alvo com a agulha sob controlo por imagem (separador 2).
Toracoscopia
Após esgotar as possibilidades mencionadas até agora, uma proporção não negligenciável de cerca de 20-25% das efusões permanece inexplicável. O algoritmo é então seguido pela toracoscopia como o passo seguinte. A espera pura com acompanhamento (“esperar e ver”) é normalmente apenas uma opção para pacientes gravemente doentes em estado geral muito mau. Se a clarificação definitiva for útil, desejada e não houver contra-indicações e os resultados da toracoscopia forem susceptíveis de alterar o procedimento, este deve ser realizado. Outro argumento para a toracoscopia é frequentemente a opção adicional da pleurodese toracoscópica, especialmente em casos de grandes e/ou efusões recorrentes. Isto significa que o diagnóstico e a terapia intervencionista são mesmo realizados numa só etapa.
Jacobaeus efectuou a toracoscopia pela primeira vez em 1910 para diagnosticar a pleurisia exsudativa. Desde os anos 70, com Brandt e Loddenkemper na Alemanha e Boutin em França, este método tem sido estabelecido na Europa para o esclarecimento de doenças pleurais e efusões pleurais. Em combinação com a moderna tecnologia de vídeo, isto deu origem à vídeo toracoscopia em qualidade HD que é comum hoje em dia (Fig. 1).

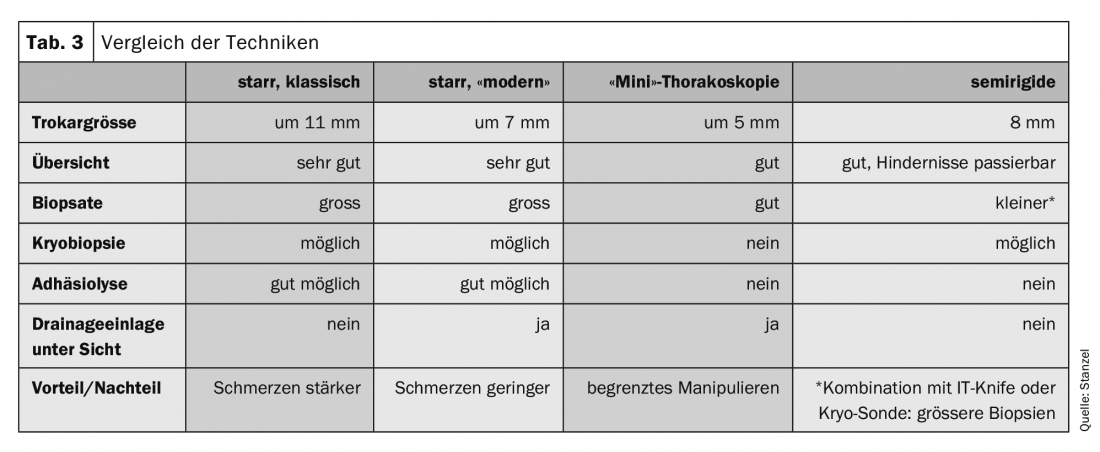
Classicamente, a toracoscopia interna – em inglês “medical thoracoscopy” – é realizada sob anestesia local em salas de endoscopia com instrumentos reutilizáveis e tem um carácter predominantemente diagnóstico (tab. 3) . No entanto, existem também possibilidades terapêuticas nas mãos do pneumologista intervencionista. A toracoscopia, especialmente a toracoscopia interventiva, pode então também ser realizada sob anestesia geral. As indicações para a toracoscopia estão listadas no quadro 4. A respectiva indicação está muito ligada à forma de anestesia e à técnica. Na Alemanha, apenas a clarificação e terapia de derrame pleural e biópsia pleural sob inspecção visual estão ainda generalizadas e mais amplamente aceites como indicações de medicina interna.
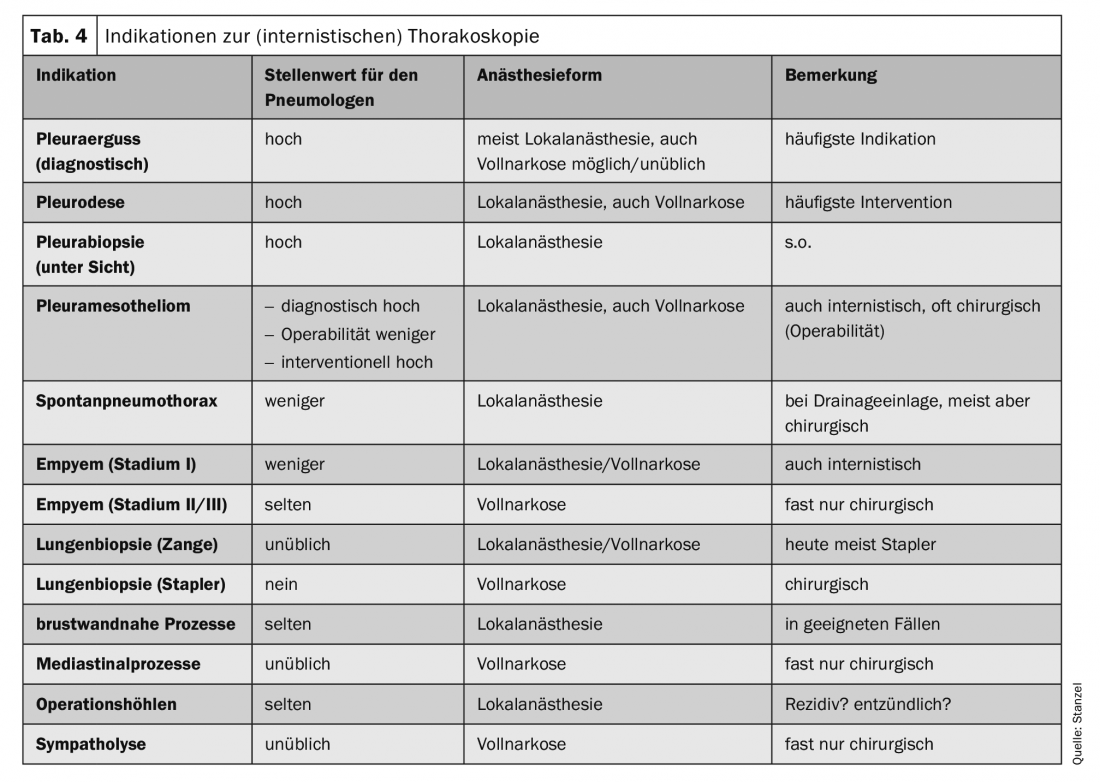
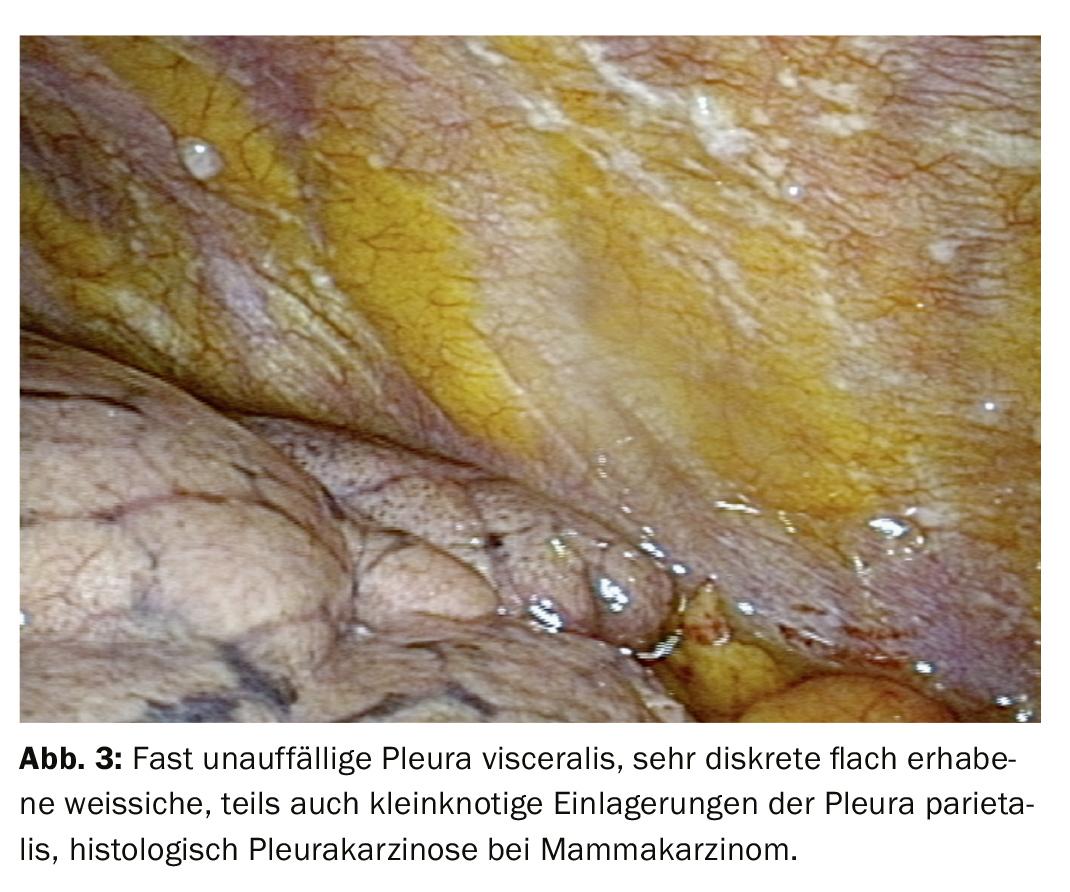
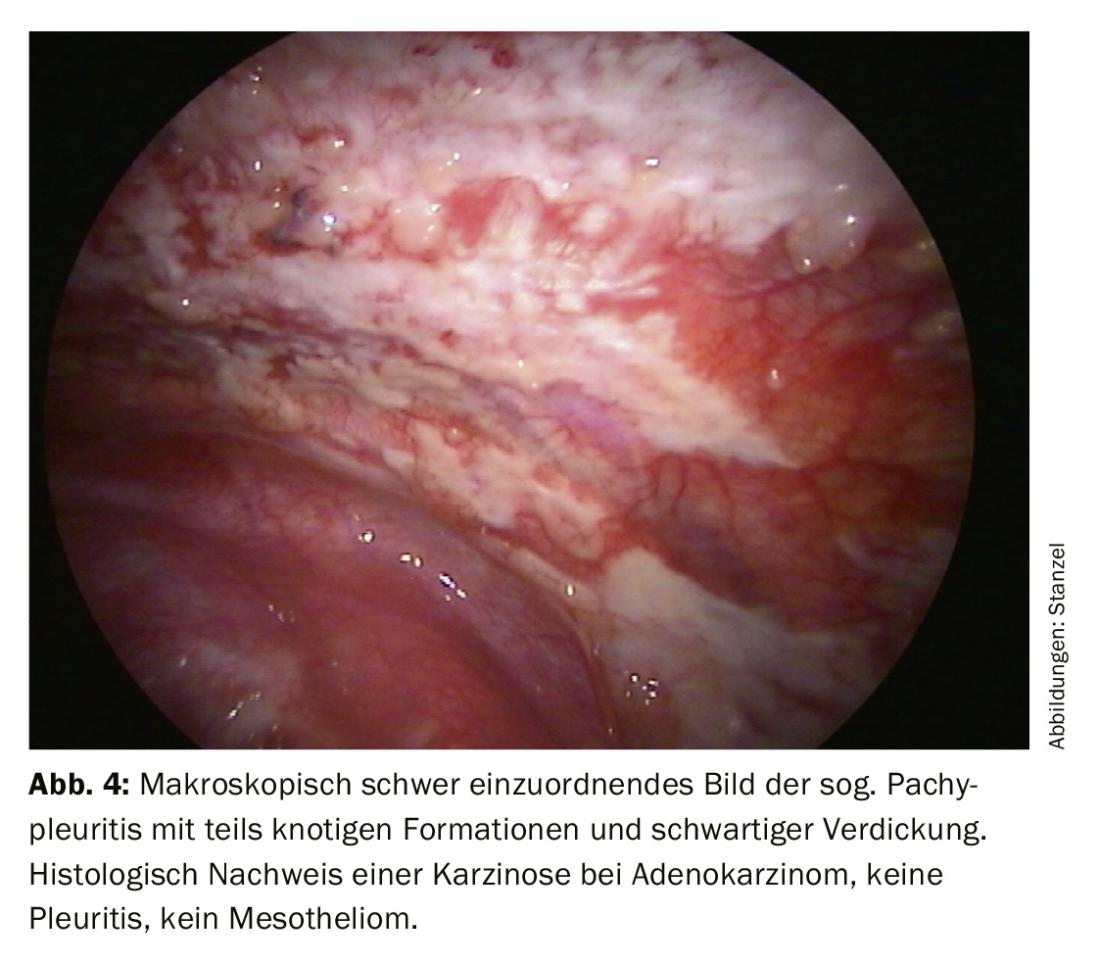
Após um processo de diagnóstico passo a passo, o foco está geralmente na diferenciação de um evento inflamatório de um derrame maligno (Fig. 2). A histologia a partir de biópsias de fórceps da pleura permite uma classificação mais clara. Na oncologia moderna, contudo, o processamento posterior do tecido tumoral também desempenha um papel importante porque as análises moleculares podem ter uma influência decisiva na terapia, especialmente no caso do carcinoma pulmonar. Assim, pode ser importante fornecer não só material citológico mas também biópsias maiores para exame, que podem ser facilmente obtidas através de biopsia com pinça directa ou criobiopsia durante a toracoscopia, mesmo que apenas manifestações tumorais discretas sejam evidentes. (Fig.3). O mesotelioma pleural como um importante diagnóstico diferencial de derrame maligno diminuiu claramente de frequência. Mas também aqui, a melhor diferenciação e classificação histológica baseada no material de biopsia obtido durante a toracoscopia pode ser uma boa indicação (Fig. 4).
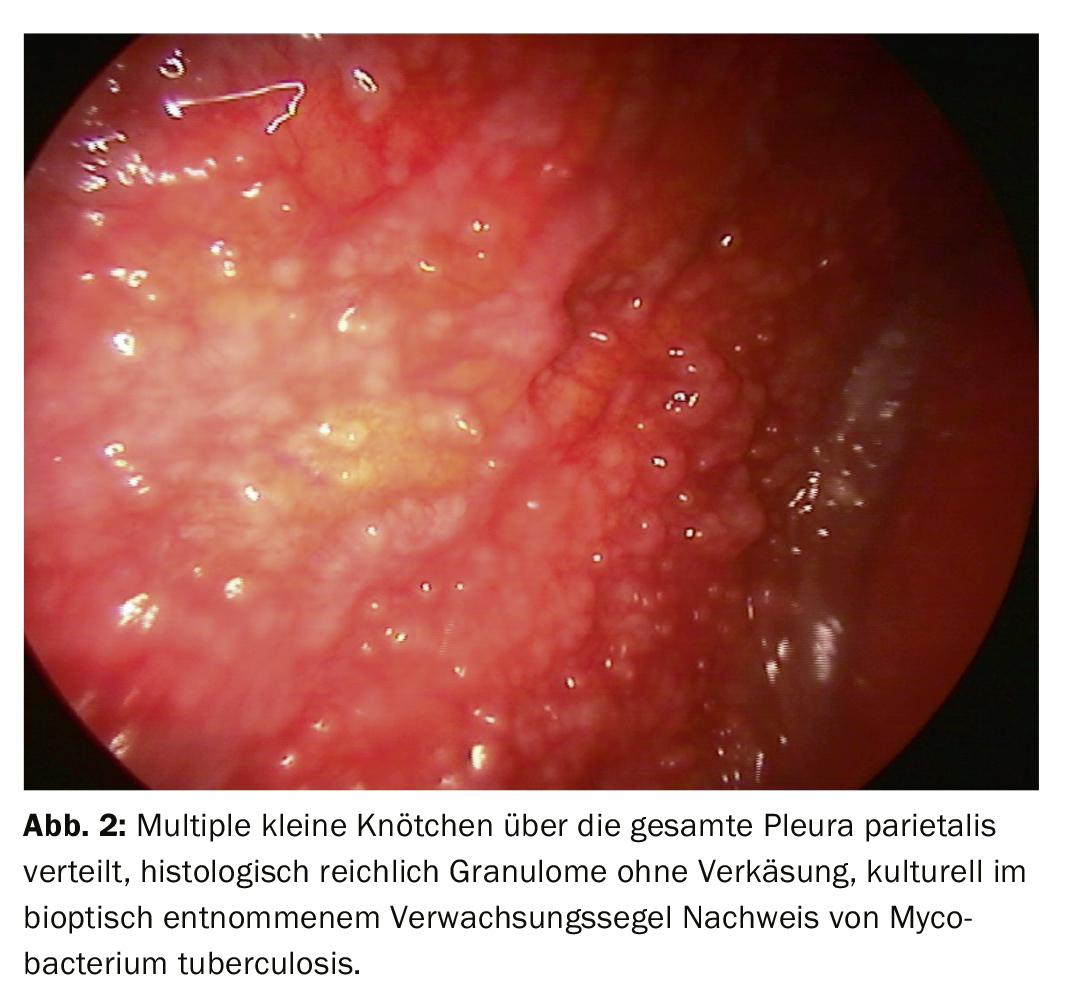
Alguns pneumologistas também vêem uma indicação de toracoscopia interna na fase inicial de um derrame parapneumónico ou empiema, mas depois mais de um ponto de vista terapêutico. Quanto mais o quadro clínico se desenvolve no sentido de um empiema complicado, mais o VATS do cirurgião torácico é considerado porque o desbridamento se torna cada vez mais importante. Se a diferenciação da pleurisia da pleurisia específica não for possível com suficiente certeza através de diagnósticos menos invasivos, a toracoscopia conduz a uma taxa de esclarecimento >90%. Para além do processamento histológico e microbiológico adicional de amostras de tecido, os materiais obtidos durante o desbridamento (depósitos de fibrina, velas e câmaras) devem também ser fornecidos para exame posterior (Fig. 2) . Para estas questões, o material deve também ser processado de forma adequada (solução salina, processamento rápido). Técnicas altamente sensíveis como a PCR são menos frequentemente necessárias.
No caso do pneumotórax, a toracoscopia é agora normalmente realizada como VATS pelo cirurgião torácico se houver uma indicação de cirurgia. Em alguns centros, é ou foi argumentado que se um dreno torácico for inserido no caso de um pneumotórax sintomático, uma toracoscopia interna também pode muito bem determinar a estratégia adicional e isto pode ser feito através do mesmo acesso antes da inserção do dreno. No entanto, uma vez que as recomendações para pneumotórax estão actualmente a avançar para uma única punção com cateteres de pequeno lúmen como terapia inicial, a toracoscopia interna quase nunca é realizada com esta indicação.
O equipamento para efectuar toracoscopia consiste em instrumentos rígidos como trocarte com manga, válvula, óptica, pinça e sucção (Tab. 3, 5). Para exame sob anestesia local, instrumentos com diâmetros menores são comuns hoje em dia, normalmente cerca de 6-7 mm. São também utilizados instrumentos maiores com 10-12 mm de diâmetro, principalmente sob anestesia geral. mm de diâmetro são utilizados, mas já quase não são comuns. Um instrumento de maior diâmetro também causa mais dor e desconforto durante e após a toracoscopia. A “minitoracoscopia” é realizada com instrumentos ainda mais pequenos com cerca de 3 mm de diâmetro, a manga tem então um diâmetro exterior de cerca de 5-6 mm. Então o procedimento é menos invasivo e menos doloroso. Os resultados são comparáveis aos do procedimento padrão.
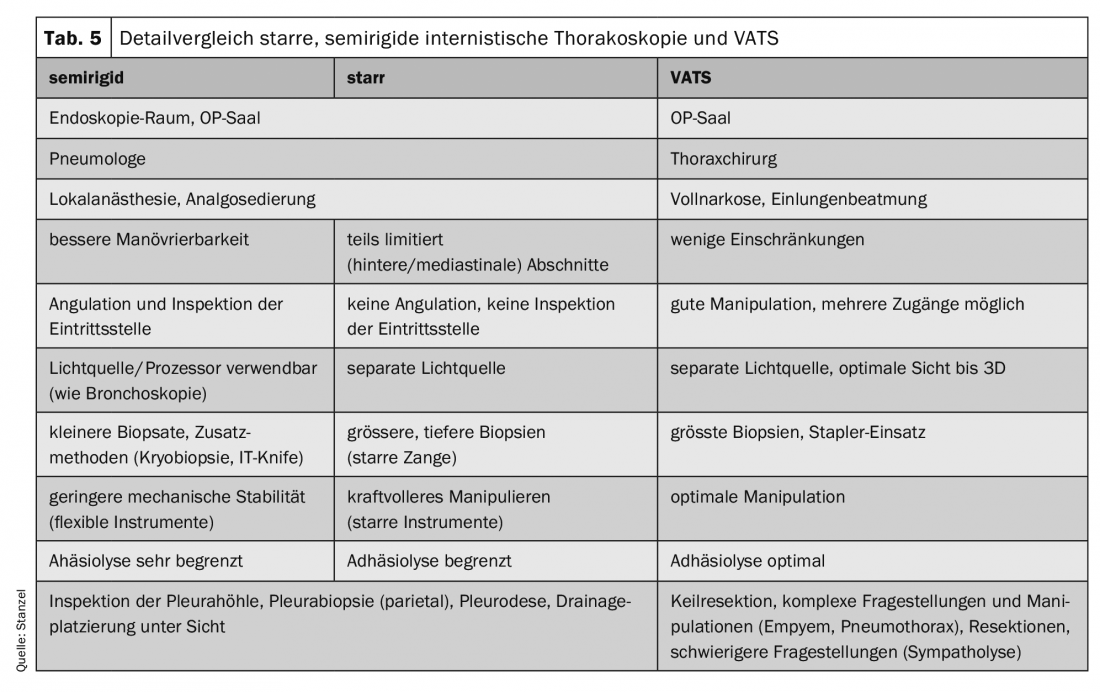
Alternativamente, foi desenvolvido um instrumento semi-rígido que se assemelha a um broncoscópio flexível e que também pode ser movido em torno de obstáculos devido à opção de angulação. As principais desvantagens são biópsias mais pequenas e frequentemente mais difíceis de remover do que com fórceps rígidos. No entanto, estas desvantagens podem ser parcialmente compensadas utilizando técnicas adicionais (faca eléctrica com electrocautério ou técnica de criobiopsia).
O pneumotórax necessário para o exame é criado ou passivamente através da admissão de ar ambiente, geralmente após ou com remoção de um derrame, ou activamente através de um insuflador. A localização da efusão e a criação do pneumotórax são mais facilmente realizadas sob controlo sonográfico. Um pneumotórax pode ser realizado com segurança mesmo no caso de derrames mais pequenos ou da ausência de derrames. A verificação fluoroscópica é pouco comum hoje em dia. Na maioria das vezes, o exame é efectuado através de apenas um acesso. Ocasionalmente pode ser necessário criar um segundo acesso, especialmente se houver adesões, a fim de visualizar outras áreas e fazer biópsias.
Os resultados da toracoscopia são melhores em carcinomatose pleural (Fig. 3, 4). A biopsia com agulha esclarece 44%, a citologia 62%, a toracoscopia sozinha até 95%, em combinação com os outros procedimentos até 97%. No mesotelioma maligno, a toracoscopia dá um contributo significativo para a confirmação histológica, embora isto seja mais difícil. Isto envolve uma encenação exacta e a determinação do procedimento seguinte. Também pode ser esclarecido se uma ressecção é promissora. Para pleurisia tuberculosa, os números para esclarecimento são: biopsia com agulha 51%, + cultura 61%, toracoscopia (+ cultura) 99% (Fig. 2).
Uma vantagem da toracoscopia é um diagnóstico mais preciso. Num estudo francês, foram analisadas 168 toracoscopias internas. Em 66 pacientes, o diagnóstico foi pleurisia não específica após todo o trabalho de diagnóstico. Em apenas 34 o diagnóstico foi confirmado por toracoscopia. Por outro lado, verificou-se que 16 tinham mesotelioma maligno, 10 tinham carcinomatose pleural com adenocarcinoma, 3 tinham carcinoma indiferenciado e 3 tinham pleurisia específica. Com relativa frequência, todo o procedimento posterior muda como resultado do diagnóstico finalmente feito por toracoscopia. O procedimento foi modificado em 155 de 182 pacientes.
A biópsia da pleura é feita sob visão directa e o número de biópsias realizadas deve situar-se entre 2 e 6. Em qualquer caso, deverá também estar disponível material suficiente macroscopicamente, especialmente se forem efectuados diagnósticos adicionais abrangentes como é comum hoje em dia (imunohistologia, análise molecular). Se faltar uma estrutura-alvo clara, devem ser biopsiadas múltiplas áreas. A biópsia deve ser feita parietalmente na costela. As biópsias viscerais estão associadas ao risco de uma fuga prolongada de ar, as do espaço intercostal com hemorragia do vaso intercostal ou lesão do nervo. Ao levantar e puxar de lado, a pleura pode muitas vezes ser arrancada como uma tapeçaria e uma biópsia maior obtida em segurança. No processo, os pacientes podem mover-se e ficar inquietos mesmo sob analgesia quando estão com dores. Uma injecção local adicional é invulgar e normalmente não necessária. Como regra, o material da biópsia é colocado em formalina e processado histologicamente. Se a causa for infecciosa, especialmente se houver suspeita de uma causa específica, o material também deve ser colocado em solução salina e rapidamente transferido para um laboratório apropriado. A biopsia electrocirúrgica ou criobiopsia são novas formas de aumentar o rendimento, especialmente quando se trabalha com o instrumento semi-rígido.
Os pacientes que têm uma efusão pleural maligna e são sintomáticos têm frequentemente uma efusão extensa. A quimioterapia nem sempre é um tratamento promissor, especialmente quando a angústia respiratória relacionada com efusão é a principal preocupação e precisa de ser tratada rapidamente. Aqui, a toracoscopia oferece simultaneamente uma opção terapêutica com a realização de pleurodese, geralmente por insuflação adicional de talco. As taxas de sucesso são geralmente dadas como >90%.
Uma contra-indicação absoluta à toracoscopia é a adesão e a aglutinação do espaço pleural, como pode ocorrer em processos malignos avançados, especialmente no mesotelioma pleural. Processos inflamatórios e empiema também podem causar isto, tal como a cirurgia anterior ou pleurodese. As contra-indicações relativas incluem uma marcada dispneia ou hipoxemia não devida a efusão. Outras são uma situação cardiovascular instável, uma condição hemorrágica, uma tosse insaciável e uma hipertensão pulmonar ou obesidade acentuada.
A thoacoscopia interna é um procedimento seguro e caracteriza-se por uma baixa taxa de complicações quando realizada por um examinador treinado e experiente. A BTS Pleural Disease Guideline relata uma mortalidade de 0,34%, que é muitas vezes às custas do talco poudrage. Outras complicações tais como empiema, hemorragia, metástase de canal, fuga de ar, pneumotórax ou pneumonia ocorrem em até 1,8%, e complicações menores tais como enfisema subcutâneo, hemorragia menor, infecção local, hipotensão ou febre em até 7,3%. A toracoscopia semi-rígida tem taxas de complicação ligeiramente inferiores à toracoscopia rígida. Uma complicação grave é a hemorragia de um recipiente intercostal, que normalmente pode ser evitada. Um procedimento cirúrgico torácico pode então tornar-se necessário. Portanto, recomenda-se por vezes que a toracoscopia só seja realizada se um cirurgião torácico estiver disponível em caso de emergência.
Resumo
A toracoscopia interna é um procedimento de diagnóstico seguro com poucas complicações e uma elevada taxa de diagnóstico. As características essenciais são a menor invasividade em comparação com o VATS, o menor esforço, bem como os custos mais baixos. Isto coloca a toracoscopia no fim de um fluxo de trabalho (algoritmo) que leva à clarificação da causa da doença pleural em mais de 90% e também oferece opções terapêuticas, mais comummente utilizadas em derrames malignos, mas também em derrames parapneumónicos ou empiema e pneumotórax.
Mensagens Take-Home
- No caso de derrame pleural pouco claro, a taxa de esclarecimento por toracoscopia interna sobe para mais de 90%.
- A toracoscopia interna é um procedimento minimamente invasivo realizado sob anestesia e analgesia local.
- A sonografia do tórax substituiu a fluoroscopia como técnica adjuvante no planeamento e execução da toracoscopia.
- Se houver lesões pleurais circunscritas, uma biópsia com agulha guiada por sonografia ou TAC pode esclarecer a situação; no caso de alterações difusas, a toracoscopia é geralmente a única opção.
- O derrame maligno recorrente pode ser diagnosticado por toracoscopia numa sessão e definitivamente eliminado por talco.
Literatura:
- Light R: Doenças Pleurais. Baltimore, MD: Lippincott Williams & Wilkins 2007.
- Collins TR, Sahn SA: Toracocentese. Valor clínico, complicações, problemas técnicos, e experiência do paciente. Peito 1987; 91(6): 817-822.
- Seijo LM, Sterman DH: Pneumologia Intervencionista. N Engl J Med 2001; 344(10): 740-749.
- Hooper CE, Lee YCG, Maskell NA: Criação de um serviço especializado em doenças pleurais. Respirologia 2010; 15(7): 1028-1036.
- Stanzel F, Ernst A: Diagnóstico de doenças pleurais. Pneumologe 2008; 5: 211-218.
- Frank W. Procedimento de diagnóstico em efusão pleural. Pneumologia 2004; 58: 777-790.
- Ferrer J: Efusão pleural tuberosa e empiema tuberculoso. Sem Critérios Care Med 2001; 6/22: 637-646.
- Rodriguez-Panadero F, Janssen JP, Astoul P: Toracoscopia: visão geral e lugar no diagnóstico e gestão dos derrames pleurais. Eur Resp J 2006; 28: 409-421.
- Rahman NM, em nome da British Thoracic Society Pleural Disease Guideline Group. Toracoscopia anestésica local: British Thoracic Society Pleural Disease Guideline 2010. Tórax 2010; 65(suppl 2): ii54-ii60.
- Loddenkemper R: Toracoscopia – estado da arte. Eur Resp J 1998; 11: 213-221.
- Rodriguez-Panadero F, Janssen JP, Astoul P: Toracoscopia: visão geral e lugar no diagnóstico e gestão dos derrames pleurais. Eur Resp J 2006; 28: 409-421.
- Tassi G, Marchetti G: Minitoracoscopia: Uma abordagem menos invasiva da toracoscopia. Peito 2003; 124: 1975-1977.
- Pyng L, Mathur PN, Colt HG: Avanços na Toracoscopia: 100 Anos desde Jacobaeus. Respiração 2010; 79: 177-186.
- Alraiyes AH, Dhillon SS, Harris K, et al: Thoracoscopia Médica: Técnica e Aplicação. PLEURA 2016; 3: 1-11.
- Janssen JP: Porque faz ou não precisa de toracoscopia. Eur Respir Rev 2010; 19: 117, 213-216.
- Woolhouse I, em nome do BTS Mesothelioma Guideline Development Group: British Thoracic Society Guideline for the Investigation and Management of Malignant Pleural Mesothelioma. Tórax 2018; 73: i1-i30.
- Blanc FX, Atassi K, Bignon J, Housset B: Valor Diagnóstico da Toracoscopia Médica na Doença Pleural – Um Estudo Retrospectivo de 6 Anos. Peito 2002; 121: 1677-1683.
InFo PNEUMOLOGIA & ALERGOLOGIA 2020; 2(1): 8-14