O carcinoma epitelial dos ovários é um grupo heterogéneo de carcinomas que têm diferentes etiologias, genética e, portanto, prognóstico biológico. Em fases avançadas (IIB-IV), a terapia padrão continua a ser a terapia citoreducativa máxima, pesando a morbilidade e a rápida continuação da quimioterapia com carboplatina/paclitaxel. A quimioterapia adjuvante continua a ser carboplatina e paclitaxel (q3w ou q1w). Na situação R1 ou fase IV, bevacizumab deve também ser administrado durante a terapia e continuado como terapia de manutenção, uma vez que esta mostrou um benefício de sobrevivência de cerca de nove meses. A individualização da terapia de acordo com a biologia subjacente é essencial, pelo que é necessário o envolvimento de todos os peritos e de uma equipa interprofissional e interdisciplinar num centro de tumores.
Cerca de 200.000 mulheres em todo o mundo desenvolvem cancro epitelial dos ovários (EOC). Cerca de 60-70% dos doentes são diagnosticados numa fase avançada (FIGO fase III-IV). Destes pacientes, cerca de 70% sofrem uma recorrência, o que geralmente significa uma situação controlável mas já não curativa. O prognóstico nas fases avançadas é modesto, com uma taxa de sobrevivência de 50% a 5 anos. Nas fases iniciais (FIGO I-IIA), os pacientes são geralmente curados após um estadiamento cirúrgico adequado e terapia de sistema adjuvante contendo platina (estudo ACTION). Contudo, as taxas de incidência e mortalidade europeias normalizadas em função da idade mudaram apenas ligeiramente ao longo dos últimos 40 anos, apesar da melhoria da subespecialização cirúrgica e dos novos medicamentos de segunda linha.
Sintomatologia
Os sintomas de EOC são geralmente não específicos e aparecem tardiamente. Os sintomas frequentemente reclamados são frequentemente de origem gastrointestinal: meteorismo, mudança de hábitos nas fezes, dificuldades de micturição e aumento da circunferência abdominal. O sinal clinicamente mais importante é um tumor sólido, irregular e fixo na pélvis que pode ser delineado no exame ginecológico.
Subtipos histológicos
Os subtipos histológicos do carcinoma ovariano são morfologicamente bem delineados: serosos (75-80%), endometrióides (10%), mucinosos (10%), células claras (1%), células transicionais (1%) e indiferenciadas (1%). Estes histotipos não só diferem de forma puramente morfológica como também apresentam um padrão de comportamento biológico diferente, que é representado, entre outras coisas, por uma clara distinção genética ao nível do mRNA [1]. E o curso clínico também difere em função dos subtipos biológicos. Assim, o prognóstico da COC endometrióide é significativamente melhor do que o da COC mucinosa [2]. No futuro, a terapia terá de ser cada vez mais orientada para os subtipos biológicos, a fim de alcançar melhores prognósticos.
Durante muito tempo, pensava-se que o carcinoma ovariano era mais susceptível de ocorrer esporadicamente e só era hereditário em 10-15% dos casos. As mutações hereditárias relevantes para o cancro dos ovários estão nos genes BRCA1 (Chr. 17,60%) e BRCA2 (Chr. 13,30%), bem como as mutações nos genes de reparação de incompatibilidade de DNA MLH1, MSH2, MSH6, PMS1, PMS2 (5%), que também causam “cancro do cólon humano não polipose” (HNPCC) ou síndrome de Lynch [3]. Um estudo australiano recente mostrou que até 20% de todos os carcinomas serosos têm uma mutação no gene BRCA1 ou -2 [4]. Nos carcinomas serosos indiferenciados, sabemos que existe o chamado fenótipo “BRCAness”. Uma vez que tanto o BRCA como o PARP desempenham um papel na modificação da resistência aos tumores, o tratamento com os chamados inibidores PARP é central, e é provável que isso venha a aumentar no futuro.
O nosso conhecimento sobre o desenvolvimento do cancro dos ovários foi revolucionado em 2007 quando a adnexa dos portadores de mutação BRCA1/2 foi removida e foram descobertos carcinomas tubulares in situ precoces. Isto levou à percepção de que uma proporção significativa de carcinomas serosos dos ovários provavelmente tem origem no tubo. Anteriormente, tinha sido assumido que o epitélio de superfície de camada única que cobre o ovário é alterado por ovulação constante e produz cistos de inclusão metaplásicos [5, 6].
Terapia do cancro dos ovários
A terapia do cancro dos ovários é multimodal e inclui cirurgia e quimioterapia ou terapia de alvo, bem como radioterapia no passado.
Já nos anos 40, foi postulado pela primeira vez que a ressecção completa de todos os restos tumorais é essencial para o prognóstico. Mas foi apenas com a subespecialização de ginecologistas especiais como oncologistas ginecológicos que foi possível realizar a cirurgia de debulking abaixo dos 2 cm. Aqui, se possível, a citoredução completa em vez da óptima deve ser orientada para [7, 8]. De acordo com o antigo Consenso GCIG (Gynecological Cancer Intergroup) realizado em 2010, um debulking óptimo é um foco de tumor residual <1 cm (alcançável em 47%) [9]. Na nova definição consensual do GCIG, no entanto, o descascamento óptimo corresponde a nenhum tumor residual macroscopicamente visível (alcançável em apenas 34%) [10].
Vários estudos demonstraram que a sobrevivência depende significativamente do volume residual do tumor. Uma meta-análise da Bristow com mais de 6000 pacientes de 2002 mostrou claramente a correlação linear entre a extensão da citoredução e o número de pacientes.
Sobrevivência em [8]. Os tópicos de discussão actuais dizem respeito à extensão da agressividade no debulking, por exemplo, do abdómen superior [11] ou dos gânglios linfáticos. No estudo de um grande centro de tumores dos EUA, foi demonstrado que a citoredução completa era possível em 85,3% e a citoredução óptima (<1 cm) em mais 13,5%. Contudo, isto só foi possível com um aumento maciço da morbilidade devido a procedimentos adicionais extensivos, por exemplo, ressecções rectosigmóides (52,1%), remoção de diafragma (40,5%), ablação de implantes peritoneais (89%) ou esplenectomias, ressecções hepáticas e pancreatectomias distais (19%) [7]. Uma vez que a terapia de EOC não só inclui o debulking cirúrgico, mas também a rápida continuação da terapia com quimioterapia, parece questionável se o debulking prolongado com elevada morbilidade e o atraso da quimioterapia subsequente em vários meses é útil, especialmente em pacientes de idade avançada.
Actualmente, não há estudos que tenham demonstrado um benefício da linfonodectomia. Isto é especialmente verdade no caso de um tumor residual, independentemente do volume. Uma análise retrospectiva de pacientes do estudo de vários estudos AGO-OVAR (n=3388) mostrou um pequeno benefício em termos de sobrevivência global nos 51,3% de pacientes com uma redução óptima do tumor quando foi realizada uma linfonodectomia pélvica/paraaórtica sistemática [12]. Contudo, para além desta observação retrospectiva, não há dados prospectivos que provem a situação factual.
Terapia cirúrgica
O tratamento cirúrgico da EOC deve ser sempre realizado por laparatomia longitudinal se houver suspeita urgente de malignidade. O Laparascopy não tem valor no tratamento primário de EOC e aumenta o risco de tumor ou ruptura de cisto. Se ocorrer uma ruptura intra-operatória do tumor iatrogénico, o prognóstico piora com o “upstaging” para uma fase IC. O tratamento tumoral deve sempre incluir a encenação completa na fase inicial e o descascamento na fase avançada, uma vez que isto também é prognóstico. Podem ser feitos compromissos na cirurgia de preservação da fertilização com uma adenexectomia unilateral. No entanto, no caso de encenação incompleta, o “upstaging” ocorre em 30% dos casos na segunda operação. O quadro 1 mostra os requisitos para a terapia cirúrgica, incluindo a cirurgia de conservação de fertilização na fase inicial. Como os carcinomas mucínicos avançados são geralmente de origem não ovariana, deve ser sempre realizada uma apendicectomia e uma exploração extensiva do intestino/estômago [13].

Em contraste com o tratamento de EOC precoce, o tratamento de EOC avançado é concebido para maximizar a cirurgia citoreducativa. Após a fase FIGO, o remanescente do tumor após a ressecção máxima é o segundo prognóstico mais importante
Factor. Todas as lesões tumorais visíveis devem ser removidas. Uma ressecção completa é claramente melhor do que uma ressecção <1 cm (1-10 mm). Uma meta-análise AGO mostrou que a ressecção completa prolongou a sobrevivência por 30 meses na fase IV, 47 meses na fase IIIC e 60 meses na fase IIB-IIIB [14].
A ressecção intestinal, a ressecção do diafragma e a ressecção parcial do fígado também podem melhorar o resultado, mas também causam uma morbilidade e mortalidade correspondentes e só devem ser realizadas por oncologistas ginecologistas experientes.
Radioterapia
Nos anos 80, a radioterapia foi utilizada como terapia adjuvante porque mostrou um benefício sobre a quimioterapia com ciclofosfamidas. No entanto, tem sido hoje em dia relegada para segundo plano pela introdução da quimioterapia com platina e, apesar da sua boa eficácia, só raramente é utilizada. Na situação paliativa, contudo, a radioterapia para controlo dos sintomas ainda tem um papel importante e também pode ser considerada após a citorredação secundária óptima na recorrência localizada.
Quimioterapia
Actualmente, a quimioterapia com platina é o padrão no tratamento adjuvante do cancro dos ovários, bem como na situação de recorrência com um intervalo adequado (>6 meses). Nos anos 80, foram avaliadas várias terapias de combinação, em particular a combinação de platina com ciclofosfamida ou doxorubicina. Foram também estudadas combinações triplas, mas em geral trouxe mais toxicidade do que benefícios para os pacientes.
O segundo pilar principal da quimioterapia são os taxanes, que foram inicialmente extraídos do teixo do Pacífico (Taxus brevifolia). A combinação de carboplatina e paclitaxel ainda é o padrão na quimioterapia adjuvante do cancro dos ovários e tem sido testada em vários estudos (GOG111, OV10, ICON3). Desde 2004 a combinação de carboplatina/paclitaxel i.v. tem sido a norma mundial baseada nos dados do estudo. Isto também foi recomendado num documento de consenso [9].
Vários estudos investigaram o uso da quimioterapia em grupos de baixo risco versus grupos de alto risco (GOG, ICON 1, ACTION). As discussões actuais giram em torno da administração da quimioterapia neoadjuvante (EORTC55971,
CHORUS study), a quimioterapia intraperitoneal (SWOG, GOG172), a administração semanal de paclitaxel (JGOG3016, MITO7, ICON8), a administração adicional de terapias-alvo, em particular bevacizumab (ICON7, GOG218, AURELIA, OCEANS), bem como o chamado “paclitaxel” em curso após a quimioterapia. “Manutenção” – isto é, quimioterapia de manutenção com bevacizumab.
Os ensaios da fase III que anunciaram uma mudança de paradigma na terapia padrão para o cancro ovariano avançado ao longo das décadas foram:
- GOG111 (n=386) e OV10 (n=680), que compararam cisplatina/cicloposfamida com cisplatina/paclitaxel e mostraram um benefício de sobrevivência para a combinação paclitaxel
- GOG158 (n=792) e OVAR3 (n=883), que compararam cisplatina/paclitaxel com carboplatina/paclitaxel e mostraram uma eficácia semelhante com melhor tolerabilidade para o carboplatina
- GOG172 (n=429), que comparou a iv administração de cisplatina/paclitaxel com a administração intraperitoneal e observou uma eficácia melhorada mas aumentou a toxicidade e reduziu a qualidade de vida dos doentes
- JGOG3016 (n=637), que comparou a combinação carboplatina/paclitaxel como um regime semanal versus um regime de três semanas de taxol e mostrou um benefício de sobrevivência para o regime semanal de paclitaxel
- GOG218 (n=1873) e ICON7 (n=1528), que estudaram carboplatina/paclitaxel com placebo versus carboplatina/paclitaxel com e sem bevacizumab contínuo e mostraram um benefício de sobrevivência significativo para pacientes que tinham carcinoma avançado (FIGO III/IV) e não podiam ser operados de forma óptima (ICON7).
Bevacizumab é o primeiro medicamento da lista de terapias a ser desenvolvido como uma nova “terapia orientada” no contexto dos testes genéticos no cancro dos ovários. Ataca os vasos tumorais ligando-se ao “factor de crescimento endotelial vascular” (VEGF), que por sua vez se liga ao receptor com o mesmo nome. VEGF é responsável pela sobrevivência das células endoteliais, anomalias vasculares, estimulação do crescimento de novos vasos e aumento da permeabilidade vascular [15]. Foi um dos principais candidatos na análise de genes disregulados no cancro dos ovários [16]. VEGF desempenha um papel central na ovulação normal, a angiogénese estimulada por VEGF é essencial para o crescimento do tumor e desempenha um papel importante no desenvolvimento do cancro nos ovários, promovendo mudanças de crescimento benigno para maligno e contribuindo para a formação de metástases peritoneais e produção de ascite [17]. Não é portanto surpreendente que níveis elevados de VEGF no sangue estejam associados a um prognóstico mais pobre. Existem agora quatro ensaios fase III do inibidor VEGF bevacizumab no cancro dos ovários, ambos adjuvantes (GOG-0218 e ICON7 [18, 19]) e paliativo de primeira linha em situações sensíveis e refractárias à platina (OCEANS e AURELIA [20, Pujade-Lauraine ASCO 2012]).
O tratamento das fases iniciais (FIGO IA G1-FIGO IIA) do cancro dos ovários inclui quimioterapia com platina; isto melhora o prognóstico de sobrevivência em cerca de 8% após cinco anos. Os tumores da fase IA G1 não devem receber quimioterapia, pois têm um excelente prognóstico apenas com cirurgia. Todas as outras fases iniciais recebem quimioterapia com carboplatina/paclitaxel a cada três semanas, num total de quatro a seis ciclos.
Em terapia combinada carboplatina/paclitaxel, o paclitaxel pode ser administrado opcionalmente “dose-dense” semanalmente. Os dados japoneses (JGOG3016) são excelentes, mas ainda não é claro até que ponto os dados são transferíveis para doentes europeus, embora não tenha sido a célula clara mas sim os carcinomas serosos que mostraram a resposta. O ensaio europeu MITO7 não mostrou nenhum benefício PFS (progression-free survival) com carboplatina e paclitaxel semanais, mas uma melhor tolerabilidade.
Os dados do ensaio ICON8, que também está a testar o conceito dose-denso num só braço, são agora ansiosamente aguardados.
Tratamento recorrente
Cerca de 70% dos doentes diagnosticados com FIGO III/IV em estado avançado sofrerão uma recorrência no decurso dos primeiros cinco anos após a terapia adjuvante. Então, infelizmente, existe uma situação paliativa sem normalmente qualquer hipótese de cura. Ao contrário das últimas décadas, porém, a situação de recorrência caracteriza-se pelo facto de as opções terapêuticas terem aumentado e uma situação de recorrência estável poder frequentemente ser alcançada durante anos.
Os objectivos da terapia de recaída devem incluir o controlo dos sintomas, o prolongamento da sobrevivência sem sintomas e a manutenção/melhoria da qualidade de vida. A gestão destes pacientes está a tornar-se cada vez mais complexa à medida que mais dados estão disponíveis, e a escolha do tratamento ou da espera cautelosa depende de factores individuais. No entanto, as decisões de tratamento devem, sempre que possível, ser baseadas em provas e provir de ensaios aleatórios. Uma nova intervenção cirúrgica só faz sentido para pacientes seleccionados, isto é, se, por exemplo
- O paciente está livre de recidivas há mais de dois anos
- O tumor parece completamente ressecável
- Um envolvimento de gânglios linfáticos isolados está presente
- Não existe ascites ou carcinomatose peritoneal
- O paciente mostra um bom desempenho.
Os dados prospectivos sobre a ressecção estão actualmente a ser gerados no ensaio DESKTOP-III. Este estudo revê aleatoriamente o valor da re-resecção para a recidiva sensível à platina. A experiência já foi adquirida no estudo DESKTOP-II e foi desenvolvida uma pontuação preditiva para a operacionalidade [21].
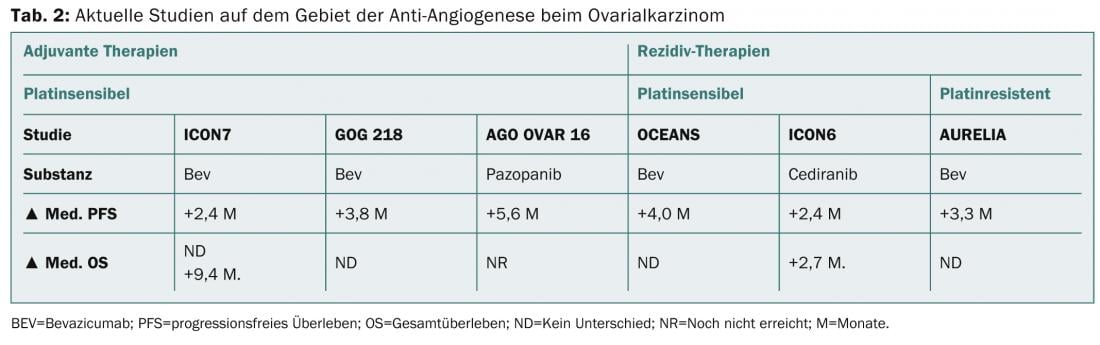
As novas opções de quimioterapia para o cancro dos ovários com recidiva na situação sensível à platina, bem como na situação refractária à platina, podem ser a administração adicional de bevacizumab ou a administração semanal de paclitaxel. O quadro 2 mostra a evolução actual no campo da antiangiogénese na terapia inicial, bem como na terapia de recorrência.
No caso de doentes com reflexos terapêuticos, são também necessários bons cuidados paliativos, que já foram incluídos nas decisões terapêuticas de antemão. O prognóstico nesta situação é geralmente muito pobre (<1 ano de sobrevivência) e o controlo dos sintomas é, portanto, a prioridade.
Em geral, os seguintes co-factores devem ser cuidadosamente considerados na escolha de um agente quimioterápico paliativo: Tempo para recaída, agentes quimioterápicos adjuvantes recebidos, sintomas actuais, desejos e conforto do paciente (alopecia?), estado geral, comorbilidades, tolerância à quimioterapia anterior, toxicidade residual (polineuropatia) e função dos órgãos. Se o estado ECOG dos pacientes com tumores sensíveis à platina for bom, é indicada uma combinação contendo platina com taxano/antraciclina, uma vez que há uma melhoria no prognóstico em comparação com a terapia com platina singular [22]. A inclusão destes doentes num possível ensaio clínico é geralmente recomendada.
Devido à complexidade crescente, um doente com cancro nos ovários deve ser sempre tratado numa equipa interdisciplinar interprofissional no âmbito de um centro de tumores ginecológicos. Isto tem a vantagem não só de uma maior experiência com estes pacientes, mas também, em particular, de uma estreita ligação em rede das disciplinas individuais e da coordenação óptima das medidas de apoio e terapêuticas.
Marcus Vetter, MD
Prof. Dr. Viola Med. Heinzelmann-Schwarz
Literatura:
- Heinzelmann-Schwarz VA, et al: Br J Cancer 2006; 94(6): 904-913.
- Winter III WE, et al: JCO 20 de Agosto de 2007; 25(24): 3621-3627.
- Burke W, et al: JAMA 1997; 277(12): 997-1003.
- Alsop K, et al: J Clin Oncol 2012; 30(21): 2654-2663.
- Auersperg N, et al: Endocr Rev 2001; 22(2): 255-288.
- Jarboe E, et al: Int J Gynecol Pathol 2008; 27(1): 1-9.
- Eisenkop SM, Friedman RL, Wang HJ: Gynecol Oncol 1998; 69(2): 103-108.
- Bristow RE, et al: Gynecol Oncol 2002; 86(2): 163-170.
- du Bois A, et al. (Intergroupe Gynecologic Cancer; AGO-OVAR; ANZGOG; EORTC; GEICO; GINECO; GOG; JGOG; MRC/NCRI; NCIC-CTG; NCI-US; NSGO; RTOG; SGCTG; IGCS; Equipa Organizacional das duas anteriores OCCC Internacionais): Ann Oncol 2005; 16(8): viiii7-viii12.
- Stuart GC, et al. (Participantes da4ª Conferência do Consenso do Cancro do Ovário (OCCC); Intergrupo do Cancro Ginecológico): Int J Gynecol Cancer 2011; 21(4): 750-755.
- Barlin JN, et al: Gynecol Oncol 2013; 130(2): 284-288.
- du Bois A, et al. (Groupe d’Investigateurs Nationaux pour l’Etude des Cancers Ovariens. Potencial papel da linfadenectomia no cancro ovariano avançado): J Clin Oncol 2010; 28(10): 1733-1739.
- Schilder JM, et al: Gynecol Oncol 2002; 87(1): 1-7.
- du Bois A, et al: Cancer 2009 Mar 15; 115(6): 1234-1244.
- Ferrara N: Endocr Rev 2004; 25(4): 581-611.
- Jacob F, et al: Biomark Med 2009; 3(6): 743-756.
- Belotti D, et al: Cancer Res 2003; 63(17): 5224-5229.
- Burger RA, et al. (Grupo de Oncologia Ginecológica): N Engl J Med 2011; 365(26): 2473-2483.
- Perren TJ, et al. (ICON7 Investigadores): N Engl J Med 2011; 365(26): 2484-2496.
- Aghajanian C, et al: J Clin Oncol 2012; 30(17): 2039-2045.
- Harter P, et al: Int J Gynecol Cancer 2011 Fev; 21(2): 289-295.
- Raja FA, et al: Ann Oncol 2013 Dez; 24(12): 3028-3034.
InFo Oncologia & Hematologia 2014; (2)1: 8-13











