A terapia do sistema de carcinoma de células renais está a mudar. Vários inibidores da tirosina cinase podem prolongar significativamente a sobrevivência em fases metastáticas. As imunoterapias também são eficazes.
O carcinoma de células renais é responsável por cerca de 2-3% de todos os tumores malignos. A incidência global em 2012 está estimada em 338.000 casos com 144.000 mortes associadas a tumores. O carcinoma de células renais está assim em 13º lugar a nível mundial em termos de incidência [1–3] . Depois do carcinoma da próstata e do carcinoma urotelial da bexiga, é o terceiro tumor urológico mais comum. O termo “tumor renal” abrange um amplo espectro de tumores heterogéneos, bem como diferentes entidades histopatológicas. Os três subtipos mais comuns são o carcinoma de células claras, papilífero e cromófobo renal, que juntos representam cerca de 85-90% de todos os tumores renais malignos e dos quais o subtipo de células claras tem o pior prognóstico [4]. Em cerca de 10-15% dos casos, os tumores renais são benignos [5]. Os tumores renais benignos mais comuns são o oncocitoma e o angiomiolipoma.
Epidemiologia
A idade principal de início do carcinoma de células renais situa-se entre os 60 e 70 anos [5,6]. Os homens são mais frequentemente afectados do que as mulheres, cerca de 1,5:1. Os factores de risco são o tabagismo, a obesidade, a hipertensão arterial e a insuficiência renal crónica [5,6]. Uma pequena proporção de carcinomas de células renais é hereditária, sendo que a síndrome de Von Hippel-Lindau (BVS), esclerose tuberosa e síndrome de Birt-Hogg-Dubé são dignos de menção neste contexto.
Diagnósticos
Actualmente, a maioria dos carcinomas de células renais são diagnosticados incidentalmente, ou seja, como um achado incidental num exame de imagem com uma questão médica diferente e são assintomáticos no momento do diagnóstico inicial. Como resultado, os tumores renais são diagnosticados com mais frequência numa fase inicial do que no passado, o que levou a uma chamada “mudança de fase” nas últimas décadas [5,6]. A tríade clássica de sintomas de dor de flanco, macrohaematuria e tumor abdominal palpável é agora muito rara. No entanto, se estes sintomas locais estiverem presentes, trata-se geralmente de um caso de uma doença tumoral já localmente avançada e metástaseada com um prognóstico consecutivo pobre. O exame físico geral desempenha um papel bastante subordinado no diagnóstico do carcinoma de células renais. No entanto, os varicoceles ou edemas das extremidades inferiores podem ser indicações de espaço retroperitoneal, que devem consequentemente ser excluídos por imagens [6]. Os tumores renais podem causar vários sintomas paraneoplásicos [6].
Os achados renais anormais na ecografia devem ser mais esclarecidos com tomografia computorizada multifásica (TC) do abdómen ou com uma ressonância magnética. Em casos especiais, a sonografia com contraste pode ser útil [5]. As lesões espaciais do rim são geralmente divididas em lesões sólidas e císticas. As lesões císticas estão divididas em cinco categorias (I, II, IIF, III, IV) para avaliação da dignidade da TC utilizando a classificação BOSNIAK [7,8]. Os resultados das categorias III e IV são considerados malignos até prova em contrário; por conseguinte, é indicado um esclarecimento histológico. Em massas sólidas do rim, a captação local do meio de contraste aplicado (CM) é um importante critério de malignidade [5].
A localização exacta do tumor (central, periférico, proximidade do hilo ou pyelon, etc.), a extensão do tumor local, qualquer envolvimento vascular (por exemplo, trombos tumorais na veia renal e veia cava) e aumentos suspeitos de gânglios linfáticos são avaliados na TC ou RM para que o estadiamento preciso possa ser efectuado de acordo com a actual classificação TNM (Tab. 1) [5,6]. A diferenciação de angiomiolipomas e oncocitomas sem gordura de processos malignos pode causar dificuldades no diagnóstico por imagem [9]. Se houver suspeita da presença de carcinoma de células renais, deve ser realizada uma TC suplementar do tórax para excluir metástases pulmonares [5].

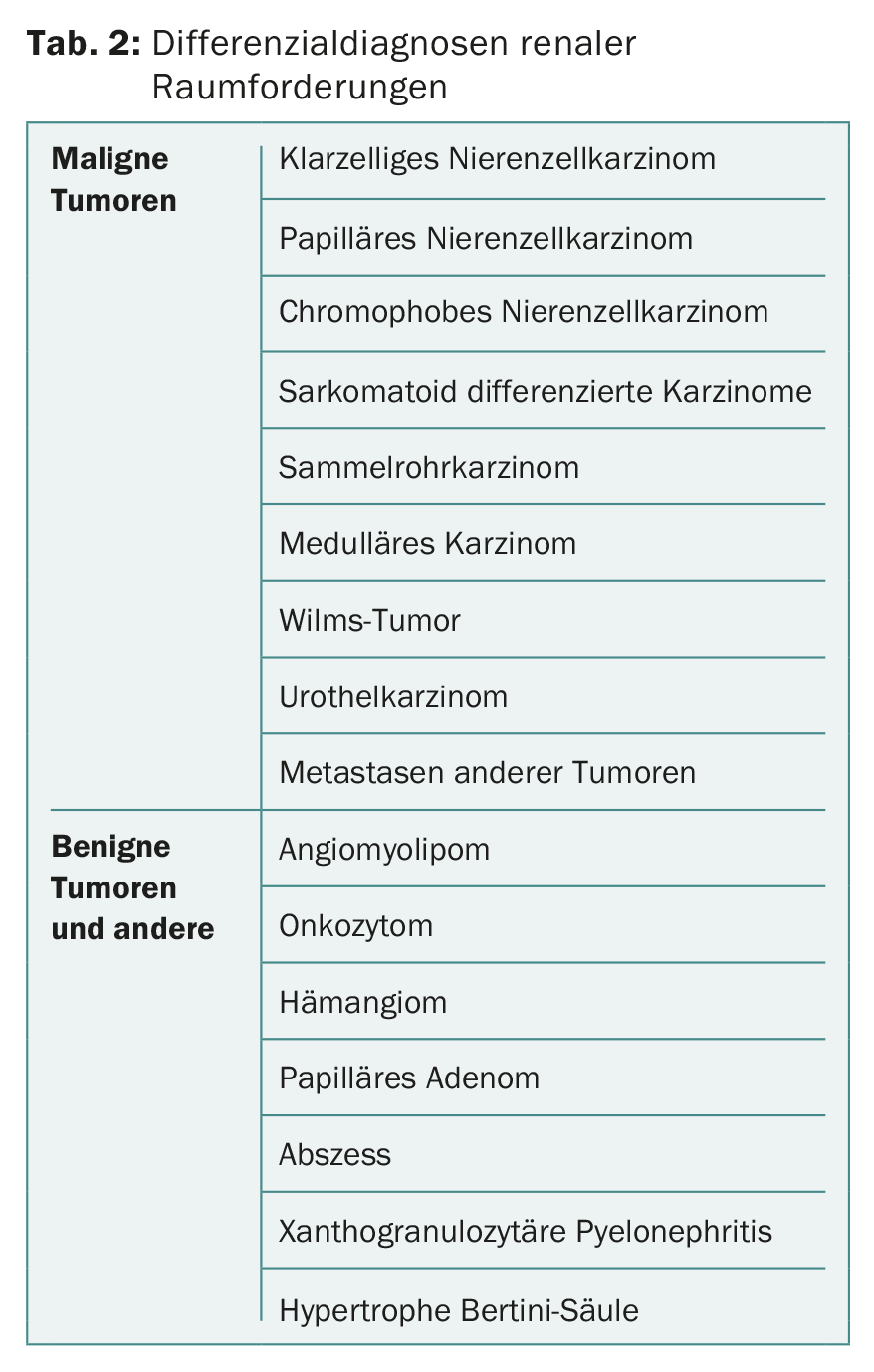
Enquanto que a biopsia do tumor renal percutâneo costumava ser praticamente contra-indicada devido a preocupações com as metástases de stents, está agora a ser realizada com cada vez maior frequência. A biopsia é particularmente importante para lesões radiologicamente pouco claras, para pequenos tumores renais antes da inclusão numa estratégia de vigilância activa, antes da terapia ablativa local ou na doença tumoral metastática para aquisição histológica [5,6,9]. No caso de tumores renais metástaseados, isto permite a escolha de um sistema terapêutico adequado. Uma biopsia do tumor renal também permite a diferenciação das metástases de outros tumores primários. Uma biópsia pode ser realizada quer por sonografia quer por TAC. Possíveis diagnósticos diferenciais de massas renais são mostrados no quadro 2.
Encenação
O estadiamento clínico do carcinoma de células renais está de acordo com a actual classificação TNM (Tab. 1) [5,10]. O sistema de classificação da OMS/ISUP (Organização Mundial de Saúde/Sociedade Internacional ou Patologia Urológica) substitui o sistema de classificação histológica desenvolvido nos anos 80 e mais utilizado internacionalmente, análogo ao da Fuhrmann [5,11,12].
Terapia cirúrgica
A terapia padrão para o carcinoma de células renais é geralmente a remoção cirúrgica completa do tumor [9]. No carcinoma localizado de células renais, isto é feito com intenção curativa. Historicamente, a nefrectomia radical foi o padrão de ouro durante muito tempo [6]. Hoje em dia, dependendo da localização e tamanho do tumor renal, uma técnica cirúrgica com nefrónio no sentido de uma ressecção parcial dos rins deve ser dirigida. A sobrevivência específica do tumor no carcinoma localizado de células renais parece ser comparável após ressecção renal parcial e nefrectomia [5]. Dados retrospectivos sugerem que a sobrevivência global é melhor após ressecção renal parcial para carcinoma localizado de células renais do que após nefrectomia [5, 13-15].
As actuais directrizes da UEA recomendam a realização de uma ressecção renal parcial para o carcinoma de células renais da fase T1 [5]. Em princípio, isto pode ser feito de forma aberta, laparoscópica ou assistida por robôs. Na fase T2, recomenda-se a nefrectomia laparoscópica se a ressecção parcial dos rins não puder ser realizada [5].
A adrenalectomia ipsilateral de rotina não parece conferir qualquer benefício de sobrevivência e, portanto, só é realizada se houver suspeita de infiltração de tumores [5]. As metástases dos gânglios linfáticos (pN+) estão associadas a um mau prognóstico. No entanto, os dados sobre o significado da linfadenectomia são controversos. Actualmente, de acordo com as actuais directrizes da UEA, a linfadenectomia só é recomendada em casos de suspeita clínica de metástases dos gânglios linfáticos (cN+) [5]. Se os gânglios linfáticos forem clinicamente inconspícuos, pode ser considerado para tumores grandes ou sarcomatóides diferenciados. No caso de carcinoma de células renais já metastasisadas, pode ser oferecida aos pacientes uma nefrectomia citoreducativa antes de iniciar uma terapia do sistema, especialmente no caso de grandes tumores renais [5].
Alternativas à cirurgia
Em doentes mais idosos com com comorbilidades relevantes e/ou esperança de vida limitada, podem ser discutidas alternativas à cirurgia para o carcinoma localizado de células renais. Em particular, pequenos tumores renais, diagnosticados incidentalmente, podem ser monitorizados regularmente com imagens nestes doentes (vigilância activa) [5,9]. A taxa de crescimento de tais lesões que ocupam espaço e o risco de progressão para a fase metastática é baixa [5,6]. Inicialmente, a confirmação histológica do diagnóstico por meio de uma biopsia do tumor renal pode ser útil com este conceito [6]. Não estão definidos gatilhos claros para mudar para tratamento activo. Opções de tratamento minimamente invasivas como a crioablação ou a ablação por radiofrequência (RFA) também podem ser discutidas numa população seleccionada de doentes [5,6]. Estes procedimentos são realizados quer percutaneamente quer com assistência laparoscópica. A situação actual dos dados ainda não permite uma avaliação conclusiva destas terapias no que diz respeito ao controlo de tumores e morbilidade. A embolização arterial selectiva pode ser considerada para tumores renais inoperáveis que são sintomáticos, por exemplo, com dor de flanco ou macrohaematúria [5].
Terapia do sistema de carcinoma de células renais
O tratamento sistémico do carcinoma de células ligeiras e renais avançado melhorou muito felizmente nos últimos anos. Embora responda mal à quimioterapia, há muito que se sabe que as reacções imunológicas desempenham um papel. Assim, estabilizações mais longas e mesmo regressões de metástases pulmonares ou linfonodais podem ser observadas após a remoção do tumor primário. Em 9% dos doentes com carcinoma metatásico de células renais, o tratamento com interferão-alfa pode produzir remissões, embora com uma toxicidade considerável. Esta última é ainda significativamente mais elevada com tratamentos com interleucina 2, mas podem ser observadas remissões impressionantes que duram anos em cerca de 10% dos doentes.
Em mais de 80% dos carcinomas de células renais leves, uma alteração bialélica do gene da BVS está presente no tumor, resultando num aumento da formação de VEGF (“factor de crescimento endotelial vascular”), que é um importante factor de crescimento. Vários inibidores da tirosina quinase podem inibir os receptores VEGF (bem como outros receptores) e demonstraram ser medicamentos eficazes no carcinoma metastático das células renais. Eles substituíram a maioria dos medicamentos acima mencionados.
Na terapia de primeira linha, o sunitinibe oral e o pazopanibe igualmente eficaz mas ligeiramente menos tóxico são actualmente as principais opções. Em ensaios randomizados, o sunitinibe mostrou uma resposta em 31% em comparação com 6% com o então padrão de interferão-alfa, e um prolongamento da progressão do tumor de cinco para onze meses. A sobrevivência também foi prolongada por 4,6 meses – para 26,4 meses. Os efeitos secundários podem incluir diarreia, hipertensão, fadiga, reacções cutâneas, cabelo branco e disfunção da tiróide, bem como distúrbios cardíacos. O cabozantinibe pode ser mais eficaz do que o sunitinib em terapia de primeira linha, de acordo com um novo ensaio de fase II, mas isto ainda precisa de ser confirmado num ensaio de fase III antes de se poder tornar o novo padrão.
O mecanismo de acção acima mencionado explica também a eficácia do anticorpo monoclonal bevacizumab, que liga o VEGF. A combinação com interferon-alfa é aprovada na terapia de primeira linha.
De acordo com dados do estudo, o inibidor everolimus do mTOR é outra opção para o carcinoma de células renais com um prognóstico mais pobre. Possíveis efeitos secundários são estomatite e efeitos secundários hematológicos. Uma indicação para a everolimus é o fracasso da terapia baseada em anti-VEGF.
Um inibidor da tirosina quinase também pode ser utilizado em terapia de segunda linha (como axitinibe ou sorafenibe). O inibidor da tirosina quinase cabozantinibe prolongou significativamente a sobrevivência (21,4 vs. 16,5 meses) na terapia de segunda linha em comparação com a everolimus [16]. A combinação de lenvatinibe com everolimus foi mesmo capaz de prolongar a sobrevivência por dez meses num ensaio de fase II.
Dados interessantes recentes mostram em parte resultados muito bons com imunoterapia (inibidores de pontos de controlo). Um ensaio fase III de nivolumab em terapia de segunda linha mostrou um prolongamento da mediana de sobrevivência em comparação com everolimus por 5,4 meses a 25 meses e uma taxa de resposta mais elevada de 25% vs. 5% [17]. Outra vantagem desta terapia é também a toxicidade geralmente muito mais baixa, incluindo várias doenças auto-imunes. Contudo, nós próprios também temos visto doentes com efeitos secundários graves (por exemplo, uma doença reumática invalidante que dura meses no sentido de polimialgia reumática). Recentemente, foi demonstrado (CHECKMATE-214 na ESMO 2017) que a imunoterapia combinada com nivolumab e ipilimumab é superior à terapia com sunitinibe na terapia de primeira linha, especialmente quando a PD-L1 é expressa, com uma resposta mais elevada de 58% vs. 25% e um tempo prolongado de progressão do tumor de 22,8 vs. 5,9 meses. As imunoterapias estão assim a passar para a terapia de primeira linha como resultado destes dados actuais. No entanto, esta superioridade sobre o sunitinib não se aplica aos pacientes do grupo de bom prognóstico.
A escolha da terapia de terceira linha é baseada nos tratamentos anteriores e no seu sucesso.
Tratamento adjuvante
Estudos sobre o tratamento adjuvante após cirurgia para carcinoma de células renais e em casos de alto risco de recidiva com diferentes substâncias foram negativos e controversos durante anos. Dados recentes [18] mostram que o sunitinib durante um ano como terapia adjuvante em ambientes de alto risco pode aumentar o tempo de recaída de 5,6 para 6,8 anos. No entanto, este é ainda actualmente um tratamento fora do âmbito do rótulo.
Mensagens Take-Home
- A idade principal de início do carcinoma de células renais situa-se entre os 60 e 70 anos de idade.
- Dependendo da localização e do tamanho do tumor renal, uma técnica cirúrgica com nefrónio deve ser orientada, se possível, para uma nefrónica.
- A biopsia do tumor renal percutâneo está a ser realizada com uma frequência crescente nos dias de hoje.
- A terapia do sistema de carcinoma de células renais está a mudar graças a novos medicamentos e combinações. Vários inibidores da tirosina cinase podem prolongar significativamente a sobrevivência em fases metastáticas. As imunoterapias (inibidores de pontos de controlo) também são eficazes em fases metastasisadas.
- O tratamento adjuvante é uma opção se o risco de recidiva for elevado.
Literatura:
- Torre LA, et al: Global Cancer Statistics, 2012. CA: A Cancer J Clin 2015; 65(2): 87-108.
- Ferlay J, et al: Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136(5): 359-386.
- Rede Europeia de Registos Oncológicos: Ficha informativa sobre o cancro do rim (KC). Fevereiro de 2017. www.encr.eu
- Shuch B, et al.: Compreender as variantes patológicas do carcinoma de células renais: Destilar oportunidades terapêuticas a partir da complexidade biológica. Eur Urol 2015; 67(1): 85-97.
- Ljungberg B, et al: Orientações da UEA sobre o Carcinoma de Células Renais. Associação Europeia de Urologia. Actualização limitada Março de 2017. www.uroweb.org
- Capitanio U, Montorsi F: cancro Renal. A Lanceta 2016; 387: 894-906.
- Israel GM, Bósniak M: Como o faço: avaliando as massas renais. Radiologia 2005; 236(2): 441-450.
- Warren KS, McFarlane J: A classificação Bósniak das massas císticas renais. BJU Int 2005; 95(7): 939-942.
- Schmid HP: Tendências em carcinoma de células renais – curso de esclarecimento e terapia localizada. info@oncologia 2015; 5: 27-30.
- Edge S, et al: AJCC Cancer Staging Manual. 7ª Edição. Nova Iorque: Springer-Verlag 2010.
- Moch H: O sistema de classificação da OMS/ISUP para o carcinoma renal. Patologista 2016; 37(4): 355-360.
- Dagher J, et al: Clear cell renal cell carcinoma: validation of World Health Organization/International Society of Urological Pathology grading. Histopatologia 2017 Jul 18. DOI: 10.1111/his.13311 [Epub ahead of Print].
- Roos FC, et al: Vantagem de sobrevivência da nefrectomia parcial sobre radical em pacientes que apresentam carcinoma localizado de células renais. BMC Cancer 2014; 14(1): 372.
- Zini L, et al: Nefrectomia radical versus nefrectomia parcial: Efeito na mortalidade global e não-cancerígena. Cancro 2009; 115(7): 1465-1471.
- Huang WC, et al: Nefrectomia parcial versus nefrectomia radical em doentes com pequenos tumores renais – Há uma diferença na mortalidade e nos resultados cardiovasculares? J Urol 2009; 181(1): 55-62.
- Choueiri TK, et al: Cabozantinib versus everolimus em carcinoma avançado de células renais (METEOR): resultados finais de um ensaio aleatório, de rótulo aberto, fase 3. Lancet Oncol 2016; 17: 917-927.
- Motzer RJ, et al: Nivolumab versus everolimus em carcinoma avançado de células renais. N Engl J Med 2015; 373: 1803-1813.
- Ravaud A, et al: Adjuvant sunitinib em carcinoma de células renais de alto risco após nefrectomia. N Engl J Med 2016; 375(23): 2246-2254.
InFo ONCOLOGy & HEMATOLOGy 2017; 5(6): 23-26