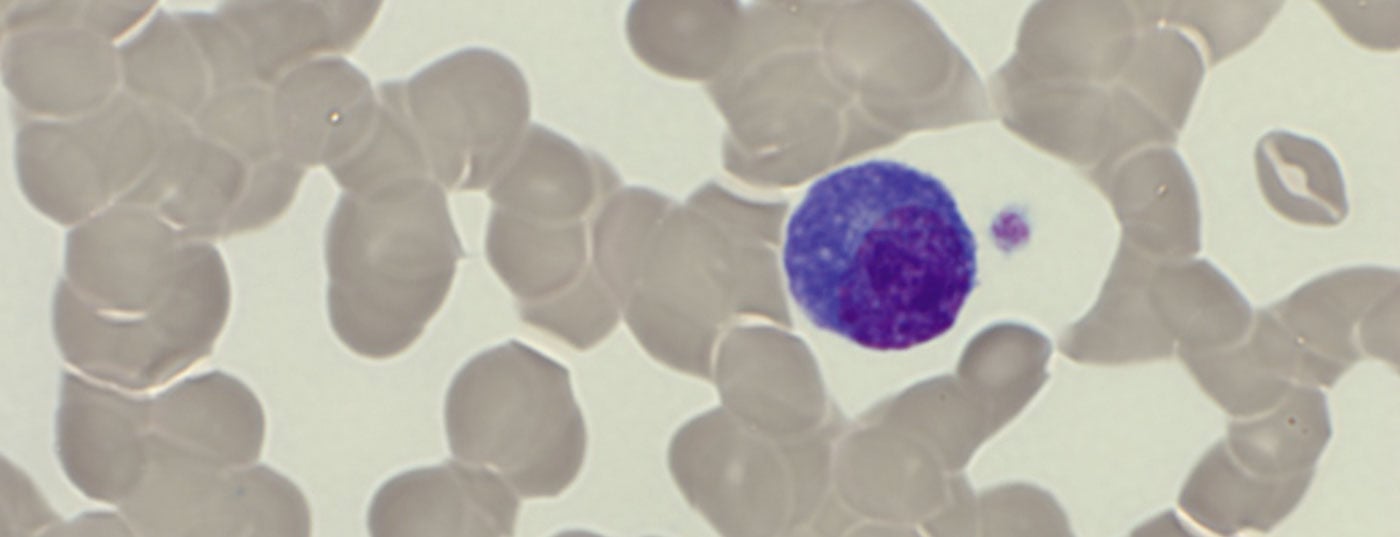
As plasmocitoses reactivas são raras, mas depois são frequentemente pronunciadas. Devem ser testados contra um reactivo (policlonal) e monoclonal Pproliferação de células lasma. O diagnóstico diferencial exacto permite uma terapia eficaz.
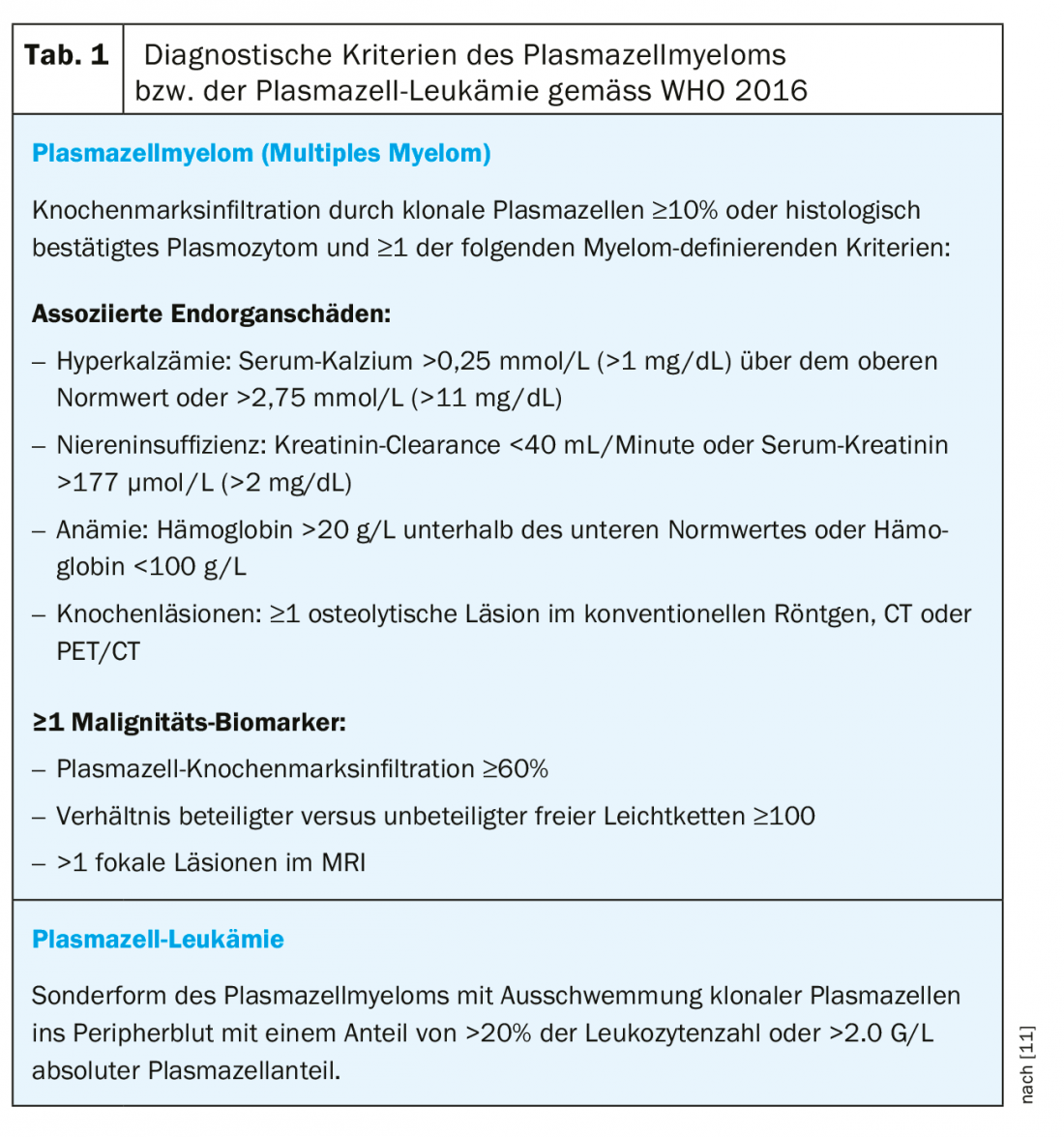
A plasmocitose reactiva foi descrita pela primeira vez em 1988 como proliferação de plasmócitos policlonais no sangue periférico e é globalmente rara [1,2]. As doenças associadas à proliferação de células plasmáticas reactivas incluem, por um lado, processos não-neoplásicos, tais como doenças auto-imunes, infecções e anemias de deficiência de substrato, e, por outro lado, processos neoplásicos malignos, especialmente doenças tumorais hematológicas [3,4]. Na maioria dos casos, a extensão da proliferação de plasmócitos é pequena e frequentemente limitada à medula óssea, mas é possível uma plasmocitose pronunciada e pode levar a um diagnóstico suspeito de leucemia plasmocítica (Tab. 1) [3–10].
Relatório de caso
Uma paciente de 70 anos de idade apresentou-se na ala de urgências de um hospital regional devido a uma dispneia aguda agravada. Duas semanas antes, o médico de clínica geral iniciou a terapia antibiótica para um quadro clínico de pneumonia. Devido à dispneia persistente para além da terapia antibiótica, foi realizado um tórax por TC, que revelou embolias pulmonares subsegmentares em ambos os lados e linfadenopatias difusas até um diâmetro máximo de 16 mm. A anticoagulação oral com edoxaban foi estabelecida e foi planeado um trabalho de linfadenopatias.
No serviço de urgência, o paciente apresentou taquidispneico com uma frequência respiratória de 35 /min e uma saturação de oxigénio de 93% abaixo de 5 litros de oxigénio por minuto. Os sinais vitais eram de outra forma os seguintes: BP 119/81 mmHg, pulso 81/min, temperatura 35,6°C. O exame físico revelou sons respiratórios obstrutivos e estridor inspiratório. O resto do exame físico não foi notável. Devido à respiração obstrutiva, 125 mg de metilprednisolona foi administrada a título experimental, o que levou a um alívio parcial da dispneia.
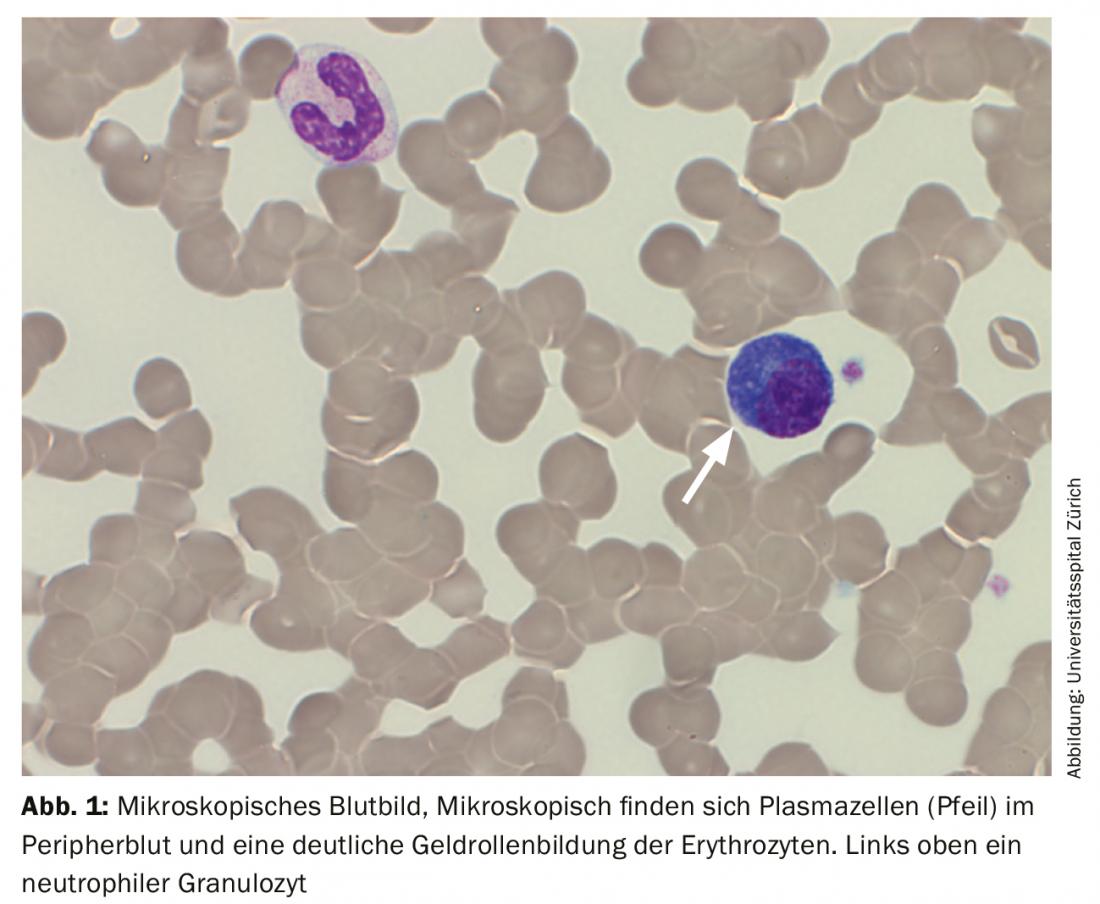
O sangue periférico mostrou anemia com uma hemoglobina de 77 g/L, valores normais de plaquetas e uma leucocitose de 20,4 G/L, devido a um washout de 29,5% de plasmócitos. Além disso, houve uma forte formação de rolos de gel dos eritrócitos como uma indicação da presença de paraproteinemia. Apropriadamente, houve um aumento total da proteína sérica de 106 g/L (intervalo de referência: 62-80 g/L) com uma ligeira diminuição simultânea da albumina de 28 g/L (intervalo de referência: 32-46 g/L) e um aumento da desidrogenase láctica (LDH) de 987 U/L (intervalo de referência: 232-430 U/L).
Esta constelação de descobertas levou à suspeita de diagnóstico de leucemia plasmocítica e a dispneia aguda foi interpretada como um possível sinal de síndrome de hiperviscosidade. Portanto, o paciente foi encaminhado para o nosso hospital central para avaliação da plasmaférese.
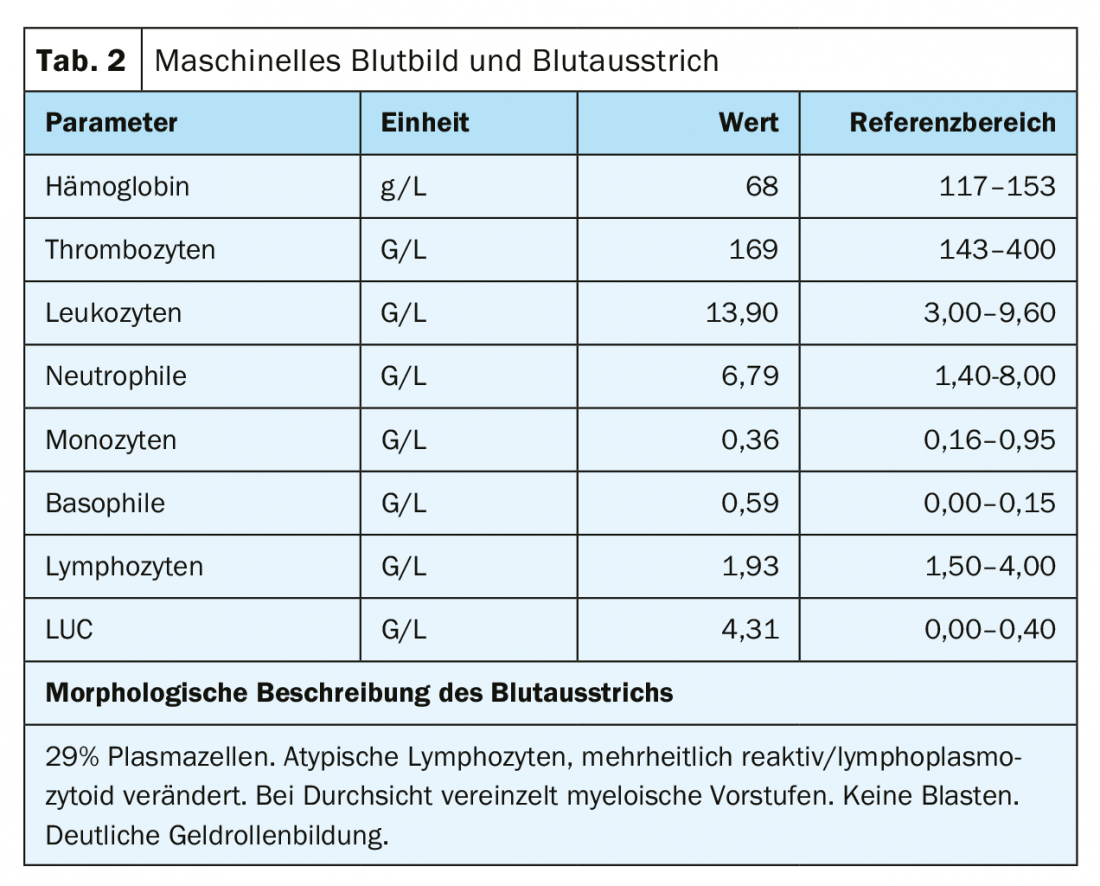
À admissão, o paciente encontrava-se numa condição cardiopulmonar estável com uma situação respiratória compensada. Não havia outros sintomas que exigissem tratamento, possivelmente associados à hiperviscosidade, de modo que não havia indicação de plasmaférese. O impressionante achado externo de 29% de plasmocitose periférica foi confirmado. (Tab. 2) (Fig. 1). Outras análises de sangue revelaram um aumento acentuado de imunoglobulinas (IgG, IgM, IgA) bem como de cadeias de luz livre no soro, mas com uma relação de cadeia de luz discreta. (Tab. 3). Uma ampla banda lambda IgM era detectável na imunofixação, mas não era possível uma diferenciação fiável entre uma banda clonal com di-/multimerização e um padrão policlonal. A β2-microglobulina também foi elevada a 17,6 mg/L (intervalo de referência <2,5 mg/L). Para um diagnóstico mais aprofundado, foi necessário proceder a uma clarificação da clonagem dos plasmócitos através da imunofenotipagem.
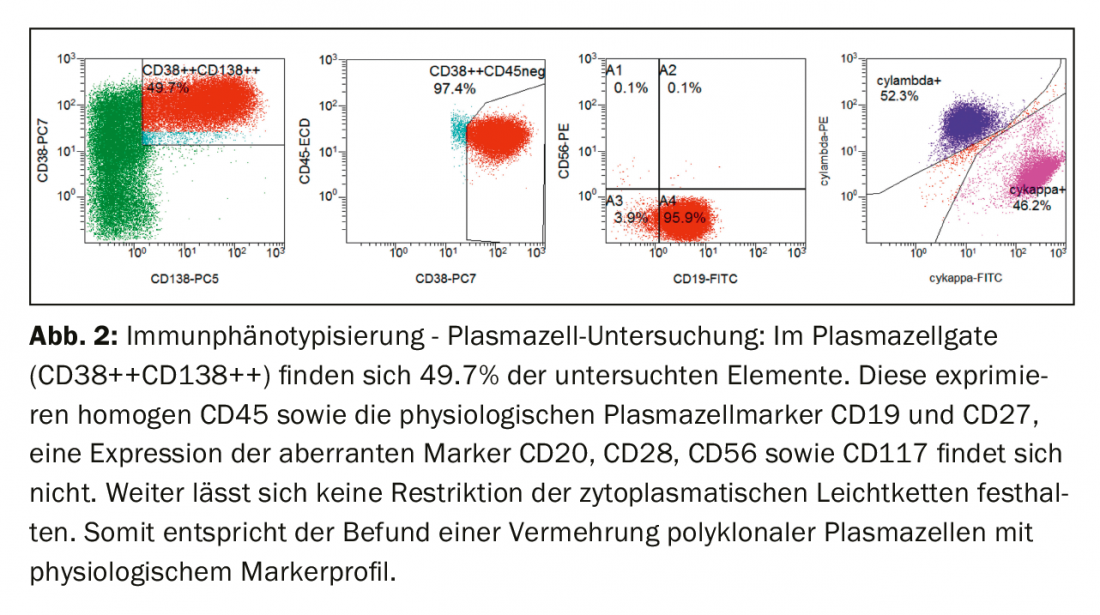
Imunofenotípicamente, os plasmócitos no sangue periférico foram claramente aumentados na porta clássica de plasmócitos (CD38++CD138+++). Estes mostraram a expressão do CD45 assim como os marcadores fisiológicos de células plasmáticas CD19 e CD27. A expressão de marcadores aberrantes (CD20, CD28, CD56 e CD117) não foi encontrada, nem houve restrição das cadeias de luz citoplasmáticas, de modo que, em resumo, houve uma proliferação de células plasma policlonais (Fig. 2).
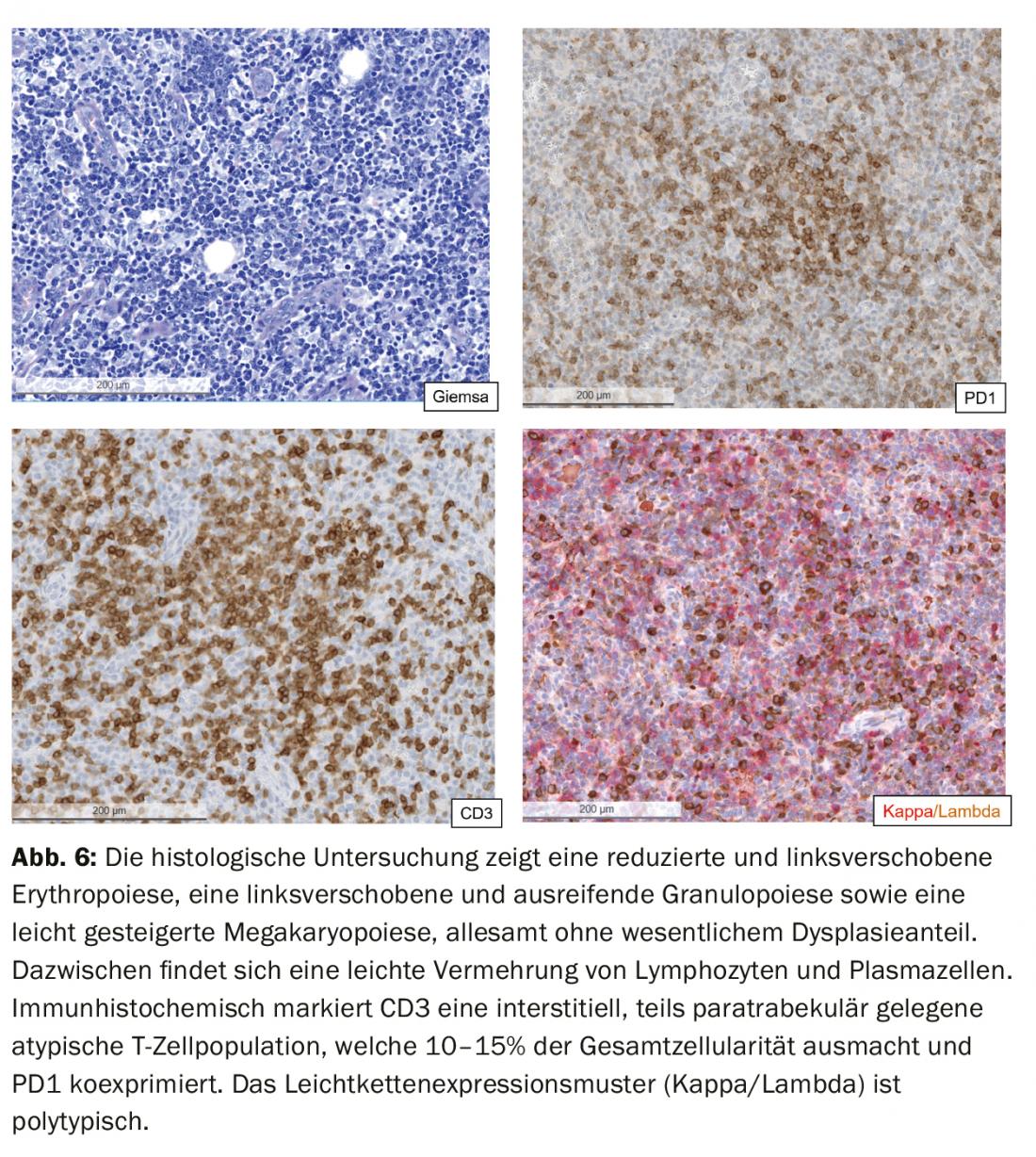
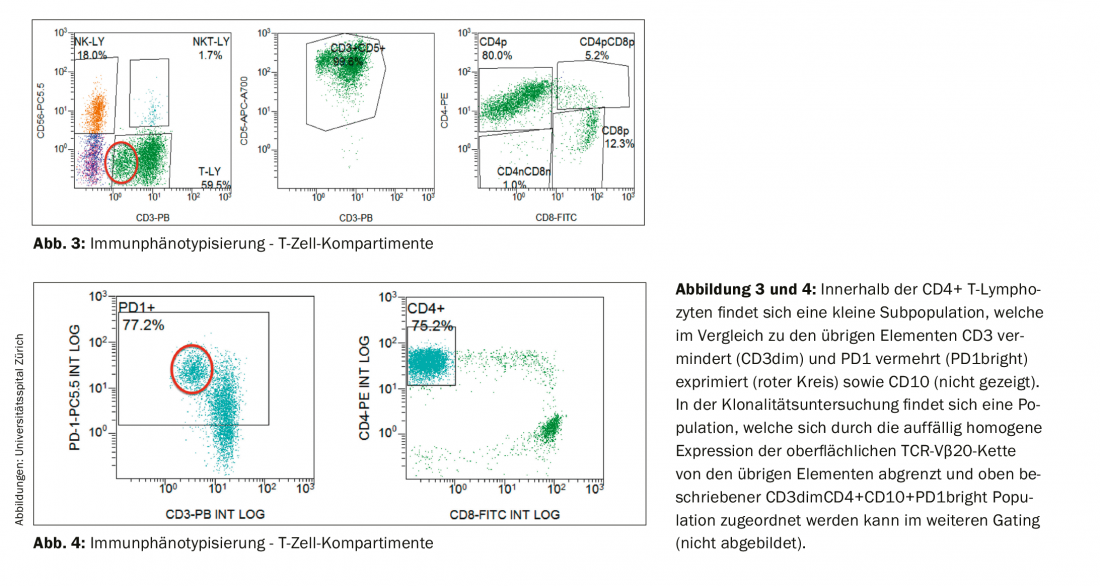
O exame imunofenotípico dos linfócitos permaneceu sem evidência de uma população de células B clonais. Em contraste, o compartimento de células T mostrou uma mudança na relação CD4:CD8 a favor dos linfócitos T CD4 positivos (no presente estudo 6,5:1; intervalo de referência em sangue periférico: relação CD4:CD8 2:1) bem como uma população pequena com expressão CD3 reduzida (CD3dim). (Fig.3). No exame de seguimento, um imunofenótipo CD4+CD3dimPD-1+CD10+ poderia ser atribuído a esta conspícua população (Fig. 4) e provou ser clonal à cadeia TCR-Vβ20 pela análise TCR. A descoberta foi assim consistente com um linfoma periférico de células T não-Hodgkin (T-NHL) do tipo linfoma angioimunoblástico de células T (AITL).
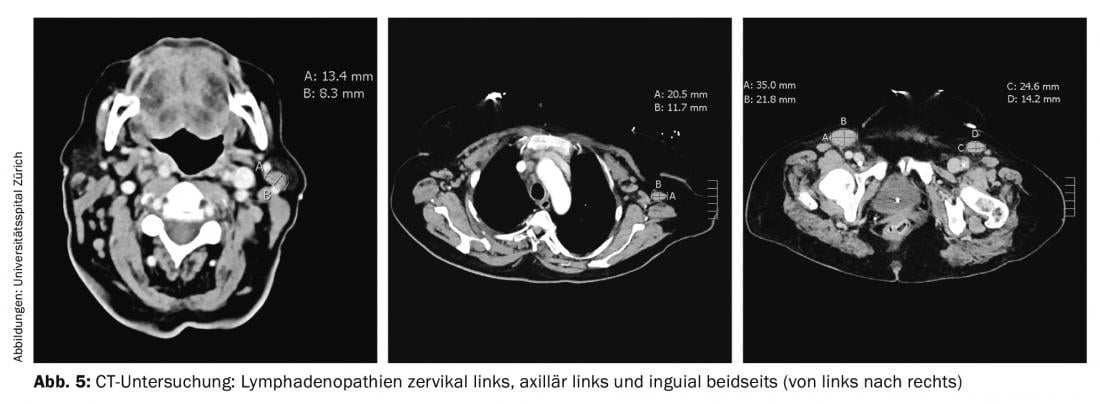
Devido à dispneia persistente, foi novamente realizada uma tomografia computorizada. O exame não revelou qualquer embolia pulmonar, mas existiam várias linfadenopatias, a maior das quais na região inguinal esquerda (35×22 mm) (Fig. 5). Consecutivamente, foi realizada uma excisão do gânglio axilar direito, onde foi confirmado o diagnóstico de linfoma angioimunoblástico de células T (AITL). O exame da medula óssea mostrou envolvimento medular por AITL com 10-15% de infiltração e proliferação de células plasma policlonais medulares em 20%.
Assim, foi feito o diagnóstico de linfoma angioimunoblástico de células T (AITL) Ann-Arbor estádio IV com plasmocitose reactiva. (Fig. 6). Inicialmente, foi administrada terapia citoreducativa com doses elevadas de corticosteróides, o que levou a uma rápida melhoria da condição clínica e a uma clara regressão da hiperglobulinemia G/M/A a curto prazo. (Tab. 3). Após a confirmação do diagnóstico, foi iniciada a terapia dirigida pela AITL com CHOP.
Definição
A plasmocitose é definida como proliferação de plasmócitos no sangue periférico e pode ser de origem neoplásica no sentido de uma doença plasmocítica clonal, mas também pode ser causada de forma reactiva [12]. A plasmocitose reactiva foi descrita pela primeira vez em 1988 por Peterson et al. descrito como “Proliferações imunoblásticas policlonais sistémicas” em quatro doentes com proliferação de plasmócitos policlonais no sangue periférico [1,2].
Na literatura, o termo plasmocitose é por vezes também equiparado à proliferação de plasmócitos em geral e o compartimento afectado (sangue periférico, medula óssea, outros tecidos) é especificado.
Epidemiologia e etiologia
A plasmocitose reactiva é um fenómeno raro, com poucos casos registados, enquanto a proliferação de plasmócitos reactivos na medula óssea é relativamente comum [13,14]. Batdorf et al. encontraram proliferação de plasmócitos (definida como >2,0% de conteúdo de plasmócitos) em 8,8% (303/3435) na sua análise de 3435 exames de medula óssea. Num estudo mais pequeno de Gupta et al. 830 exames de medula óssea foram processados e a proliferação de plasmócitos (definida como >3,5% de conteúdo de plasmócitos) foi registada em 13,7% (114/830) dos casos. Em ambos os estudos, a proliferação de plasmócitos foi devida ao mieloma plasmático em menos de 10% dos casos [3,4].
Causas não malignas tais como anemia por deficiência de substrato, anemia hemolítica, infecções (especialmente VIH), doenças auto-imunes e doenças hepáticas (especialmente na cirrose hepática), mas também foram observados processos malignos como doenças associadas à proliferação de plasmócitos reactivos. Estes últimos em 15,7% a 55,4% dos casos, a maioria dos quais eram tumores hematológicos [3,4]. A extensão da proliferação de plasmócitos foi entre 5-24% para a etiologia não neoplásica, menos de 10% para a anemia e entre 10-30% para a infecção e medula óssea hipoplásica [3]. A proliferação de plasmócitos reactivos também pode ser induzida por drogas. Por exemplo, um estudo de Zamarin et al. mostrou que em 20% dos doentes com mieloma de células plasma, a exposição prolongada à lenalidomida (>6 meses), ocorre hiperglobulinemia policlonal e proliferação de plasmócitos medulares de 5-20% (mediana de 12%) [15]. Este fenómeno está associado a uma sobrevivência prolongada sem progressão, o mecanismo não é claro.
Há apenas relatos de casos de plasmocitoses reactivas, mas não inesperadamente o espectro das doenças subjacentes é comparável: há relatos de plasmocitoses no contexto do vírus (hepatite A aguda, vírus Ebstein-Barr, parvovírus B19, dengue, vírus SFTS) mas também infecções bacterianas (S. aureus, K. pneumoniae) [5,7,10,16–20]. Um caso foi descrito num doente com síndrome de Sjögren [8]. Além disso, há vários casos de plasmocitose pronunciada em ligação com linfomas angioimunoblásticos de células T e num caso foi mesmo postulada uma ligação com um mieloma de células plasma coexistente [6,9,13,21,22]. Embora nos casos relatados tenha havido plasmocitose pronunciada em cada caso, as plasmocitoses reactivas são provavelmente na sua maioria leves; por exemplo, numa série de casos de Jego et al. apenas 2 em cada 10 pacientes tinham exsudação de plasmócitos >20% em [23].
Fisiopatologia
Nas proliferações reactivas de plasmócitos, existe uma mistura de precursores de plasmócitos (plasmablastos) e precursores (células plasma iniciais), todos com expressão homogénea CD45bright, enquanto na medula óssea normal e no mieloma de plasmócitos existe uma expressão heterogénea CD45 [24]. O mecanismo exacto que leva à proliferação não é conhecido, mas o aumento da libertação de citocinas parece provável como causa, especialmente porque a IL-2 e a IL-10 são fortes estímulos para a formação de plasmoblastos e células plasma precoces [25]. IL-6 melhora este efeito e é essencial para a sobrevivência das células plasmáticas [25,26].
O linfoma angioimunoblástico de células T é histologicamente caracterizado por um infiltrado polimórfico e inflamatório e está mais frequentemente associado a níveis elevados de citocinas séricas (incluindo IL-6 bem como IL-10) em comparação com outros linfomas periféricos de células T. Esta observação sugere que, nestes casos, a proliferação de plasmócitos reactivos associados é mediada por citocinose. Existem casos individuais descritos na literatura em que também foi encontrada uma proliferação de células plasma monoclonais [13,27,28].
Mensagens Take-Home
- As plasmocitoses reactivas são raras mas podem ser pronunciadas (lavagem de plasmócitos >20%).
- No caso de plasmocitose, a diferenciação entre a proliferação de plasmócitos reactivos (policlonais) e monoclonais é possível de forma rápida e fiável por meio da imunofenotipagem citométrica de fluxo a partir do sangue periférico.
- Os principais diagnósticos diferenciais são infecções, tumores malignos (especialmente tumores hematológicos) e doenças auto-imunes.
- O patomecanismo exacto não é claro; o aumento da libertação de citocinas (IL-2, IL-6, IL-10) como causa é possível.
Literatura:
- Peterson LC, Kueck B Fau-Arthur DC, Arthur Dc Fau-Dedeker K, et al: Proliferações imunoblásticas policlonais sistémicas.
- Li L, et al: Proliferação de plasmócitos policlonais com marcada hipergamaglobulinemia e múltiplos auto-anticorpos. Ann Clin Lab Sci 36, 479-484 (2006).
- Gupta M, et al: Perfil Etiológico de Plasmacitose em Aspirados de Medula Óssea. Dicle Medical Journal 43, 4, doi:10.5798/diclemedj.0921.2016.01.0628 (2016).
- Batdorf B, Kroft S, Olteanu H, Harrington A: Plasmacitose de medula óssea reactiva: Uma actualização para a era moderna. American Journal of Clinical Pathology 142, A102-A102, doi:10.1093/ajcp/142.suppl1.102 %J American Journal of Clinical Pathology (2014).
- Shtalrid M, Shvidel L, Vorst E: Plasmocitose Periférica de Plasmacitose Reactiva Policlonal Mimica a Leucemia de Células Plasmáticas num Paciente com Sepsis Estafilocócica. Leucemia e linfoma 44, 379-380, doi:10.1080/1042819021000029713 (2003).
- Ahsanuddin AN, Brynes RK, Li S: Plasmocitose policlonal do sangue periférico imitando a leucemia plasmática em pacientes com linfoma angioimunoblástico de células T: relatório de 3 casos e revisão da literatura. Int J Clin Exp Pathol 4, 416-420 (2011).
- Desborough MJ, Grech H: aplasia da medula óssea e plasmocitose de Epstein-Barr que imita uma neoplasia de plasmócitos. Br J Haematol 165, 272, doi:10.1111/bjh.12721 (2014).
- Lee J, Chang Je Fau-Cho YJ, Cho Yj Fau-Han, et al: caso de plasmocitose reactiva que imita o mieloma múltiplo num doente com síndrome de Sjogren primário.
- Sokol K, et al: Extreme Peripheral Blood Plasmacytosis Mimicking Plasma Cell Leukemia como Característica Atual do Linfoma Angioimunoblástico de Células T (AITL). Front Oncol 9, 509, doi:10.3389/fonc.2019.00509 (2019).
- Zhang J, et al: Plasmocitose reactiva imitando o mieloma múltiplo associado à infecção pelo vírus SFTS: um relatório de dois casos e revisão da literatura. BMC Infect Dis 18, 528, doi:10.1186/s12879-018-3431-z (2018).
- SH S, et al: WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues (Classificação de tumores de tecidos hematopoiéticos e linfóides da OMS). IARC Press, Lyon WHO Classification of Tumours, Revised 4th Edition, Volume 2 (2017).
- J., B. B., Karl-Anton K: Das Blutbild – Diagnostische Methoden und klinische Interpretation. De Gruyter (2017).
- Xu J. et al: Linfoma angioimunoblástico de células T com mieloma de células plasma coexistente: um relato de caso e revisão da literatura. Tohoku J Exp Med 235, 283-288, doi:10.1620/tjem.235.283 (2015).
- Pellat-Deceunynck C, et al.: Plasmocitoses reactivas, um modelo para estudar a biologia dos progenitores e precursores de plasmócitos humanos. The hematology journal: the official journal of the European Haematology Association / EHA 1, 362-366, doi:10.1038/sj/thj/6200053 (2000).
- Zamarin D, et al.: Activação imunitária policlonal e plasmocitose de medula em doentes com mieloma múltiplo que recebem terapia de lenalidomida de longa duração: incidência e significado prognóstico. Leucemia 27, 2422-2424, doi:10.1038/leu.2013.126 (2013).
- Wada T, et al: Plasmocitose periférica reactiva do sangue num doente com hepatite A aguda.
- Koduri PR, Naides SJ: Plasmocitose do sangue transitório na infecção por parvovírus B19: um relatório de dois casos. Ann Hematol 72, 49-51, doi:10.1007/bf00663017 (1996).
- Thai KT, et al: Alta incidência de plasmocitose periférica do sangue em doentes com infecção pelo vírus da dengue. Clin Microbiol Infect 17, 1823-1828, doi:10.1111/j.1469-0691.2010.03434.x (2011).
- Wada T, Iwata Y, Kamikawa Y, et al: Plasmocitose periférica do sangue em febre grave com síndrome de trombocitopenia. Jpn J Infect Dis 70, 470-471, doi:10.7883/yoken.JJID.2016.575 (2017).
- Moon Y, et al: Klebsiella pneumoniae associada à plasmacitose extrema. Infect Chemother 45, 435-440, doi:10.3947/ic.2013.45.4.435 (2013).
- Sakai H, et al: Linfoma angioimunoblástico de células T que se apresenta inicialmente com substituição da medula óssea e plasmocitose periférica. Intern Med 46, 419-424, doi:10.2169/internalmedicina.46.6121 (2007).
- Yamane A, Awaya N, Shimizu T, et al: Linfoma angioimunoblástico de células T com proliferação policlonal de plasmócitos no sangue periférico e medula óssea. Acta Haematol 117, 74-77, doi:10.1159/000096894 (2007).
- Jego G, et al.: As plasmocitoses reactivas são expansões de plasmastos que retêm a capacidade de se diferenciarem em plasmócitos.
- Pellat-Deceunynck C, Bataille R: plasmócitos humanos normais e malignos: proliferação, diferenciação, e expansões em relação à expressão CD45. Células sanguíneas Mol Dis 32, 293-301, doi:10.1016/j.bcmd.2003.12.001 (2004).
- Jego G, Bataille R, Pellat-Deceunynck C: Interleukin-6 é um factor de crescimento para os plasmasblastos humanos não-malignos. Blood 97, 1817-1822, doi:10.1182/blood.v97.6.1817 (2001).
- Jourdan M, et al.: IL-6 apoia a geração de plasmócitos humanos de longa duração em combinação com APRIL ou factores solúveis em células do estroma. Leucemia 28, 1647-1656, doi:10.1038/leu.2014.61 (2014).
- Dogan A, Attygalle AD, Kyriakou C: Linfoma angioimunoblástico de células T. Br J Haematol 121, 681-691, doi:10.1046/j.1365-2141.2003.04335.x (2003).
- Yi JH, Ryu KJ, Ko YH, et al: Perfis de citocinas séricas e suas implicações clínicas em doentes com linfoma periférico de células T. Cytokine 113, 371-379, doi:10.1016/j.cyto.2018.10.009 (2019).
InFo ONCOLOGy & HEMATOLOGy 2020; 8(1): 4-8