Os tratamentos sistémicos inovadores para a psoríase são um excelente exemplo de medicina translacional. Numa análise publicada no ano passado no Journal of Investigative Dermatology, o Prof. Peter van de Kerkhof, antigo Presidente da Sociedade Europeia de Investigação Dermatológica (ESDR) e Director Médico do Conselho Internacional da Psoríase, apresenta uma actualização dos conceitos imunopatogenéticos relevantes para a terapêutica da psoríase.
Nas últimas décadas, foram feitos progressos consideráveis na elucidação da patogénese complexa e multifactorial da psoríase, como base para o desenvolvimento de opções terapêuticas altamente eficazes [1]. Actualmente, a nível celular e molecular, uma resposta imunitária mediada por células T e um meio de citocinas característico associado são considerados o mecanismo patogénico essencial [2]. A nível genético, foram identificados numerosos loci genéticos associados à psoríase. O HLA-C*06:02 é considerado o principal alelo de risco da psoríase vulgar [3]. Este está localizado no locus de susceptibilidade à psoríase PSORS1. A evidência de mecanismos patogénicos auto-imunes na psoríase foi fornecida pela descoberta de que o HLA-C*06:02 provocava uma resposta auto-imune contra o ADAMTSL5, um auto-antigénio melanocítico [17,18]. Para além do ADAMTSL5, o LL-37/Cathelicidin e o PLA2G4D são dois outros potenciais autoantigénios que parecem desempenhar um papel no início ou na manutenção das lesões psoriáticas [19].
A psoríase como uma doença auto-imune mediada por células T
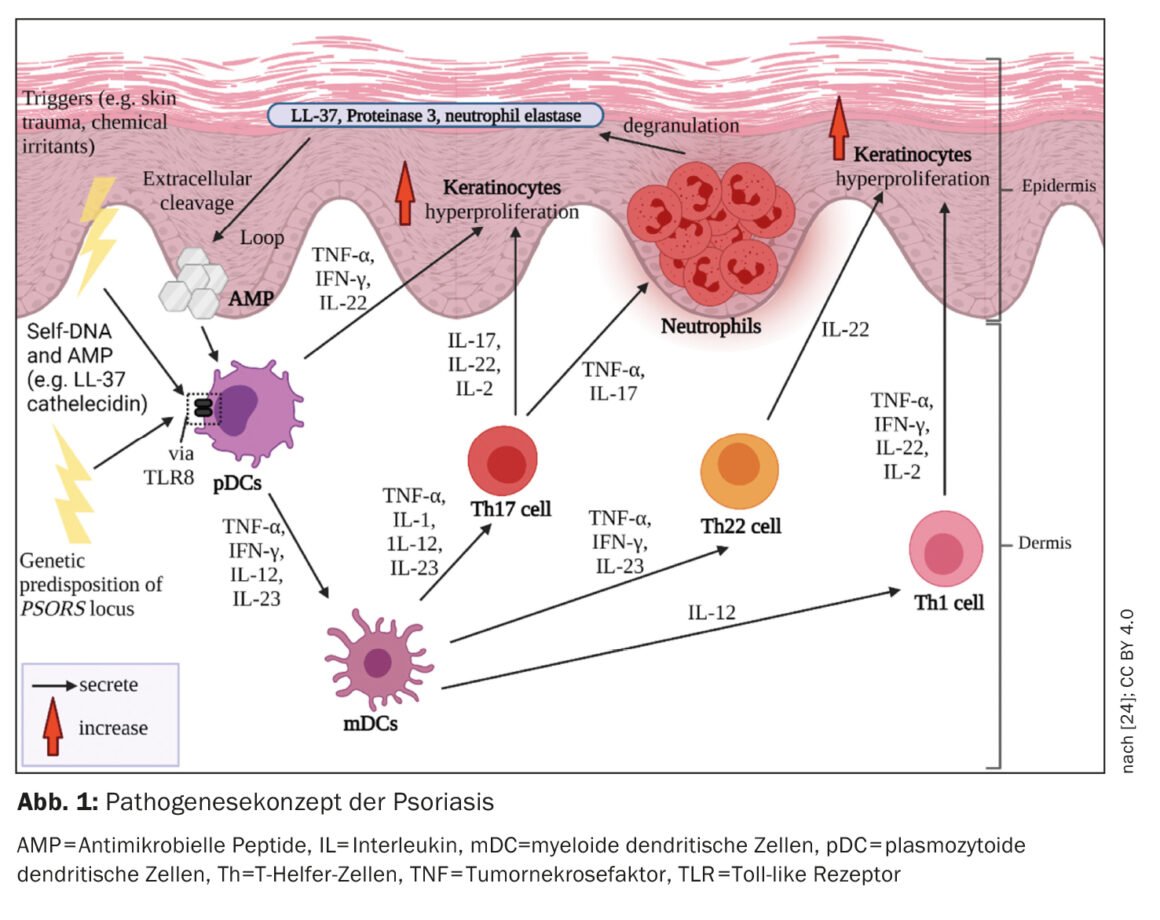
Os processos do sistema imunitário inato e adquirido estão envolvidos na imunopatogénese da psoríase (Fig. 1). Is células do sistema imunitário inato estão envolvidas no início da cascata inflamatória. Neste caso, as células dendríticas (DC) e os macrófagos parecem desempenhar um papel fundamental no estabelecimento de uma resposta imunitária dominada pelas células T helper-1 (Th1) e Th17. A activação das CD na pele leva à libertação de interleucinas-12 (IL-12) e IL-23, que estimulam as células T naïve a diferenciarem-se em células Th1 (por IL-12) e Th17 (por IL-23) [4]. As células T helper (Th) coordenam a resposta imunitária adaptativa mediada por células. As células Th1 e Th17 activadas segregam as citocinas IFN-γ e TNF-α e IL-17 e IL-22, respectivamente, que conduzem a uma maior patogénese [5,6].
Ambiente pró-inflamatório
Na psoríase, a resposta imunitária é principalmente mediada por células Th1. enquanto que na dermatite atópica existe uma predominância Th2. As populações de células T em biópsias de lesões psoriáticas, que mostraram diferentes infiltrados de células T em comparação com lesões no contexto de dermatite atópica no mesmo doente, confirmam o paradigma Th1/Th2 [1,8]. TNF-α, IFN-γ, IL-17A, IL-17F, IL-22 e IL-6 formam uma rede de citocinas nas lesões psoriáticas que, entre outras coisas, induz a hiperproliferação de queratinócitos [1]. O processo de diferenciação acelerada dos queratinócitos encurta o seu tempo de trânsito do estrato basal para o estrato córneo de cerca de 30 para 5-8 dias [9]. O resultado é a descamação e o espessamento da epiderme típicos da psoríase. Os queratinócitos activados também produzem mediadores pró-inflamatórios e expressam moléculas de adesão na superfície celular, levando à amplificação e cronificação da resposta imunitária [10].
Memória imunológica: Células T de memória residentes nos tecidos
As lesões psoriáticas têm uma contagem total de células imunitárias mais elevada em comparação com a pele saudável [11]. Mesmo na pele dos doentes com psoríase, que clinicamente não apresenta lesões, foi possível detectar um número mais elevado de células T do que na pele saudável [11]. A acumulação intra-epidérmica de células CD8 é crucial para o desenvolvimento de lesões psoriáticas [1]. Mas como é que isso acontece? Depois de os auto-antigénios serem apresentados às células dendríticas, ocorre a activação das células T. As células T activadas migram para a epiderme, sendo necessários processos complexos para entrar na epiderme – suspeita-se que as integrinas α1β1 desempenham um papel importante neste processo. O bloqueio de α1β1 por um anticorpo monoclonal resultou na acumulação de células T epidérmicas e no desenvolvimento de lesões psoriásicas no modelo de ratinho [12].
As células T, que estão localizadas na epiderme, desempenham um papel extremamente importante na patogénese da psoríase. Nas placas psoriásicas, as células CD4-positivas encontram-se principalmente na derme e as células CD8-positivas predominantemente na epiderme [13]. Uma grande proporção de células CD8-positivas na epiderme pertence às “células T de memória residente nos tecidos” (células TRM, CD8+ TRM). Trata-se de células T de memória que permanecem nas lesões psoriásicas limpas e mantêm uma memória imunológica, o que explica o facto de as lesões psoriásicas recidivarem frequentemente nos mesmos locais [14]. Os TRM CD8+ são um potencial biomarcador da actividade residual da doença [15,16].
Revisão da história clínica: terapias sistémicas antipsoriáticas
Na década de 1980, estudos com o imunossupressor ciclosporina A, que se revelou eficaz no tratamento da psoríase, confirmaram que se tratava de uma doença mediada por células T [26,27]. A Ciclosporina inibe a fosfatase calcineurina no citoplasma, bloqueando assim a fosforilação do factor nuclear das células T (NFATc), responsável pela activação dos genes de várias citocinas pró-inflamatórias [1]. Os efeitos antipsoriáticos dos anticorpos anti-CD4 e CTLA-4-Ig [28,29] dão mais apoio à tese de que as células T são um importante alvo terapêutico. Na década de 1990, um grupo de investigação dos EUA demonstrou que as lesões podiam ser induzidas através da injecção de células T autólogas em pele psoriática não doente enxertada em ratinhos SCID [30]. No mesmo modelo, foi demonstrado que os linfócitos T CD4+ induzem lesões psoriásicas em pele psoriásica não doente [31].
| Anticorpos monoclonais e pequenas moléculas Os medicamentos biológicos revolucionaram as opções de tratamento da psoríase. Com as substâncias activas biológicas actualmente disponíveis, é possível obter um controlo eficaz e seguro das doenças a longo prazo. Embora a utilização de anticorpos anti-TNF-α possa atingir um PASI75# na maioria dos doentes, os anticorpos anti-IL17A e anti-IL-23 conduzem a um PASI100** em cerca de metade dos doentes, realçando a importância da via IL-23/IL-17 na psoríase. A eficácia dos medicamentos biológicos foi comparada em meta-análises de rede [20]. Dependendo das características do doente, incluindo quaisquer co-morbilidades que possam estar presentes, é preferível uma ou outra classe de substâncias. Na Suíça, para além dos inibidores do TNF-α e do anticorpo anti IL12-/23 ustekinumab, estão actualmente aprovadas várias substâncias activas dos grupos dos anticorpos anti-IL17A (secukinumab, ixekizumab) e dos anticorpos anti-IL-23 (guselkumab, risankizumab, tildrakizumab) [25]. E o inibidor IL17A/17F bimekizumab também já ultrapassou os obstáculos à aprovação [25]. No domínio das “pequenas moléculas”, o inibidor da PDE-4 apremilast é um medicamento oral aprovado. Além disso, estão actualmente a ser testados clinicamente o deucravacitinib (TYK2-i oral), o roflumilast (PDE-4-i tópico) e o tapinarof (agonista AHR tópico) [21–23]. |
| # PASI75 = uma melhoria do PASI (Psoriasis Area and Severity Index) de pelo menos 75%. ** PASI 100 = uma melhoria de 100% no PASI (Psoriasis Area and Severity Index). |
As células CD4+ Th são conhecidas por segregarem várias citocinas. A importância destas substâncias mensageiras na patogénese da psoríase é confirmada pela excelente resposta terapêutica com a neutralização específica de citocinas individuais do sistema imunitário. Em primeiro lugar, verificou-se que o bloqueio do TNF-α ajudava a aliviar a psoríase [32,33]. O ustekinumab, um medicamento biológico dirigido contra a subunidade comum p40 da IL-12 e da IL-23, foi posteriormente aprovado e demonstrou uma boa eficácia na psoríase [1]. Os anticorpos monoclonais que visam selectivamente a subunidade p19 da IL-23 (guselkumab, risankizumab, tildrakizumab) demonstraram ser ainda mais eficazes (caixa). Os medicamentos biológicos que têm como alvo a IL-17A (secukinumab, ixekizumab) ou que provocam a inibição dupla da IL-17A e da IL17F (bimekizumab) são também altamente eficazes (ver caixa).
Para além das várias classes de medicamentos biológicos (antagonistas do TNFα, IL-17, IL-12/23 ou IL-23) e da terapêutica sistémica convencional (ciclosporina A, metotrexato, acitretina ou ésteres do ácido fumárico), os agentes de pequenas moléculas também desempenham um papel na terapia medicamentosa da psoríase. O Apremilast é um inibidor oral da PDE-4 (fosfodiesterase-4) aprovado para o tratamento da psoríase, entre outras doenças. Os efeitos anti-inflamatórios do apremilast são provocados por um aumento dos níveis intracelulares de AMPc. Além disso, o Roflumilast, um inibidor da PDE-4 de aplicação tópica, está actualmente a ser testado em ensaios clínicos [34]. O mesmo se aplica a outros representantes das “pequenas moléculas ” (caixa) .
Literatura:
- van de Kerkhof PC: From Empirical to Pathogenesis-Based Treatments for Psoriasis. J Invest Dermatol 2022; 142(7): 1778–1785.
- Di Meglio P, Villanova F, Nestle FO: Psoriasis. Cold Spring Harb Perspect Med 2014; 4(8): 1–30.
- Prinz JC: Human Leukocyte Antigen-Class I Alleles and the Autoreactive T Cell Response in Psoriasis Pathogenesis. Front Immunol 2018; 9: 954.
- Schäkel K, Schön M, Ghoreschi K: Pathogenese der Psoriasis vulgaris. Der Hautarzt 2016; 67(6): 422–431.
- Di Cesare A, Di Meglio P, Nestle FO: The IL-23/Th17 axis in the immunopathogenesis of psoriasis. Journal of Investigative Dermatology 2009; 129(6): 1339–1350.
- Lynde CW, et al.: Interleukin 17A: toward a new understanding of psoriasis pathogenesis. Journal of the American Academy of Dermatology 2014; 71(1): 141–150.
- Johansen C, et al.: Inverse regulation of the nuclear factor-κB binding to the p53 and interleukin-8 κB response elements in lesional psoriatic skin. Journal of investigative Dermatology 2005; 124(6): 1284–1292.
- Eyerich S, et al.: Mutual antagonism of T cells causing psoriasis and atopic eczema.N Engl J Med 2011; 365: 231–238.
- Schneider S, Li L, Zink A: Psoriasis – Differentialdiagnosen und Therapie. Akt Rheumatol 2022; 47: 324–332.
- Greb JE, et al.: Psoriasis. Nature Reviews Disease Primers 2016; 2: 16082.
- Lowes MA, et al.: Increase in TNF-alpha and inducible nitric oxide synthase-expressing dendritic cells in psoriasis and reduction with efalizumab (anti-CD11a). Proc Natl Acad Sci U S A 2005; 102: 19057–19062.
- Conrad C, et al.: Alpha1beta1 integrin is crucial for accumulation of epidermal T cells and the development of psoriasis. Nat Med 2007; 13: 836–842.
- Bovenschen HJ, Seyger MM, van de Kerkhof PC: Plaque psoriasis vs. atopic dermatitis and lichen planus: a comparison for lesional T-cell subsets, epidermal proliferation and differentiation. Br J Dermatol 2005; 153: 72–78.
- Clark RA: Resident memory T cells in human health and disease. Sci Transl Med. 2015 Jan 7; 7(269): 269rv1.
- Cheuk S, et al. Epidermal Th22 and Tc17 cells form a localized disease memory in clinically healed psoriasis. J Immunol 2014; 192: 3111–3120.
- Benezeder T, Wolf P: Resolution of plaque-type psoriasis: what is left behind (and reinitiates the disease). Semin Immunopathol 2019; 41: 633–644.
- Prinz JC: Melanocytes: Target Cells of an HLA-C*06:02-Restricted Autoimmune Response in Psoriasis. J Invest Dermatol 2017; 137(10): 2053–2058.
- Arakawa A, et al.: Melanocyte antigen triggers autoimmunity in human psoriasis. J Exp Med 2015; 212(13): 2203–2212.
- Hawkes JE, Chan TC, Krueger JG: Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol 2017; 140(3): 645–653.
- Armstrong AW, et al.: Comparison of biologics and oral treatments for plaque psoriasis: a meta-analysis. JAMA Dermatol 2020; 156: 258–269.
- Papp K, et al.: Phase 2 trial of selective tyrosine kinase 2 inhibition in psoriasis. N Engl J Med. 2018; 379: 1313–1321.
- Lebwohl MG, et al.: Trial of roflumilast cream for chronic plaque psoriasis. N Engl J Med. 2020; 383: 229–239.
- Robbins K, et al.: Phase 2, randomized dose-finding study of tapinarof (GSK2894512 cream) for the treatment of plaque psoriasis. J Am Acad Dermatol 2019; 80: 714–772.
- Mohd Noor AA, Azlan M, Mohd Redzwan N: Orchestrated Cytokines Mediated by Biologics in Psoriasis and Its Mechanisms of Action. Biomedicines. 2022 Feb 20;10(2): 498. www.mdpi.com/2227-9059/10/2/498, (último acesso 15.03.3023)
- Informações sobre medicamentos, www.swissmedicinfo.ch,(último acesso em 15.03.2023)
- Ellis CN, et al.: Cyclosporine improves psoriasis in a double-blind study. JAMA 1986; 256: 3110–3116
- Griffiths CE, et al.: Clearance of psoriasis with low dose cyclosporin. Br Med J (Clin Res Ed) 1986; 293: 731–732.
- Abrams JR, et al.: Blockade of T lymphocyte costimulation with cytotoxic T lymphocyte-associated antigen 4-immunoglobulin (CTLA4Ig) reverses the cellular pathology of psoriatic plaques, including the activation of keratinocytes, dendritic cells, and endothelial cells. J Exp Med 2000; 192: 681–694.
- Nicolas JF, et al.: CD4 antibody treatment of severe psoriasis. Lancet 1991; 338: 321
- Wrone-Smith T, Nickoloff BJ: Dermal injection of immunocytes induces psoriasis. J Clin Invest. 1996; 98: 1878–1887.
- Nickoloff BJ, Wrone-Smith T: Injection of pre-psoriatic skin with CD4+ T cells induces psoriasis. Am J Pathol 1999; 155: 145–158.
- Zaba LC, et al. : Amelioration of epidermal hyperplasia by TNF inhibition is associated with reduced Th17 responses [published correction in J Exp Med 2008;205:1941]. J Exp Med. 2007; 204: 3183–3194.
- Zaba LC, et al.: et al. Effective treatment of psoriasis with etanercept is linked to suppression of IL-17 signalling, not immediate response TNF genes. J Allergy Clin Immunol. 2009; 124: 1022–1030.E395
- Lebwohl MG, et al.: Trial of roflumilast cream for chronic plaque psoriasis. N Engl J Med. 2020; 383: 229–239.
DERMATOLOGIE PRAXIS 2023; 33(2): 20–22