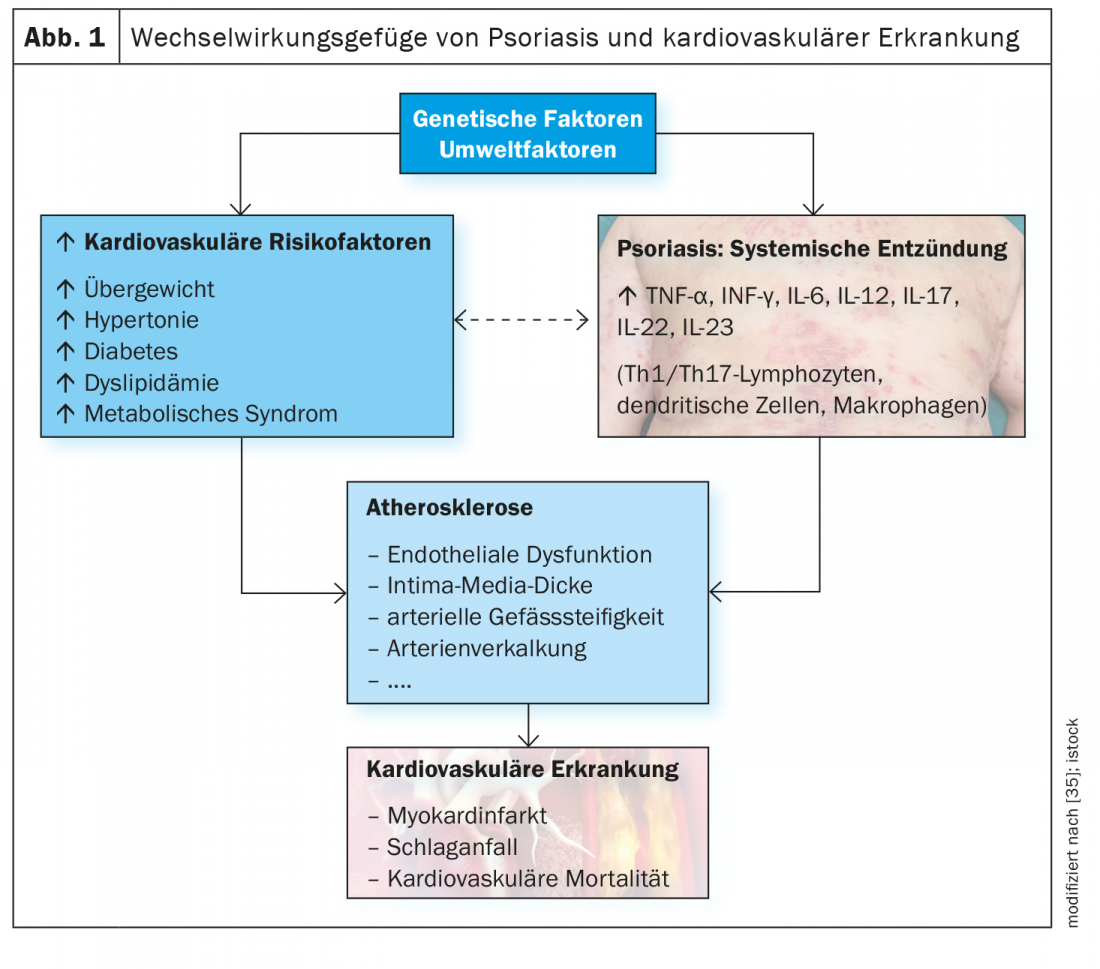
O eixo IL23/Th17 desempenha um papel importante na fisiopatologia da psoríase. Um conjunto crescente de evidências sugere que os processos inflamatórios estão envolvidos em muitas doenças cardiovasculares e metabólicas associadas à psoríase. E há provas de que a upregulação da via IL23/Th17 desempenha um papel importante nas comorbilidades cardiometabólicas na psoríase.
As doenças cardiovasculares e metabólicas estão entre as comorbidades mais comuns da psoríase de placa moderada a grave e contribuem para um aumento do risco de mortalidade [1]. De acordo com dados epidemiológicos, a doença cardiovascular (DCV) é a causa de morte mais comum ou a segunda causa de morte mais comum em doentes com psoríase [2–4]. Especialmente em doentes com psoríase grave, o risco de eventos cardiovasculares é consideravelmente aumentado em comparação com a população em geral (enfarte do miocárdio: RR 1,70-3,04; AVC: RR 1,38-1,59; mortalidade cardiovascular: 1,37-1,39) [5–8]. Para além dos perfis lipídicos anormais e do stress oxidativo, pensa-se que os processos inflamatórios estão envolvidos no desenvolvimento de alterações ateroscleróticas e num aumento associado do risco cardiovascular [9,10]. Há cada vez mais provas de que a inflamação crónica e a desregulamentação imunitária desempenham um papel importante e que a via IL23/Th17, entre outras, está envolvida.
Coronariopatia
O risco de enfarte do miocárdio como manifestação de doença coronária (CHD) é aumentado até três vezes em comparação com os não-psoriásicos [11–13]. Os polimorfismos genéticos da IL23-R parecem estar associados ao risco e à gravidade da aterosclerose [14,15]. Vários estudos mostram associações entre a IL23 e o enfarte do miocárdio. Yan et al. conseguiram mostrar que a IL23 aumenta fortemente dentro de três dias após um enfarte do miocárdio, enquanto que a IL23-R e a IL17-A não são reguladas para até sete dias e a IL17-R para até 14 dias. Com base em estudos com animais (modelo rato), assume-se que a IL23 de macrófagos e neutrófilos serve como regulador a montante da IL17-A e promove a produção de células γδT. IL17-A presumivelmente conduz a infiltração por neutrófilos bem como fibrose no tecido miocárdico. A regulação da IL23 foi associada a um maior tamanho de enfarte, níveis mais elevados de biomarcadores típicos de lesão miocárdica (LDH e creatina cinase), bem como respostas pró-inflamatórias (aumentos na IL17A, IL6 e TNF-α) e efeitos pró-apoptóticos. Ao activar o JAK2/STAT3, a IL23 induz a libertação da IL17-A, que acaba por amplificar a resposta inflamatória e os danos miocárdicos [16,17]. Verificou-se também que a neutralização da IL23 por anticorpos anti-IL23p19 resultou numa redução dos níveis de IL17-A e numa redução das lesões isquémicas e de reperfusão [16,18].
Doença cerebrovascular
Está bem estabelecido que os processos inflamatórios desempenham um papel importante na complexa fisiopatologia do AVC isquémico, especialmente na exacerbação dos danos cerebrais. A ocorrência de isquemia é acompanhada pela activação de microglia, resultando na secreção de citocinas pró-inflamatórias (especialmente IL23 e IL12) e mediadores neuroprotectores (IL10) [19]. Entre as células que se infiltram no cérebro, os macrófagos estão principalmente envolvidos nas fases iniciais dos enfartes, enquanto os neutrófilos e linfócitos estão envolvidos nas fases posteriores [20]. A IL23 secretada por macrófagos e células dendríticas promove a proliferação de células Th17 e γδT e a produção de IL17, o que contribui para a lesão cerebral após acidente vascular cerebral [21,22]. Em estudos experimentais em humanos, o aumento dos níveis de IL23 acompanhado por um aumento da proporção de células produtoras de IL17-A, bem como um aumento dos níveis de IL17-A e outras citocinas, foram demonstrados em vários momentos após o AVC, em comparação com um grupo de controlo [15]. Além disso, foi encontrada uma correlação positiva entre os níveis de IL23 e o volume da lesão [15]. Que um aumento dos mediadores pró-inflamatórios ocorreu simultaneamente com uma redução das células TReg (células T reguladoras) e IL10 apoia a hipótese de que o desequilíbrio pró-inflamatório e anti-inflamatório é um mecanismo envolvido em acidentes vasculares cerebrais e lesões cerebrais [24].
O efeito do bloqueio do IL23/IL17 tem sido objecto de vários estudos. Os animais com deficiência de IL23 tinham níveis significativamente mais baixos de células γδT e, consequentemente, menor secreção de IL17 e menor tamanho de enfarte [23]. A supressão específica da subunidade IL23p19 resultou em níveis mais baixos das citocinas pró-inflamatórias IL23 e IL17, acompanhada por upregulação do factor de transcrição FoxP3 (“forkhead box protein P3”) expresso pela célula TReg. O bloqueio da subunidade p19 foi associado, entre outras coisas, a uma redução dos enfartes e disfunções neurológicas [21].
Doença arterial oclusiva periférica
A doença arterial periférica (DAC) dos membros inferiores é uma apresentação clínica comum em adultos, frequentemente devido à aterosclerose. De acordo com dados empíricos, o risco de pAVK é 98% mais elevado nos doentes com psoríase em comparação com um grupo de controlo (OR: 1,98; 95%-CI: 1,32-2,82) [26] (Fig. 1). Embora exista uma base de provas bastante pequena relativamente ao papel da inflamação na PAOD, um estudo de controlo de casos sugere um possível envolvimento da IL23 ao mostrar que os níveis de IL23 de pacientes com PAOD eram significativamente mais elevados em comparação com um grupo de controlo. [27].
Hipertensão arterial
Estudos epidemiológicos mostram que a prevalência de hipertensão está aumentada nos doentes com psoríase (OR: 1,58; IC 95%: 1,42-1,76) e tem uma correlação positiva com a gravidade da psoríase [1]. Além disso, os doentes psoriásicos têm uma maior vulnerabilidade ao desenvolvimento de hipertensão difícil de controlar, o que significa que têm 16,5 a 19,9 vezes mais probabilidades de necessitarem de tratamento com três ou quatro medicamentos em comparação com os doentes hipertensos sem psoríase [28]. É bem conhecido que os processos inflamatórios desempenham um papel importante na patogénese da hipertensão, e sabe-se também que as células imunitárias activadas são um factor crítico dentro desta estrutura [29–31]. Em particular, foram também relatados neste contexto os resultados do envolvimento da via de sinalização IL23/IL17. As células T e macrófagos acumulam-se nas áreas renais e perivasculares. As células dendríticas activam células T, que promovem a diferenciação Th17 através da secreção de IL6, TNF-α e IL23, entre outras. A produção de IL17-A estimulada pela activação de Th17 parece ser um factor crítico na disfunção vascular e manutenção da hipertensão [31–33]. Uma vez que um desequilíbrio de Th17 e TReg é um factor fisiopatologicamente relevante para as doenças cardiovasculares, Liu et al. investigou se o uso de drogas anti-hipertensivas tem um efeito sobre esta via [34]. Verificaram que os doentes tratados com uma combinação de telmisartan e rosuvastatina mostraram uma redução sinérgica dos factores pró-inflamatórios séricos, incluindo as células IL23, Th17 e IL17-A, e um aumento dos factores anti-inflamatórios, incluindo TReg, FoxP3 e IL10 [34].
|
Resumo O eixo IL23/Th17 desempenha um papel importante na fisiopatologia da psoríase. A regulação desta via, juntamente com outras citocinas inflamatórias (por exemplo, TNF e IFN tipo I), contribui para o desenvolvimento de um “estado pró-inflamatório” crónico na psoríase. Há um conjunto crescente de evidências que sugerem que os processos inflamatórios, através de vários mediadores e vias, estão envolvidos em várias doenças cardiovasculares (por exemplo, doença coronária, hipertensão arterial) e doenças metabólicas crónicas (por exemplo, obesidade, fígado gordo não alcoólico) que são predominantes na psoríase. Os dados sugerem que a upregulação da via IL23/Th17 em combinação com um estilo de vida desfavorável é uma explicação possível para muitas comorbidades cardiometabólicas na psoríase. Há ainda muitas questões em aberto relativamente às implicações terapêuticas destas descobertas. Para a hipótese de que anticorpos monoclonais altamente específicos utilizados para o tratamento da psoríase também têm um efeito sobre o curso das comorbilidades, a base de evidência é ainda pequena. São necessários mais estudos para melhor compreender estas relações. De acordo com os conhecimentos actuais, as comorbilidades em doentes com psoríase ainda devem ser tratadas com as respectivas terapias padrão. |
Literatura:
- Takeshita J, et al: Psoríase e doenças comórbidas: epidemiologia. J Am Acad Dermatol 2017; 76: 377-390.
- Salahadeen E, et al: Estudo a nível nacional das taxas de mortalidade por causas específicas em doentes com psoríase. J Eur Acad Dermatol Venereol 2015; 29: 1002-1005.
- Svedbom A, et al: Aumento da mortalidade específica por causas em doentes com psoríase ligeira e grave: um estudo de registo sueco baseado na população. Acta Derm Venereol 2015; 95: 809-815.
- Lee M-S, Yeh Y-C, Chang Y-T, Lai M-S: All-cause and cause-specific mortality in patients with psoriasis in Taiwan: a Nationwide Population-based Study. J Invest Dermatol 2017; 137: 1468-1473.
- Armstrong EJ, Harskamp CT, Armstrong AW: Psoríase e grandes eventos cardiovasculares adversos: uma revisão sistemática e meta-análise de estudos observacionais. J Am Heart Assoc 2013; 2: e000062.
- Samarasekera EJ, et al: Incidência de doença cardiovascular em indivíduos com psoríase: uma revisão sistemática e meta-análise. J Invest Dermatol 2013; 133: 2340-2346.
- Raaby L, Ahlehoff O, de Thurah A: Psoríase e eventos cardiovasculares: actualização das provas. Arch Dermatol Res 2017; 309: 225-228.
- Mehta NN, et al: Estimativa de risco atribuível de psoríase grave em eventos cardiovasculares importantes. Am J Med 2011; 124: 775. e1-6.
- Zhou Q, Mrowietz U, Rostami-Yazdi M: Stress oxidativo na patogénese da psoríase. Free Radic Biol Med 2009; 47: 891-905.
- Asha K, et al: Dyslipidaemia & stress oxidativo em doentes com psoríase: factores de risco cardiovascular emergentes. Indian J Med Res 2017; 146: 708-713.
- Furue M, et al: Doenças cardiovasculares e metabólicas comórbidas com psoríase: para além da pele. Intern Med Tokyo Jpn 2017; 56: 1613-1619.
- Hjuler KF, et al: Aumento da prevalência de doença arterial coronária na psoríase grave e na dermatite atópica grave. Am J Med 2015; 128: 1325-1334.e2.
- Mahiques-Santos L, et al: Psoríase e doença arterial coronária isquémica. Actas Dermosifiliogr 2015; 106: 112-116.
- Zhang M, et al: Polimorfismos funcionais nos receptores de interleucina-23 e susceptibilidade à doença arterial coronária. Célula de ADN Biol 2014; 33: 891-897.
- Kave M, Shadman M, Alizadeh A, Samadi M: Análise da associação entre o polimorfismo IL-23R rs1120909026 e a incidência de aterosclerose. Int J Immunogenet 2015; 42: 341-345.
- Hu X, Ma R, Lu J et al: IL-23 promove a lesão miocárdica I/R ao aumentar as respostas inflamatórias e as reacções ao stress oxidativo. Cell Physiol Biochem 2016; 38: 2163-2172.
- Liao Y, et..: A promoção dos efeitos da IL-23 na isquemia miocárdica e reperfusão estão associados ao aumento da expressão da IL-17A e à upregulação da via de sinalização JAK2-STAT3. Mol Med Rep 2017; 16: 9309-9316.
- Zhu H, et al: Eixo Hmgb1-TLR4-IL-23-IL-17A promovem lesão de isquemia-reperfusão num modelo de transplante cardíaco. Transplantação 2013; 95: 1448-1454.
- Zhao S-C, et al: Regulação da activação microglial no AVC. Acta Pharmacol Sin 2017; 38: 445-458.
- Ma S, et al: O efeito imunomodulador das células do estroma da medula óssea (BMSCs) sobre a interleucina (IL)-23/IL-17-mediada por um AVC isquémico em ratos. J Neuroimmunol 2013; 257: 28-35.
- Zheng Y, et al.: Pivotal role of cerebral interleukin-23 during immunologic injury in delayed cerebral ischemia in mice. Neurociência 2015; 290: 321-331.
- Brait VH, et al: Importância dos linfócitos T na lesão cerebral, imunodeficiência, e recuperação após isquemia cerebral. J Cereb Blood Flow Metab 2012; 32: 598-611.
- Gelderblom M, et al: IL-23 (interleucina-23)- a produção de células dendríticas convencionais controla a resposta prejudicial da IL-17 (interleucina-17) no acidente vascular cerebral. Stroke 2018; 49: 155-164.
- Hu Y, Zheng Y, Wu Y, Ni B, Shi S: Desequilíbrio entre as células produtoras de IL-17A e as células T reguladoras durante o derrame isquémico. Mediadores Inflamm 2014; 2014: 813045.
- Jiang C, et al: Alterações no sistema imunitário celular e marcadores inflamatórios circulantes de doentes com AVC. Oncotarget 2016; 8: 3553-3567.
- Prodanovich S, et al: Associação de psoríase com doenças coronárias, cerebrovasculares, e vasculares periféricas e mortalidade. Arch Dermatol 2009; 145: 700-703.
- David A, et al: Interleucin-23 níveis séricos em doentes afectados por doença arterial periférica. Clin Biochem 2012; 45: 275-278.
- Armstrong AW, et al: Psoríase e severidade da hipertensão: resultados de um estudo de caso-controlo. PLoS ONE 2011; 6: e18227.
- Coffman TM: Sob pressão: a busca dos mecanismos essenciais da hipertensão. Nat Med 2011; 17: 1402-1409.
- Kirabo A, et al. As proteínas modificadas por isoketal DC activam as células T e promovem a hipertensão. J Clin Invest 2014; 124: 4642-4656.
- Dixon KB, Davies SS, Kirabo A: células dendríticas e isolevuglandinas em imunidade, inflamação, e hipertensão. Am J Physiol Heart Circ Physiol 2017; 312: H368-H374.
- Loperena R, et al: Hipertensão e aumento do estiramento mecânico endotelial promovem a diferenciação e activação do monócito: papéis de STAT3, interleucina 6 e peróxido de hidrogénio. Cardiovasc Res 2018; 114: 1547-1563.
- Madhur MS, et al: Interleukin 17 promove a hipertensão induzida pela angiotensina II e a disfunção vascular. Hypertens Dallas Tex 1979; 2010; 55: 500-507.
- Liu Z, et al: O tratamento com a combinação telmisartan/rosuvastatina tem um efeito sinérgico benéfico na melhoria do desequilíbrio funcional Th17/Treg em doentes hipertensos com aterosclerose carotídea. Aterosclerose 2014; 233: 291-299.
- Torres T, Bettencourt N: Psoríase: O assassino visível. Rev Port Cardio 2014; 33 : 95-99.
Leitura adicional:
- Egeberg A, et al.: O papel da via interleucina-23/Th17 na comorbidade cardiometabólica associada à psoríase. JEADV 2020; 34(8): 1695-1706, https://onlinelibrary.wiley.com/doi/10.1111/jdv.16273
PRÁTICA DA DERMATOLOGIA 2020; 30(6): 30-32