Os anos de 2020 e 2021 trouxeram algumas inovações no cancro da próstata metastásico. Assim, com o 177Lutetium-PSMA-617e o inibidor PARP Olaparib, estão disponíveis duas novas substâncias activas. Este último já está aprovado na Suíça, e a terapia com 177Lutetium-PSMA-617é acessível no âmbito de um programa de uso compassivo. Para pacientes com carcinoma da próstata metastático, castração-refractário, existem assim novas opções após o fracasso da terapia de primeira linha, que também aumentam a importância dos testes genéticos nesta entidade.
Os anos 2020 e 2021 trouxeram algumas novidades no cancro da próstata metastásico (mPCa). Na reunião anual deste ano da Sociedade Americana de Oncologia (ASCO), foi apresentado na sessão plenária um estudo sobre o cancro da próstata metastático-refractário (mCRPC) (VISION Trial on 177Lutetium-PSMA). Do mesmo modo, um estudo (PROfound) sobre o inibidor PARP olaparib foi apresentado no Congresso da Sociedade Europeia de Oncologia Médica(ESMO) 2020 e já levou à aprovação. Isto representa a elevada contribuição científica nesta entidade tumoral. As novas descobertas e as opções terapêuticas resultantes permitem entretanto que um grande número de doentes sobreviva durante muito tempo apesar da doença metastasisada.
Infelizmente, tal como relatado em vários estudos do cenário sensível às hormonas, nem todos os doentes respondem durante até dois anos à terapia combinada do sistema com privação de androgénio (ADT) mais agente receptor de androgénio (AR)-alvo [1– 4] ou ADT mais docetaxel [5]. Há também cursos rápidos com progressão já ao fim de seis meses. Para estes pacientes, o desenvolvimento de terapias potentes é também necessário na fase de mCRPC. Aqui, duas novas terapias foram acrescentadas ao armamentário em 2020 e 2021. Um destes, utilizando o olaparib, já está aprovado na configuração do mCRPC, em pacientes com mutação BRCA1/2 seleccionados molecularmente após falha de um Agente Hormonal Novel (NHA) ou, para além da quimioterapia contendo taxana-contendo (CHT) (não obrigatória) [6,7].
Notícias cancro da próstata resistente à castração metastática (mCRPC)
1. visando PSMA – PSMA PET CT e lutetium-PSMA(177Lu-PSMA-617)
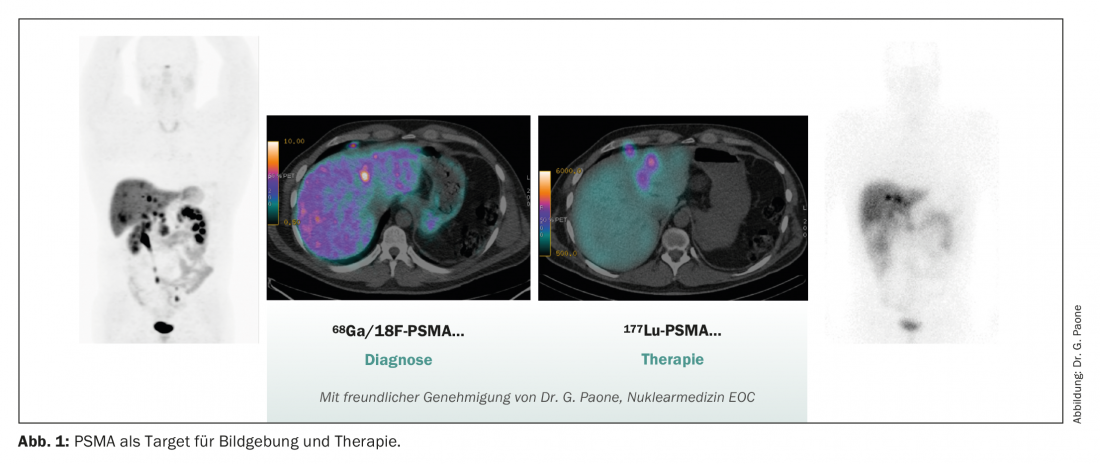
O antigénio de membrana específica da próstata (PSMA) é uma glicoproteína ligada à membrana que é altamente expressa numa elevada proporção de doentes (até 75%) em mCRPC [8]. Além disso, foi demonstrado que a expressão PSMA aumenta durante o curso do desenvolvimento desde a hiperplasia benigna da próstata (BPH) até ao carcinoma prostático invasivo e correlaciona-se em conformidade com a pontuação de Gleason e a agressividade da doença [9]. A expressão PSMA é altamente dependente da via AR e pode ser upregulada pelo ADT e pelos modernos agentes alvo AR, tais como a enzalutamida [10,11]. Os protocolos de ensaios clínicos correspondentes estão actualmente a investigar a combinação de uma terapia dirigida contra 177PSMAe agentes de alvo AR oral (ENZA-p, NCT04419402).
A imagem PSMA PET-CT com 66Ga-PSMAé agora amplamente utilizada na Suíça, tendo por isso sido implementada e aprovada para a encenação de carcinomas da próstata localizados de alto risco ou recidiva bioquímica após tratamento local definitivo e para a avaliação da adequação ao tratamento com 177Lu-PSMA. A aplicação no carcinoma localizado de alto risco da próstata é nova. Num estudo de fase III, a PSMA PET-CT demonstrou ter uma sensibilidade e especificidade significativamente mais elevadas para a positividade dos gânglios linfáticos e a detecção de metástases à distância em comparação com o estadiamento convencional usando TC ou cintigrafia óssea. Isto teve um impacto significativo na gestão do tratamento no estudo.
Em cerca de um quarto dos casos, após terem sido encontradas metástases distantes no PSMA PET-CT, houve uma mudança de uma terapia potencialmente curativa para uma terapia paliativa [12]. Se este conhecimento adicional graças à PSMA PET-CT, muitas vezes com um aumento, tem um impacto na sobrevivência ou se é rentável, está actualmente a ser investigado.
O PSMA está a desempenhar um papel cada vez mais importante não só no diagnóstico, mas também na terapia. Com os dados positivos da fase III do ensaio de 177LutetiumPSMA-617 no ensaio VISION, em breve estará disponível outra opção de tratamento em doentes com mCRPC pré-tratados [13]. O estudo inscreveu 831 pacientes com lesões PET-positivas PSMA que foram pré-tratados com pelo menos um NHA (novo agente hormonal) e uma linha de quimioterapia com base em taxano. Os pacientes foram aleatorizados para receber até seis ciclos de 177Lu-PSMA-617como uma infusão de seis semanas com padrão de cuidados de saúde (SOC) aprovado por protocolo em comparação com o SOC apenas (consistindo principalmente em glucocorticosteróides ou um segundo NHA, uma vez que não foram permitidos cabazitaxel, radium-223 ou medicamentos de investigação). O estudo atingiu o seu ponto final primário de sobrevivência global (OS) com um OS médio de 15,3 versus 11,3 meses (HR 0,62, 95% CI: 0,52 a 0,74; p<0,001). Efeitos secundários > grau 3 foram observados em 52,7% dos pacientes. A trombocitopenia (8% grau 3) e a anemia (13% grau 3) foram as mais comuns. Em geral, as reacções adversas aos medicamentos eram bem geríveis, de modo que a qualidade de vida não era normalmente prejudicada.
Na Suíça, existem alguns centros seleccionados, incluindo o nosso departamento de medicina nuclear em Bellinzona, que têm sido capazes de oferecer tratamento de pacientes utilizando 177LutetiumPSMA-617 durante um ano, como parte de um programa de uso compassivo. Já conseguimos obter bons conhecimentos na prática clínica como resultado. As aprovações regulamentares do Swissmedic na Suíça e da EMA na UE ainda têm de ser aguardadas. Portanto, o tratamento personalizado, reservado a pacientes com metástases altamente PSMA-expressoras, é actualmente considerado o novo padrão de tratamento para pacientes com mCRPC pré-tratados.
A intensidade da expressão PSMA é susceptível de ser de valor prognóstico para a resposta à terapia PSMA-617 com 177Lutetium, de acordo com os resultados do estudo inicial. Assim, a expressão média baixa do PSMA revelou-se desfavorável para a resposta, mas falta ainda uma definição precisa do corte do SUV. [14]No estudo TheraP fase II, os participantes também tiveram de se submeter a FDG PET como parte do processo de rastreio para detectar lesões discordantes no armazenamento de FDG e lesões PSMA PET-negativas que impediram a participação no estudo. [15]. No Estudo da Visão, aproximadamente 20% dos pacientes foram excluídos da terapia devido ao armazenamento inadequado de lesões no PET PSMA-CT. Na prática clínica, os doentes devem ser bem seleccionados, porque os afectados com doença muito avançada (superscan de cintilografia óssea ou metástase hepática extensiva) e baixa reserva de medula óssea não beneficiam do tratamento muito complexo e dispendioso com 177LutetiumPSMA-617.
2. Inibidores da polimerase poli-ADP-ribose (PARP) em doentes seleccionados de mCRPC com alterações somáticas ou genómicas em defeitos genéticos de reparação homóloga (HRD) – enfoque nos genes do cancro da mama (BRCA) 1 e 2
Os inibidores PARP tornaram-se indispensáveis no tratamento de alguns tumores sólidos, tais como o carcinoma ovariano ou da mama. Devido à utilização generalizada, a experiência com o perfil de efeitos secundários e a eficácia já pode ser recolhida há algum tempo. As alterações nos genes de reparação do ADN, tais como BRCA1 e BRCA2, estão também presentes num número significativo de doentes com cancro da próstata e servem como um alvo.
Foi recentemente publicado na literatura que as mutações somáticas BRACA1 estão presentes em aproximadamente 9% do mCRPC, e as mutações somáticas BRCA2 estão presentes em aproximadamente 2% [16]. As mutações da linha germinal são mais comuns em doentes com PCa avançada (11,8%) do que na população geral de PCa [17]. Por conseguinte, as directrizes actuais recomendam uma pesquisa precoce de alterações ou mutações dos genes de reparação do ADN (pelo menos BRCA1/2) no tecido tumoral – e, portanto, testes somáticos. Isto deve ser feito o mais tardar no início da fase de castração-refractária, uma vez que a terapia com o inibidor PARP olaparib é agora também aprovada pelo Swissmedic a partir deste ponto. Estão também disponíveis aprovações da EMA e da FDA, desde que uma mutação BRCA1 ou 2 possa ser detectada.

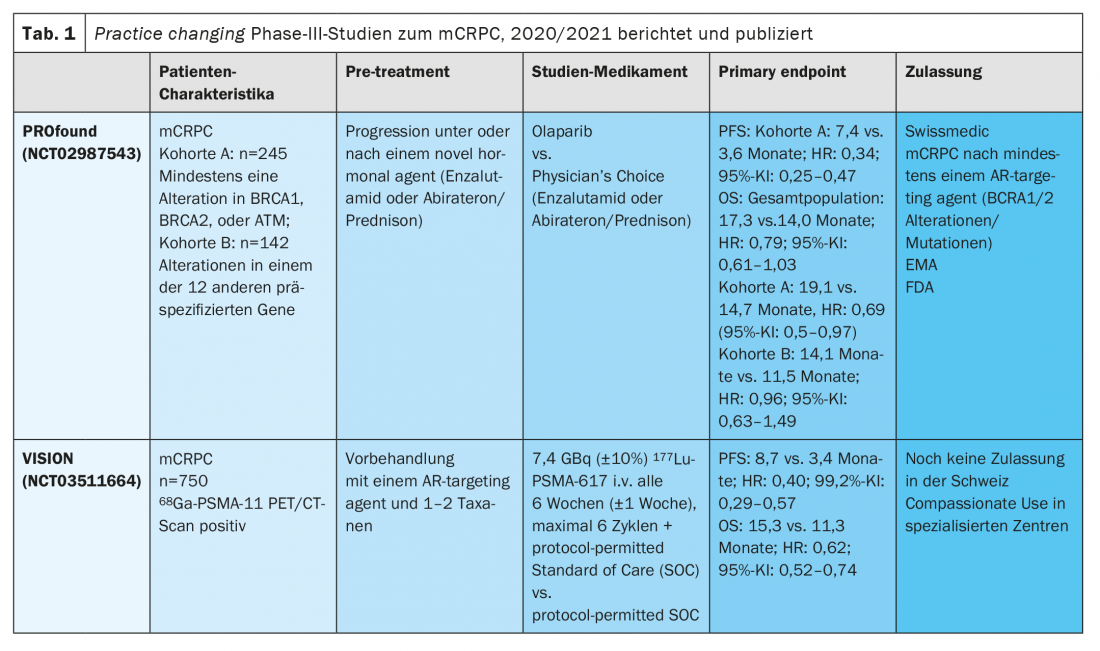
Olaparib foi aprovado na Suíça no início deste ano, com base nos resultados do ensaio PROfound fase III aleatorizado. Neste ensaio aleatório controlado, os pacientes com mCRPC receberam terapia com olaparib ou com o Investigator’s Choice (enzalutamida ou abiraterona/prednisona).
O estudo atingiu o seu ponto final primário de sobrevivência sem progressão (PFS) e, além disso, também atingiu o ponto final secundário chave do SO em pacientes com defeitos em 15 genes pré-definidos de RHR [6,7]. O estudo PROfound foi concebido com dois coortes no braço olaparibe, com coorte A incluindo pacientes com os defeitos mais comuns nos genes de reparação de ADN, tais como BRCA1 e 2 e ATM, e coorte B incluindo indivíduos afectados com defeitos de reparação de ADN em outros 12 genes previamente especificados. Após a progressão radiológica no braço de controlo, foi permitido um crossover para olaparib. Embora o estudo tenha sido positivo para todos os parâmetros na coorte A (OS mediana 19,1 vs. 14,7 meses; FC: 0,69 (IC 95%: 0,5-0,97), a análise genética exploratória só mostrou benefício significativo em pacientes com mutações ou alterações do BRCA1/2 (FC 0,63, IC 95%: 0,42-0,95). O índice de perigo (HR) para olaparib em mutações ATM foi de 0,93 (95% CI: 0,53-1,75). Como resultado, o benefício na presença de uma mutação ATM é apenas pequeno. O resultado final é que estes resultados levaram à aprovação regulamentar do olaparib apenas para pacientes mCRPC com mutações BRCA1/2 e, pelo menos, um tratamento prévio com um agente anti-retroviral. O perfil de toxicidade era consistente com relatórios anteriores.
Mensagens Take-Home
- Com 177Lutetium-PSMA-617e o inibidor PARP Olaparib, dois novos agentes estão disponíveis para o tratamento do cancro da próstata metastásico, castração-refractário.
- Não há actualmente aprovação para a terapia PSMA com 177Lutetium
- na Suíça, mas é acessível em centros especializados, como parte de um programa de uso compassivo. O tratamento do carcinoma da próstata metastático, castração-refractário com olaparibe tem sido possível desde 2020, após aprovação.
- 177Lutetium A terapia PSMAé utilizada após falha de um agente de alvo AR e de um taxano (docetaxel). A sequência terapêutica ideal com cabazitaxel (um padrão estabelecido após falha do docetaxel) ainda não está actualmente clara e deve ser avaliada individualmente.
- O inibidor PARP olaparib é aprovado para o tratamento do cancro da próstata metastásico de castração-refractário com mutação BRCA1/2 após pré-tratamento com pelo menos um novo agente hormonal. Os testes para mutações somáticas e/ou germinativas dos genes de reparação de DNA estão indicados no mCRPC, o mais tardar na altura em que o paciente seria elegível para o tratamento olaparib.
Literatura:
- Fizazi K, et al: Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. New England Journal of Medicine. 2017; 377: 352-360.
- Chi KN, et al: TITAN: Um ensaio aleatório, duplo-cego, controlado por placebo, fase 3 de apalutamida (ARN-509) mais terapia de privação de androgénio (ADT) em cancro da próstata sensível à hormona metastática (mHSPC). Anais de Oncologia. 2016; 27: vi265.
- Davis ID, et al: Enzalutamida com Terapia Padrão de Primeira Linha no Cancro da Próstata Metástático da Próstata. New England Journal of Medicine. 2019; 381: 121-131.
- James ND, et al: Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy (Abiraterona para o cancro da próstata não tratada anteriormente com terapia hormonal). New England Journal of Medicine. 2017; 377: 338-351.
- Sweeney CJ, et al: Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer. New England Journal of Medicine. 2015; 373: 737-746.
- de Bono J, et al: Olaparib para o cancro da próstata resistente à castração metástática. New England Journal of Medicine. 2020; 382: 2091-2102.
- Hussain M, et al: Survival with Olaparib in Metastatic Castration-Resistant Prostate Cancer. New England Journal of Medicine. 2020; 383: 2345-2357.
- Vlachostergios PJ, et al: A absorção e sobrevivência em cancro da próstata resistente à castração metástática por membrana. Fronteiras em Oncologia. 2021; 11.
- Sweat SD, et al: A expressão do antigénio da membrana específica da próstata é maior no adenocarcinoma da próstata e nas metástases dos gânglios linfáticos. Urologia. 1998; 52: 637-640.
- Wright GL, et al.: Upregulação do antigénio de membrana específico da próstata após terapia de privação de androgénio. Urologia. 1996; 48: 326-34.
- Rosar F, et al.: Novos conhecimentos no paradigma da upregulação da expressão tumoral da PSMA por bloqueio de receptores androgénicos: A enzalutamida induz a upregulação da PSMA no cancro da próstata resistente à castração, mesmo em pacientes que tenham progredido anteriormente na enzalutamida. Eur J Nucl Med Mol Imaging. 2020; 47: 687-694.
- Hofman MS, et al: PET-CT antigénio de membrana específica da próstata em pacientes com cancro da próstata de alto risco antes da cirurgia ou radioterapia (proPSMA): um estudo prospectivo, randomizado e multicêntrico. A Lanceta. 2020; 395: 1208-1216.
- Sartor O, et al: Lutetium-177-PSMA-617 para o cancro da próstata resistente à castração metástática. New England Journal of Medicine. 2021. doi: 10.1056/NEJMoa2107322. Epub antes da impressão.
- Seifert R, et al.: Análise da expressão e resultado da PSMA em pacientes com cancro da próstata avançado que recebem 177Lu-PSMA-617 radioligand terapia. Teranóstico. 2020; 10: 7812-7820.
- Hofman MS, et al: 177Lu-PSMA-617 versus cabazitaxel em doentes com cancro da próstata resistente à castração metastática (TheraP): um ensaio aleatório, de rótulo aberto, fase 2. A Lanceta. 2021; 397: 797-804.
- Mahal BA, et al: Diferenças raciais no perfil genómico do cancro da próstata. New England Journal of Medicine. 2020; 383: 1083-1085.
- Pritchard CC, et al: Herdado DNA-Repair Gene Mutations in Men with Metastatic Prostate Cancer. N Engl J Med. 2016; 375: 443-453.
InFo ONCOLOGy & HEMATOLOGy 2021; 9(4): 6-9