A actividade física reduz provavelmente o risco de desenvolver a doença de Parkinson mais tarde na vida. Consequentemente, a terapia não medicamentosa para Parkinson está a tornar-se cada vez mais importante. Essencialmente, envolve neuromodulação e neuroreabilitação em pacientes avançados.
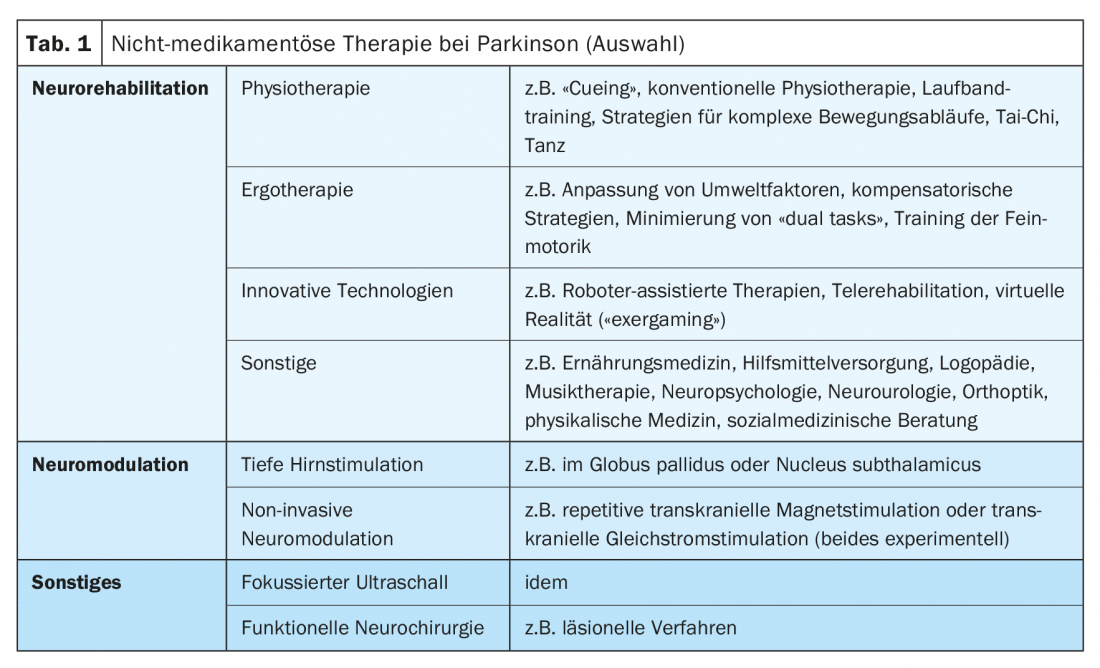
A terapia não medicamentosa para a doença de Parkinson envolve essencialmente neuromodulação e reabilitação neuronal em pacientes avançados. O foco do artigo é o tratamento reabilitativo de pacientes com doença de Parkinson com especial atenção para problemas de tratamento especiais e abordagens terapêuticas inovadoras. Procedimentos como a estimulação cerebral profunda ou a neuromodulação não invasiva não são discutidos em detalhe, nem a ecografia focalizada como uma alternativa terapêutica experimental à estimulação cerebral profunda. Certas áreas da reabilitação neuronal como a fonoaudiologia, neuropsicologia e reabilitação visual também não são discutidas (Tab. 1).
Reabilitação somática para a doença de Parkinson
A actividade física reduz provavelmente o risco de desenvolver a doença de Parkinson mais tarde na vida. De acordo com uma meta-análise sueca dos seis estudos disponíveis na altura, as pessoas fisicamente activas têm um risco inferior (“hazard ratio”: 0,66) de desenvolver a doença de Parkinson mais tarde na vida em comparação com as pessoas fisicamente inactivas [1].
Em fisioterapia ou terapia ocupacional, o exercício descreve uma actividade física que é planeada, estruturada e repetida a fim de (re)aprender ou manter uma função de movimento. O feedback pode ajudar os pacientes a ir além das suas capacidades percebidas ou a tornarem-se mais conscientes de movimentos que anteriormente eram automáticos ou inconscientes. Estão disponíveis numerosos estudos sobre a eficácia da fisioterapia em todas as suas variantes para a doença de Parkinson, alguns dos quais são brevemente apresentados a seguir. Nos anos 90, foi publicado um dos primeiros estudos controlados em que a mobilidade dos doentes de Parkinson melhorou através da participação num programa de reabilitação de 4 semanas [2]. Contudo, esta melhoria não persistiu quando se regressou à actividade física habitual. LSVT®BIGé provavelmente um dos procedimentos mais frequentemente utilizados no tratamento terapêutico de doentes com Parkinson e foi introduzido por Farley e Koshland [3]. Neste tratamento intensivo, os pacientes treinam movimentos de grande amplitude 4 vezes por semana durante 1 hora por dia durante 4 semanas. O LSVT®BIGfoi mais eficaz do que a “marcha nórdica” ou autoterapia no ambiente doméstico, num estudo controlado [4]. O estudo PRET-PD descobriu que o treino de força progressivo 2×semana durante 24 meses levou a uma redução dos sintomas motores, tal como medido pela UPDRS-III. O treino da banda de rodagem 3×semana em alta intensidade (80% da reserva de frequência cardíaca) ou baixa intensidade (40% da reserva de frequência cardíaca) foi comparado com o treino de força não aeróbica [5]. Todos os três grupos mostraram uma melhoria na velocidade de marcha, enquanto o treino de força também melhorou a força muscular. Por conseguinte, foi proposta uma combinação de elementos de treino aeróbico e não aeróbico. O treino de passos compensatórios pode ser utilizado para tratar a instabilidade postural na doença de Parkinson. Tai-chi conduz provavelmente a uma melhoria das perturbações do equilíbrio e a uma redução da frequência das quedas na doença de Parkinson [6]. Além disso, o programa HiBalance foi desenvolvido como um método para tratar as perturbações do equilíbrio na doença de Parkinson. Relativamente à terapia ocupacional, o tratamento individual domiciliário levou a uma melhoria subjectiva nas actividades da vida quotidiana [7]. Além disso, um programa de terapia ocupacional domiciliário específico (HOMEDEXT) é susceptível de melhorar as capacidades motoras finas em doentes com Parkinson.
Embora muitos estudos tenham números de casos relativamente pequenos, é altamente provável que a reabilitação neuronal seja eficaz no tratamento de pacientes com DP. Contudo, não é claro em que mecanismos se baseia o efeito sintomático e se a actividade física influencia positivamente o curso da doença. O estudo SPARX em pacientes com DP de novo PD concluiu que o exercício da passadeira de alta intensidade deveria ser mais investigado para um efeito modificador da doença [8]. Outras provas de um possível efeito modificador de doenças do exercício aeróbico vieram do estudo Park-in-Shape [9].
Perturbações posturais: Kamptokormie
Uma postura inclinada é uma das características típicas da doença de Parkinson. As formas pronunciadas são chamadas camptocorms. Outras perturbações posturais na doença de Parkinson são a antecollis e a síndrome de Pisa. A prevalência destas perturbações posturais é de 11,2% para a camptocoria, 8,5% para a síndrome de Pisa e 6,5% para a antecollis, ocorrendo formas mistas [10].
Camptocoria na doença de Parkinson foi descrita pela primeira vez em 1999 em oito pacientes em que a L-dopa não resultou em nenhuma alteração ou agravamento da má posição. A camptocormia superior mais comum (≥45°) tem o ponto de flexão entre a coluna torácica inferior e superior lombar, enquanto que na camptocormia inferior menos comum (≥30°) esta está ao nível da articulação da anca. O principal critério para distinguir entre camptocormia e cifoscoliose é a capacidade de corrigir a má postura através de várias manobras, por exemplo, deitar-se ou encostar-se a uma parede. O ângulo das linhas entre o maléolo lateral e o processo espinhoso L5 e entre os processos espinhosos L5 e C7 é utilizado para determinar a camptocoria total [11]. A camptocoria superior é medida pelas linhas de ligação desde o fulcro vertebral até aos processos espinhosos L5 e C7. Estas medições podem ser efectuadas com a ajuda do NeuroPostureApp©. Os possíveis factores etiológicos incluem rigor muscular, distonia axial, fraqueza devido a miopatia, distúrbios do esquema corporal com autoconsciência reduzida e mudanças estruturais na coluna vertebral, embora a fisiopatologia da camptocoria na doença de Parkinson ainda não seja compreendida de forma conclusiva.
A resposta aos medicamentos dopaminérgicos ou à estimulação cerebral profunda depende de vários factores, tais como a duração da camptocormia, mas é frequentemente insatisfatória. As injecções intramusculares com toxina botulínica ou lidocaína podem ajudar, mas os dados são insuficientes e muitas vezes inconsistentes. Portanto, a reabilitação postural desempenha um papel importante no tratamento da camptocormia. Isto inclui treino de postura passiva e activa, controlo de postura visual e proprioceptiva e exercícios funcionais [11]. A Camptocormia desapareceu completamente num caso quando se usou uma mochila de 6 kg e reapareceu depois de a mochila ter sido descartada. A utilização de um rolo alto também pode ser útil. Além disso, a colocação de uma órtese pode ser considerada. Em casos individuais, a má posição pode ser corrigida cirurgicamente, mas as complicações e as revisões cirúrgicas são frequentes.
“Congelamento da marcha (FOG)”
A FOG foi definida como uma incapacidade episódica de gerar passos eficazes que duram segundos na ausência de qualquer outra causa conhecida que não seja a síndrome de Parkinson ou outro distúrbio de marcha complexo. Alternativamente, o FOG foi também definido como uma breve ausência episódica ou redução acentuada do movimento para a frente dos pés, apesar da intenção de andar. Quando um paciente avança, a seguinte sequência de eventos resulta quando ocorre a FOG: a) uma clara e crescente diminuição do comprimento dos passos; b) uma amplitude de movimento significativamente reduzida nas articulações da anca, joelho e tornozelo; (c) coordenação perturbada do ciclo de passos, que é difícil de distinguir da festinação; e d) movimentos alternados de alta-frequência semelhantes a tremores [12].
Clinicamente, três formas diferentes de FOG podem ser distinguidas: a) passos muito pequenos; b) Movimentos do tipo tremor no mesmo local; c) Akinesia. O FOG ocorre mais frequentemente durante a descolagem, virando, em espaços confinados, sob stress ou distracção. A coordenação bilateral deficiente da marcha predispõe à ocorrência de FOG, especialmente em actividades que requerem um elevado grau de coordenação esquerda-direita. A rotação de 360° em combinação com uma “dupla tarefa” foi descrita como o gatilho mais importante do FOG. Durante a inversão, os “não congeladores” e os sujeitos de controlo reduziram a sua cadência, enquanto os “congeladores” aumentaram a sua cadência. A etiologia da FOG ainda não foi conclusivamente esclarecida. Durante um episódio de FOG, a actividade do núcleo subthalâmico e da região locomotora mesencefálica é reduzida. O aumento da conectividade das regiões subcorticais e corticais envolvidas no processamento de sinais sensoriais e espaciais visuais suporta a hipótese de uma sobrecarga no laço basal dos gânglios que, em última análise, leva à ocorrência de FOG [13].
No tratamento, deve ser feita uma distinção entre FOG que ocorre durante o estado ligado ou desligado da medicação de pacientes com DP. A FOG durante o estado de fora pode normalmente ser melhorada através da optimização da terapia medicamentosa. Atenção focalizada e estímulos externos (“tacos”) podem ajudar a quebrar o FOG. A formação por treino em casa teve efeitos positivos na FOG, marcha e equilíbrio [14]. A diminuição da eficácia após o fim desta intervenção prova a necessidade de dispositivos de “taco” permanentemente aplicáveis. Os dispositivos “open-loop”, que oferecem estímulos visuais ou auditivos com um ritmo definido, podem melhorar a marcha mas são frequentemente pouco fiáveis ou podem piorar o FOG em alguns pacientes. Um dispositivo portátil para a detecção de FOG em tempo real, que fornece automaticamente um estímulo acústico quando o FOG é detectado, que dura até a pessoa começar a andar novamente, já foi desenvolvido em 2010. Este dispositivo detectou o FOG online com uma sensibilidade de 73,1% e uma especificidade de 81,6%. A eficácia de outro dispositivo de “ciclo fechado” com estímulos visuais-acústicos foi estudada em treze doentes com doença de Parkinson com FOG no estado de não-medicação [15]. Após uma sessão de treino e remoção do dispositivo, a velocidade de marcha e o comprimento dos passos foram melhorados. O número de dispositivos que lidam com a previsão ou detecção de FOG tem aumentado significativamente desde então. De acordo com uma revisão recente, 68 dispositivos deste tipo foram descritos até agora [16]. Até os dispositivos de “ciclo fechado” serem utilizados na prática clínica diária, as técnicas convencionais de “taco” continuarão a desempenhar o papel mais importante no tratamento fisioterapêutico e na prestação de ajuda.
Terapias assistidas por robôs
No caso de terapias assistidas por robôs, foi investigado o treino de marcha para doentes com Parkinson em particular. O treino de marcha assistido por robô distingue entre tecnologia baseada em exoesqueleto e tecnologia baseada no sector final (Fig. 1) . O primeiro utiliza um exoesqueleto que se adapta ao corpo e move directamente as extremidades. Em contraste, os robôs baseados no sector final movem as extremidades inferiores através de placas de pé. Os dispositivos de ambos os grupos como o Lokomat®, o “Gait Trainer” e o robô G-EO foram examinados até agora. Na maioria dos estudos, o treino de marcha assistido por robôs foi comparado com o treino em passadeiras. Embora em alguns estudos o treino de marcha assistido por robôs tenha sido melhor do que o treino em passadeiras em alguns aspectos, a situação dos dados é ainda insuficiente e parcialmente inconsistente. No entanto, vários estudos indicam que o treino da marcha assistida por robôs é superior ao treino da passadeira no tratamento de FOG [17].
Realidade virtual
A realidade virtual é cada vez mais utilizada na reabilitação de neurónios, especialmente de distúrbios de marcha e equilíbrio em doentes com Parkinson. WiiTM com “balance board” da Nintendo e da Xbox Kinect™ da Microsoft foram frequentemente examinados. Ambos os sistemas parecem ser adequados para a reabilitação neuronal de doentes com Parkinson [18]. As empresas de tecnologia médica na reabilitação de neurónios estão também a recorrer cada vez mais à integração da realidade virtual ou aumentada nos seus produtos. Apesar das provas de que a realidade virtual conduz a uma reabilitação mais eficaz e menos demorada do que as terapias convencionais, existem actualmente poucos dados que sustentem esta alegação [19]. No entanto, pode assumir-se que “exergaming” continuará a ganhar aceitação na reabilitação de neurónios, com a esperança de que os efeitos positivos na cognição também possam ser alcançados ao mesmo tempo.
Mensagens Take-Home
- Especialmente na doença de Parkinson avançada, as terapias não medicamentosas estão a ganhar importância.
- Há esperança de que a actividade física tenha uma influência positiva no curso da doença de Parkinson.
- Sintomas axiais como a camptocoria ou FOG são um problema terapêutico particular na doença de Parkinson.
- Espera-se que as tecnologias inovadoras e a utilização da realidade virtual sejam cada vez mais utilizadas na reabilitação neuronal da doença de Parkinson.
Literatura:
- Yang F, et al: Actividade física e risco da doença de Parkinson na Coorte Nacional de Março da Suécia. Cérebro 2015; 138(2): 269-275.
- Comella CL, et al: Physical therapy and Parkinson’s disease: a controlled clinical trial. Neurologia 1994; 44 (3): 376-378.
- Farley BG, Koshland GF: Formação GRANDE para andar mais depressa: a aplicação da relação velocidade-amplitude como estratégia de reabilitação para pessoas com a doença de Parkinson. Exp Brain Res 2005; 167(3): 462-467.
- Li F, et al. Tai chi e estabilidade postural em doentes com a doença de Parkinson. N Engl J Med 2012; 366(6): 511-519.
- Ebersbach G, et al.: Comparação do exercício na doença de Parkinson – o estudo Berlin LSVT®BIG. Mov Disord 2010; 25(12): 1902-1908.
- Shulman LM, et al: Ensaio clínico aleatório de 3 tipos de exercício físico para doentes com a doença de Parkinson. JAMA Neurol 2013; 70(2): 183-190.
- Sturkenboom IH, et al: Eficácia da terapia ocupacional para doentes com doença de Parkinson: um ensaio aleatório controlado. Lancet Neurol 2014; 13: 557-566.
- Schenkman M, et al: Efeito do exercício da passadeira de alta intensidade nos sintomas motores em doentes com a doença de novo Parkinson: uma fase aleatória de tria clínica. JAMA Neurol 2018; 75(2): 219-226.
- van der Kolk NM, et al: Eficácia do exercício aeróbico caseiro e supervisionado à distância na doença de Parkinson: um exercício aeróbico duplo cego e aleatório na doença de Parkinson. Lancet Neurol 2019; 18(11): 998-1008.
- Tinazzi M, et al: Postural Abnormalities in Parkinson’s Disease: An Epidemiological and Clinical Multicenter Study. Mov Disord Clin Pract 2019; 6(7): 576-585.
- Margraf NG, et al: Consenso para a medição do ângulo de camptocormia no paciente em pé. Parkinsonism Relat Disord 2018; 52: 1-5.
- Gandolfi M, et al: programa de exercício específico de quatro semanas para o tronco diminui a flexão do tronco para a frente na doença de Parkinson: um ensaio controlado aleatorizado e cego único. Parkinsonism Relat Disord 2019; 64:268-274.
- Nutt JG, et al: Congelamento da marcha: avançar sobre um fenómeno clínico misterioso. Lancet Neurol 2011; 10(8):734-744.
- Potvin-Desrochers A, et al: Alterações na conectividade funcional do estado de repouso relacionadas com o Congelamento da Marcha na doença de Parkinson. Neurociência 2019; 418: 311-317.
- Nieuwboer A, et al.: A formação de tutores em casa melhora a mobilidade relacionada com a marcha na doença de Parkinson: o ensaio RESCUE. J Neurol Neurosurg Psychiatry 2007; 78(2): 134-140.
- Espay AJ, et al. Treino em casa com dispositivo de treino em circuito fechado para melhorar a marcha em pacientes com doença de Parkinson. J Rehabil Res Dev 2010; 47: 573-581.
- Pardoel S, et al: Detecção e previsão de congelamento da marcha na doença de Parkinson com base em sensores vestindo: uma revisão. Sensores 2019; 19(23): 5141.
- Cappeci M, et al.: Efeitos clínicos do treino de marcha assistido por robô e treino de passadeira para a doença de Parkinson. Um ensaio controlado aleatório. Ann Phys Rehabil Med 2019; 62(5): 303-312.
- Marotta N, et al: Nintendo WiiTM versus Xbox KinectTM para locomoção funcional em pessoas com doença de Parkinson: uma revisão sistemática e meta-análise de rede. Disabil Rehabil 2020; doi:10.1080/09638288.1768301.
- Canning CG, et al: Realidade virtual na investigação e reabilitação da marcha e equilíbrio na doença de Parkinson. Nat Rev Neurol 2020; 16(8): 409-425.
InFo NEUROLOGIA & PSYCHIATRY 2020; 18(5): 6-9.