As lesões pruriginosas visíveis no couro cabeludo são um importante factor de stress para muitos doentes com psoríase. As preparações tópicas são utilizadas como terapia de primeira linha, mas nem sempre são eficazes, especialmente para sintomas moderados a graves. Nestes casos, uma terapia de sistema eficaz e tolerável é uma alternativa de tratamento importante. O Apremilast é uma das opções de tratamento baseadas em provas.
A comichão e a estigmatização são frequentemente acompanhadas por uma qualidade de vida significativamente reduzida nos doentes com psoríase capilar. Embora o tratamento tópico possa ser suficiente para sintomas ligeiros, este não é frequentemente o caso para lesões psoriásicas moderadas a graves. Por conseguinte, é importante que estejam disponíveis alternativas de tratamento sistémico baseadas em provas para esta população de doentes. Estes incluem o inibidor de fosfodiesterase-4 (PDE-4) apremilast (Otezla®). A pequena molécula antipsoriásica está disponível na forma oral e demonstrou ser eficaz no tratamento de doentes com psoríase em placas, incluindo em subpopulações de doentes com envolvimento de couro cabeludo. Isto é demonstrado pelas análises do ensaio ESTEEM fase III 1 e 2 e do ensaio LIBERATE controlado por placebo, que comparou o apremilast com o etanercept [1–3]. O estudo STYLE é o primeiro ensaio prospectivo randomizado controlado por placebo para investigar a eficácia e segurança do apremilast em doentes com psoríase do couro cabeludo moderada a grave. Os resultados foram publicados no ano passado no Journal of the American Academy of Dermatology [4].
Elevada proporção de doentes conseguiu libertar-se das manifestações
Para avaliar a eficácia e segurança do apremilast 30 mg (2×/d) para a psoríase capsíase moderada a grave, foi realizado um estudo de fase III duplo-cego, controlado por placebo, em adultos com psoríase do couro cabeludo moderada a grave que tinham demonstrado uma resposta inadequada a pelo menos um tratamento de psoríase tópica. O parâmetro primário foi a proporção de pacientes que atingiram uma pontuação de 0 (sem aparência) ou 1 (quase sem aparência) na Avaliação Global do Médico do Escalpo com uma redução de pelo menos 2 pontos 16 semanas após a linha de base. Os pontos finais secundários foram uma melhoria de pelo menos 4 pontos no total da comichão (“Coceira Total do Corpo”) e prurido do couro cabeludo (“Scalp Itch Numeric Rating Scale”, NRS), e uma melhoria da qualidade de vida (“Dermatology Life Quality Index”, DLQI). Um total de 303 pacientes foram aleatorizados para o apremilast de braços do estudo (n=201) ou placebo (n=102). Com o apremilast, um número significativamente maior de doentes atingiu os pontos finais da Avaliação Global do Couro Cabeludo (43,3% vs. 13,7%), Scalp Itch NRS (47,1% vs. 21,1%) e Whole Body Itch NRS (45,5% vs. 22,5%).
Redução da prurido e melhoria da qualidade de vida como resultados importantes
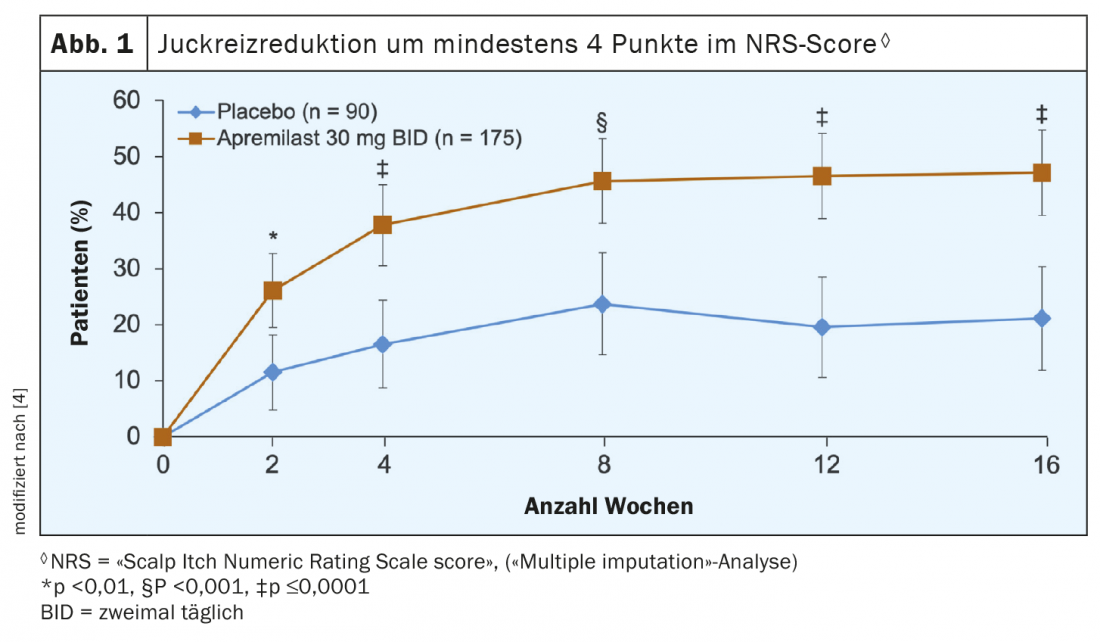
Para a avaliação do prurido, os pacientes avaliaram os sintomas de prurido na área do couro cabeludo utilizando o instrumento de medição NRS (“Scalp Itch Numeric Rating Scale”) numa escala de 0 (sem prurido) a 10 (prurido na intensidade mais forte imaginável). A figura 1 mostra a análise dos dados, que mostra que o tratamento apremilast resultou numa carga de coceira comprovadamente mais baixa na área do couro cabeludo. Assim, em todos os pontos de tempo de medição até à semana 16, inclusive, após a linha de base, uma proporção significativamente mais elevada de pacientes no grupo apremilast alcançou uma melhoria de pelo menos 4 pontos na pontuação do NRS. Este é um alvo significativo, porque a comichão crónica, tal como a dor crónica, pode ter um impacto significativo na qualidade de vida e, em certos casos, leva à falta de sono, à redução do desempenho e a perturbações depressivas. O facto de os pacientes também terem beneficiado do tratamento apremilast em termos de qualidade de vida é demonstrado por um olhar sobre as características do “Índice de Qualidade de Vida em Dermatologia” (DLQI). O grupo verum mostrou uma melhoria significativamente maior na média dos mínimos quadrados (LSM) em relação ao placebo (-6,7 vs. -3,8; p<0,0001). Os LSM são valores médios nos quais a influência dos covariáveis sobre a variável dependente foi removida.
No geral, o tratamento foi bem tolerado, com efeitos secundários ocasionais com apremilastos, incluindo diarreia, náuseas e dores de cabeça.
Literatura:
- Papp K, et al: Apremilast, um inibidor oral de fosfodiesterase 4 (PDE4), em doentes com psoríase de placa moderada a grave: resultados de um ensaio de fase III, aleatorizado e controlado (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM 1]). J Am Acad Dermatol. 2015; 73: 37-49.
- Paul C, et al: Eficácia e segurança do apremilast, um inibidor da fosfodiesterase 4 oral, em doentes com psoríase de placa moderada a grave durante 52 semanas: um ensaio fase III, aleatório, controlado (ESTEEM 2). Br J Dermatol. 2015; 173: 1387-1399.
- Reich K, et al: A eficácia e segurança do apremilast, etanercept, e placebo, em doentes com psoríase de placa moderada a grave: 52 semanas de resultados de um ensaio de fase 3b, aleatório, controlado por placebo (LIBERATE). J Eur Acad Dermatol Venereol. 2017; 31: 507-517.
- Van Voorhees AS, et al: Eficácia e segurança do apremilast em doentes com psoríase de placa moderada a grave do couro cabeludo: resultados de um estudo de fase 3b, multicêntrico, aleatório, controlado por placebo, duplo-cego. JAAD 2020; 83(1): 96-103.
PRÁTICA DA DERMATOLOGIA 2021; 31(2): 34