O conhecimento de marcadores moleculares na leucemia poderia ajudar a identificar pacientes de alto risco no futuro. Além disso, existe a possibilidade de desenvolver abordagens terapêuticas mais específicas. Algumas terapêuticas já aprovadas mostram como este caminho para a terapia personalizada vale a pena.
Se estudar a patogénese das leucemias, a primeira coisa que normalmente se nota é que o processo é muito heterogéneo, tal como a variedade de doenças leucémicas que dele resultam. Principalmente, as leucemias ocorrem como resultado de alterações genéticas moleculares. Os genes e produtos genéticos de, por exemplo, BCR-ABL, p53, DNMT3A, etc. são particularmente afectados regularmente. Mas que papel de diagnóstico e, sobretudo, terapêutico desempenham tais mutações genéticas?
Mutações genéticas e aberrações cromossómicas ocorrem naturalmente em todas as pessoas saudáveis com idade crescente. Em pessoas com mais de 70 anos de idade, tais alterações genéticas podem ser encontradas em 10-50% de todas as pessoas testadas. Contudo, nem todas estas pessoas mais velhas desenvolvem leucemia. Em muitos casos, a doença é desencadeada por uma acumulação clonal de mutações em hematopoiese. Isto significa que as células sanguíneas alteradas formam um clone aumentado numericamente e assim tornam-se determinantes do quadro sanguíneo. Esta chamada hematopoiese clonal (“clonal hematopoiesis of indeterminate potential”, CHIP) é, de acordo com os conhecimentos actuais, um factor de risco decisivo para a neoplasia hematológica. Além disso, as aberrações cromossómicas no sangue periférico e, nos homens mais velhos, a perda do cromossoma Y nas células sanguíneas são considerados factores de risco para o desenvolvimento da leucemia.
De marcadores genéticos e genes marcadores
A leucemia mielóide aguda (LMA) ainda é frequentemente associada a um prognóstico muito pobre. Para pacientes mais idosos, em particular, não existem muitas vezes, ou existem apenas algumas opções terapêuticas específicas. Contudo, os alvos genéticos (tais como FLT3, IDH1/2, BCL2) permitem agora classificar melhor os pacientes e os respectivos prognósticos (favoráveis, intermédios, pobres) e também tratá-los com a ajuda da primeira terapêutica orientada.
Uma alteração genética que não é rara é a mutação FLT3. Cerca de 25% dos pacientes com LMA têm um ou mais alelos para este gene. A mutação é considerada instável e, portanto, causa diferentes sensibilidades terapêuticas, o que desempenha definitivamente um papel importante para futuros regimes de tratamento. No entanto, o primeiro ensaio mundial de fase III genótipo específico chamado RATIFY [1] em doentes com mutação AML e FLT3 mostrou que a midostaurina, um inibidor multitarget da tirosina cinase, aumentou a sobrevivência em combinação com a quimioterapia. Além disso, a sobrevivência sem eventos aumentou de 3,2 para 8,2 meses. Assim, após mais de 30 anos, a agora aprovada midostaurina é considerada um verdadeiro avanço na terapia AML.
Um “sucesso de bloqueio” de futuras opções terapêuticas em AML é o venetoclax, um medicamento que actua como um alvo de células estaminais para BCL2 e está actualmente na fase III de aprovação potencial. Mesmo em monoterapia, as boas taxas de resposta (20% ORR) têm sido demonstradas até agora em ensaios com venetoclax em doentes com R/R AML. Além disso, 70% dos inquiridos viveram mais de doze meses. A resposta ao venetoclax foi rápida e duradoura, com poucas recidivas.
Semelhante à LMA, a leucemia linfoblástica aguda (ALL) é também muito heterogénea do ponto de vista molecular (mais de dez subgrupos diferentes), razão pela qual a quimioterapia padrão de acordo com a abordagem “one fits all” não pode realmente ser útil. No futuro, haverá certamente mais movimento no tratamento destas entidades tumorais, por exemplo, na procura de TKIs adequadas e, sobretudo, de abordagens de imunoterapia ou terapia celular CAR-T. Com blinatumomab (anti-CD19) e inotuzumab ozogamicina (anti-CD22), já se encontram no mercado as primeiras terapêuticas aprovadas.
Após a sobrevivência vem a qualidade de vida
Após a introdução das IMC no tratamento da leucemia mielóide crónica (LMC), a taxa de sobrevivência de 10 anos para esta doença é agora de até 83%, de modo que as hipóteses de sobrevivência com LMC são aproximadamente as mesmas que na população em geral. No entanto, isto significa que para os doentes com LMC já não é apenas uma questão de sobrevivência. A sobrevivência sem progressão, o perfil de efeitos secundários, a toxicidade a longo prazo e especialmente a qualidade de vida também desempenham um papel importante para eles. Para os oncologistas, contudo, a hipótese de conseguir uma remissão sem terapia em doentes com LMC com medicamentos está em primeiro plano, porque isto conduz efectivamente a uma melhor qualidade de vida, menos efeitos secundários e menos toxicidade a longo prazo.
Existem actualmente cinco medicamentos originais a nível mundial, dos quais o imatinib, que também foi aprovado neste país, é certamente um dos bem conhecidos “destaques” do tratamento moderno de CML. Por exemplo, o imatinibe mostrou uma sobrevivência de 5 anos em CML de mais de 95%. No entanto, aberrações citogenéticas (cromossómicas) adicionais podem reduzir o sucesso da terapia. Portanto, para além da PCR, a aspiração de medula óssea continua a ser recomendada para a detecção de alterações nos doentes com LMC.
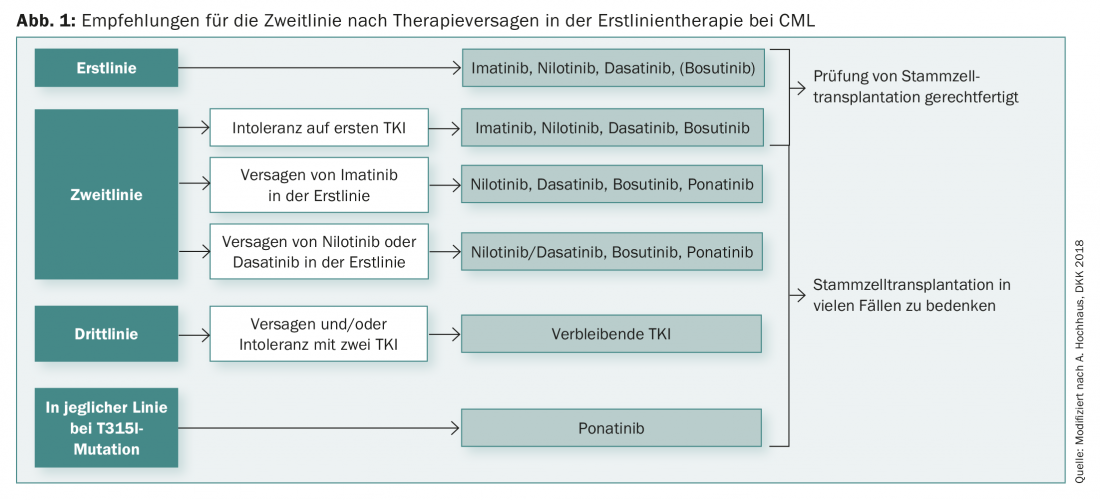
No entanto, a escolha da terapia de primeira linha para a LMC não depende apenas da genética. Além disso, os objectivos terapêuticos individuais devem desempenhar um papel, bem como quaisquer doenças concomitantes (comorbidades). Para muitos pacientes, a questão da dedutibilidade da terapia é também muito importante. Existem também recomendações iniciais a este respeito, que, segundo estudos actuais, permitem a interrupção da terapia em casos de remissão molecular profunda superior a 18 meses, a fim de reduzir os efeitos secundários, por exemplo.
A duração da remissão molecular profunda (durante pelo menos dois anos) é então também um factor decisivo para a prevenção de recaídas. No entanto, em muitos casos, a terapia é novamente possível mesmo após uma recaída e o paciente pode voltar a obter a remissão com a terapia. Após o fracasso da terapia de primeira linha, existe agora toda uma gama de diversas opções de segunda linha para a LMC (Fig. 1).
Fonte: 33º Congresso Alemão sobre o Cancro, 21-24 de Fevereiro de 2018, Berlim
Literatura:
- Stone RM, et al: N Engl J Med 2017; 377: 454-464.











