O estudo SOLO-1 foi um dos tópicos “quentes” na OMPE deste ano. Uma melhoria da PFS de 70% com boa tolerância e eficácia não só nas recorrências fala por uma inovação relevante na terapia do cancro ovariano avançado.
Mas desde o início: Olaparib é um inibidor PARP (poli-[ADP-Ribose] polimerases 1, 2 e 3). As enzimas PARP são necessárias para reparar quebras de uma só corda no ADN. Se esta via de reparação for bloqueada de certa forma, nomeadamente através do efeito do olaparib, ocorrem quebras de dupla cadeia na replicação de células que, na presença simultânea de mutações patogénicas como o BRCA1/2, também não podem ser reparadas e activar mecanismos alternativos, propensos a erros. A falta de reparação no ADN acaba por conduzir a uma instabilidade insustentável do genoma ao longo de vários ciclos de replicação com morte das células tumorais (que são mais sobrecarregadas pelos danos no ADN do que as células normais). Os comprimidos revestidos com película Lynparza® são aprovados na Suíça como monoterapia para pacientes com cancro de ovário sérico de alta qualidade, sensível à platina, após quimioterapia com platina (na presença de remissão completa ou parcial).
SOLO-1
A pergunta SOLO-1 foi concebida para responder na fase III: O olaparib também é eficaz na manutenção de carcinomas avançados recentemente diagnosticados (isto é, não só na situação de recaída)? É razoável e apropriado utilizar o novo agente em certos pacientes já como padrão após a quimioterapia platina de primeira linha bem sucedida e não apenas quando a doença se repete?
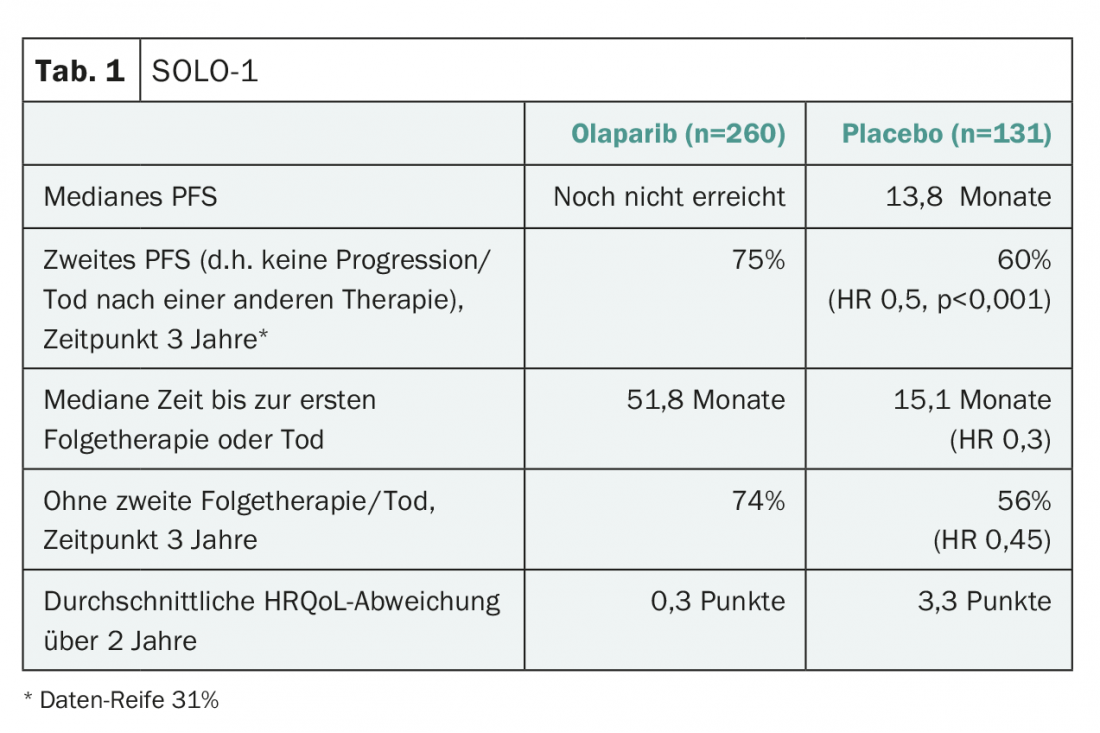
Poderia encurtá-lo e dizer: Sim, é – pelo menos para as mulheres com a doença BRCA-mutated. 391 pacientes com mutação (principalmente na linha germinal) em BRCA1, -2 ou ambos, com doença serosa ou endometrióide de “alto grau”, recentemente diagnosticada, avançada e concluída com sucesso a quimioterapia platina (resposta parcial ou completa) foram randomizados para o estudo. Tal como noutros estudos, os doentes com cancro da trompa de Falópio e cancro peritoneal fizeram parte da amostra devido à semelhança no desenvolvimento de tumores e ao comportamento biológico comum dos tumores. Após um seguimento médio de mais de três anos, mais de metade do grupo de manutenção de olaparibe ainda estava vivo e sem progressão (60,4%), enquanto a proporção no grupo de placebo era menos de metade do que a 26,9% (HR 0,3, 95% CI 0,23-0,41; p<0,001). A diferença de sobrevivência sem progressão mediana entre placebo e olaparib foi de cerca de três anos, de acordo com a análise de sensibilidade. O quadro 1 mostra mais alguns resultados do estudo. De particular relevância é o chamado PFS2, que também foi significativamente melhorado por olaparib. Especificamente, isto significa: O tempo até à renovação da progressão ou morte após terapia subsequente foi também prolongado. Um efeito prejudicial do olaparibe precoce nas linhas de terapia subsequentes não deve, portanto, ser assumido.
Os dois braços de comparação estavam bem equilibrados na linha de base, aproximadamente 80% dos pacientes tinham mostrado uma resposta completa à quimioterapia, e o estado de desempenho do ECOG era bom. A maioria tinha sido submetida a cirurgia, aproximadamente 60% de cirurgia inicial (mais de 70% dos quais não tinham doença macroscópica residual), aproximadamente 30% de cirurgia de intervalo citoreducativo (mais de 80% dos quais não tinham doença macroscópica residual). Os autores salientaram no congresso que este era um grupo que tinha uma probabilidade relativamente alta de ser “curado” apenas pela terapia da linha da frente. Assim, o obstáculo para um resultado significativo foi provavelmente relativamente elevado.
O carcinoma ovariano
Uma redução de 70% no risco de progressão ou morte é um resultado surpreendentemente bom, considerando as características da doença: o cancro dos ovários é o quinto novo diagnóstico de cancro mais comum entre as mulheres europeias, sendo a maioria das afectadas entre os 55 e 64 anos de idade na altura. Cerca de 16% dos tipos mais comuns de cancro dos ovários têm uma mutação BRCA.
Como a detecção em fases iniciais é um desafio, cerca de três quartos das mulheres diagnosticadas já têm formas avançadas. A quimioterapia (após cirurgia) pode interferir com o crescimento do tumor e retardá-lo ou pará-lo – mas raramente impede que a condição regresse a longo prazo. Embora a terapia padrão seja realizada com intenção curativa, apenas alguns pacientes com doenças avançadas recentemente diagnosticadas têm uma hipótese de tal cura. Após três anos, mais de 70% de todos os tumores tratados voltam a ocorrer. A partir deste ponto, a doença é normalmente considerada incurável hoje em dia. Por conseguinte, a taxa de sobrevivência a longo prazo (embora crescente) permanece baixa em pouco mais de 20% cinco anos após o diagnóstico na fase III, e em 5% na fase IV.
Cura?
A amostra de SOLO-1 é de mulheres com doença avançada. Este quadro é frequentemente encontrado na prática clínica diária. O objectivo é proteger esses pacientes também e o mais tempo possível das consequências de uma recidiva (precoce). Pelo menos para pacientes com tumores alterados por BRCA, o estudo parece representar um grande salto em frente no desenvolvimento prático. Um novo padrão está nos blocos de partida. Pela primeira vez, o foco está nos carcinomas recentemente diagnosticados e não na situação de recorrência, onde, para além do olaparibe, outros inibidores PARP também fizeram progressos nos últimos anos – em parte dependentes, em parte independentes da mutação BRCA – e foram aprovados na Europa (para as recorrências que ocorreram pelo menos seis meses após a interrupção da terapia com platina).
A mortalidade, que é considerada uma das mais elevadas em comparação com outros cancros nas mulheres, poderia ser maciçamente reduzida, ou seja, a morte atrasada, pela utilização mais precoce do inibidor PARP. Finalmente, na SOLO-1, quase dois terços das mulheres estavam vivas e sem progressão após três anos e ainda pouco mais de metade estavam vivas e sem progressão após quatro anos (em comparação com 11% no placebo). Neste contexto, é relevante que a terapia de estudo tenha sido interrompida após dois anos, na ausência de provas de doença. No caso de resposta parcial (estável), poderia ser continuado; no caso de progressão, também foi interrompido. Quanto tempo durará o efeito será mostrado nas observações de acompanhamento a longo prazo. O que é certo é que as curvas de Kaplan-Meier permaneceram praticamente inalteradas (ou seja, não convergiram mais) mesmo após dois anos e, portanto, após a terapia ter sido interrompida.
As esperanças são, portanto, elevadas. Alguns peritos não receiam utilizar a palavra “cura” numa base experimental (que, no entanto, pode ser definida de forma diferente para o cancro e é principalmente declarada com base num certo tempo de sobrevivência). O ingrediente activo aumenta realmente o número de pacientes curados, e quão elevada é esta proporção a longo prazo? No futuro, não serão apenas 20% das mulheres em fases avançadas que ainda estão vivas cinco anos após o diagnóstico, mas (significativamente) mais? Neste momento, é impossível prever com certeza.
Portanto, temos de esperar – também até que os dados sobre a sobrevivência global estejam “maduros”, ou seja, até que estejam disponíveis números de casos suficientemente elevados. Isto poderia – no interesse dos pacientes – demorar ainda algum tempo (tendo em conta que a mediana PFS ainda não foi alcançada). Actualmente, a maturidade dos dados do SO é de 21%.
Uma conclusão já pode ser tirada: Os primeiros testes genéticos, nomeadamente já na altura do diagnóstico, estão a tornar-se cada vez mais importantes e podem colocar certos problemas logísticos em algumas regiões.
As questões permanecem em aberto quanto à forma como os outros inibidores PARP se irão comportar no campo, se os pacientes sem uma mutação BRCA também irão beneficiar, e se a manutenção combinada com olaparib e bevacizumab poderia trazer mais vantagens. Sobre este último tópico, o ensaio PAOLA-1 está em curso, com resultados esperados em 2019.
Tolerabilidade boa
Os resultados são ainda mais relevantes porque a terapia foi geralmente bem tolerada. Isto reflecte-se sobretudo na inalterada qualidade de vida relacionada com a saúde (HRQoL) desde o início do estudo com o olaparib (tab. 1) . Caso contrário, os efeitos secundários correspondiam ao perfil de segurança conhecido, eram na sua maioria suaves, bem controlados e, com cerca de 12%, levaram relativamente raramente à interrupção da terapia. De relevância foram principalmente a anemia e a neutropenia, que foram de grau 3 ou superior em 22% e 9%, respectivamente.
O estudo foi publicado no renomado New England Journal of Medicine ao mesmo tempo que foi apresentado no congresso [1].
Fonte: ESMO, 19-23 de Outubro de 2018, Munique
Literatura:
- Moore K, et al: Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. NEJM 2018 21 de Outubro. DOI: 10.1056/NEJMoa1810858 [Epub ahead of print].
InFo ONCOLOGY & HEMATOLOGY 2018; 6(6); publicado 25 Oct 2018 (antes da impressão).











