O tratamento da artrite reumatóide (AR) fez grandes progressos ao longo dos últimos 20 anos. Isto refere-se tanto à gama de medicamentos disponíveis como à evolução em termos de rapidez de início de acção e taxas de resposta. Os inibidores JAK provaram ser uma alternativa aos produtos biológicos, com algumas vantagens.
O tratamento da artrite reumatóide (AR) fez grandes progressos ao longo dos últimos 20 anos. Isto refere-se tanto à gama de medicamentos disponíveis como à evolução em termos de rapidez de início de acção e taxas de resposta. Os inibidores JAK provaram ser uma alternativa aos produtos biológicos, com algumas vantagens.
Considerando o manuseamento não fácil (necessidade de arrefecimento, administração parenteral), os produtos biológicos não são a forma ideal de terapia para todos os pacientes, especialmente porque apenas uma minoria consegue uma remissão clínica contínua sob os mesmos. Dor, limitações funcionais, fadiga e depressão, por outro lado, significam uma elevada carga de doença para as pessoas afectadas. Os inibidores JAK são posicionados no tratamento da artrite reumatóide após o fracasso do tratamento com csDMARD ou biólogos.
A Liga Europeia contra o Reumatismo (EULAR) recomendou que os pacientes com uma resposta fraca a csDMARD (por exemplo, metotrexato, MTX) e um prognóstico desfavorável sejam tratados com bDMARD ou com um inibidor JAK [1]. Se isto não conduzir a uma resposta terapêutica, deve ser tentada uma mudança de substância ou classe (de bDMARD para JAKi ou vice-versa). Tanto para os DMARD biológicos como para os sintéticos visados (b/tsDMARD), recomenda-se a terapia combinada com um csDMARD. Se isto for excluído (por exemplo, devido a contra-indicações), a EULAR aconselha que os inibidores IL-6 e JAK sejam preferidos em relação a outros bDMARD.
Três inibidores JAK estão actualmente disponíveis na Suíça para o tratamento de AR: Tofacitinibe, baricitinibe e upadacitinibe. Além disso, o filgotinib foi aprovado na Alemanha desde 2020 e o peficitinib está disponível no mercado japonês desde 2019, mas ainda não pode ser utilizado nos EUA ou na Europa. Ao escolher o inibidor JAK apropriado, a questão das diferenças específicas do composto no perfil de eficácia e segurança é muitas vezes de maior interesse para os prestadores de tratamento.
Tofacitinib
A selectividade dos inibidores JAK, ou seja, a inibição de isoformas individuais a uma determinada concentração intracelular, é o foco principal dos estudos. Procura-se assim a relação ideal de eficácia e efeitos secundários, como no caso da anemia, por exemplo. Para o tofacitinibe, aprovado na Suíça desde 2013, uma análise post-hoc de doentes seropositivos e seronegativos mostrou uma resposta comparável em ambos os grupos [2]. As taxas de remissão de DAS28 foram ligeiramente inferiores às dos pacientes com PCC. Na análise, os dados de cinco estudos da fase III foram agrupados e os subgrupos foram definidos com base na serologia: RF+CCP+, RF+CCP-, RF-CCP+ e RF-CCP-. Como resultado, os pacientes com RF+CCP+ tinham uma maior probabilidade de obter uma resposta ACR-20, -50 ou -70 do que os pacientes com RF-CCP. Este resultado foi mostrado para a resposta ACR-20 e -50 para ambos tofacitinib 5 mg duas vezes por dia e tofacitinib 10 mg duas vezes por dia. Em contraste, a resposta do ACR-70 só foi melhor na dose mais elevada.
Outro estudo analisou o risco de eventos cardiovasculares sob tofacitinibe. A avaliação de um estudo fase IV comparando o tofacitinibe com bloqueadores de TNF (adalimumab, etanercept) em doentes com mais de 50 anos de idade e com pelo menos um factor de risco adicional para eventos cardiovasculares mostrou que o risco de eventos tromboembólicos associados ao tofacitinibe deve ser considerado aumentado.
O risco de embolia pulmonar foi também significativamente aumentado com tofacitinib na dose de 10 mg e foi também mais elevado com 5 mg duas vezes por dia do que em estudos anteriores. Além disso, a mortalidade por todas as causas foi mais elevada abaixo de 10 mg duas vezes por dia do que abaixo de 5 mg duas vezes por dia. A EMA emitiu assim uma recomendação em 2019 que o tofacitinibe não deve ser utilizado em doentes com risco acrescido de tromboembolismo. Os doentes com mais de 65 anos de idade só devem ser tratados com tofacitinibe se não houver alternativa terapêutica.
Upadacitinib
Foi feita uma comparação para upadacitinib vs adalimumab vs placebo em doentes MTX-IR com RA activa no ensaio SELECT-COMPARE [3]. Neste estudo, havia uma opção de mudar de upadacitinib para adalimumab na semana 12, bem como vice-versa (nas semanas 14, 18, 22 e 26) se houvesse menos de 20% de melhoria nas articulações dolorosas e inchadas (pontos finais co-primários ACR20 e DAS28-CRP <2,6).
O estudo de 1629 pacientes com RA activa apesar do MTX mostrou que o upadacitinib (aprovado na Suíça desde a Primavera de 2020) foi estatisticamente mais eficaz do que o adalimumabe: 71% dos pacientes conseguiram uma resposta ACR20 com upadacitinib, apenas 63% com adalimumabe e 36% com placebo. 29% dos doentes conseguiram a remissão segundo a DAS28-CRP, em comparação com apenas 18% em adalimumabe e 6% em placebo. Em termos de efeitos secundários, os aumentos de herper zoster e CK foram mais frequentes com upadacitinib, o tromboembolismo venoso (TEV) ocorreu em 3 pacientes com adalimumab vs. 2 pacientes com upadacitinib. Olhando para os não-respondedores, verificou-se que a mudança do upadacitinib para o adalimumabe resultou em 13% de remissão, enquanto que inversamente a mudança do adalimumabe para o upadacitinib resultou em 26% de obtenção do resultado desejado.
No ensaio SELECT-MONOTHERAPY, 648 pacientes com RA activa apesar do MTX foram aleatorizados para a continuação da terapia MTX ou upadacitinib 15 mg ou 30 mg como monoterapia [4]. Mais uma vez, verificou-se uma resposta significativamente melhor com upadacitinib: após 14 semanas, 68% dos pacientes com upadacitinib 15 mg e 71% com upadacitinib 30 mg obtiveram uma resposta ACR20, em comparação com apenas 41% dos pacientes que continuaram a terapia MTX.
Baricitinib
O Baricitinib foi aprovado na Suíça desde 2017 numa dose de 4 mg (2 mg em doentes idosos ou em insuficiência renal). Em ensaios clínicos, a substância activa uma vez por dia em doses de 2 mg e 4 mg já demonstrou no passado uma eficácia clínica significativa com segurança aceitável [5,6]. Os eventos adversos graves (SUEs) mais frequentemente notificados durante o período controlado por placebo foram infecções.
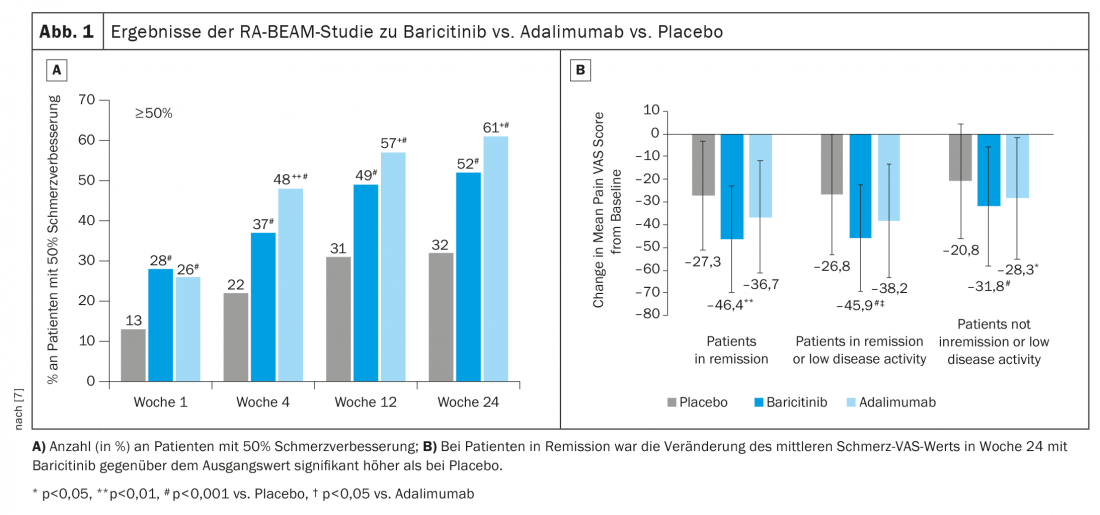
No ensaio RA-BEAM, o baricitinib 4 mg + MTX foi comparado com adalimumab + MTX e placebo + MTX [7]. Aqui, a melhoria de 50% na dor demonstrou ser melhor com o baricitinibe. (Fig. 1A). Se olharmos mais de perto apenas para os pacientes que estão em remissão ou têm baixa actividade da doença, ainda vemos um efeito significativo na dor com baricitinibe. (Fig. 1B). O efeito positivo ainda poderia ser observado após uma mudança de adalimumab para baricitinibe após a semana 16.
Relativamente à resposta de vacinação sob baricitinibe, o PCV13 e o toxoide do tétano (TT) foram testados. 106 pacientes do estudo RA-BEYOND com 2 mg ou 4 mg de baricitinibe (com e sem MTX) foram vacinados com PCV13 e contra o tétano. No total, 68% dos pacientes mostraram uma resposta de vacinação suficiente contra o pneumococo, 43% conseguiram um aumento dos títulos de vacinação mais de 4 vezes para o tétano. Um aumento de mais de 2 vezes depois do PCV13 foi alcançado por 74% dos pacientes [8].
Novo estudo sobre o efeito a longo prazo
A segurança a longo prazo do baricitinib em 3770 pa-tients (10 127 pacientes-anos de exposição, PYE) durante o programa de desenvolvimento clínico já foi relatada anteriormente [9]. Uma vez que o baricitinib, como outros medicamentos anti-reumáticos modificadores de doenças (DMARD), é utilizado cronicamente em doentes com AR, é importante monitorizar e avaliar continuamente a evolução do perfil de segurança a longo prazo. Estes dados a longo prazo são mais relevantes para avaliar a incidência e o risco de eventos adversos não usuais de interesse especial (AESI), incluindo malignidades e eventos cardiovasculares adversos graves (MACE). Desde a análise anterior, o estudo de extensão de longo prazo (LTE) foi concluído e o Prof. Peter C. Taylor, Departamento de Ortopedia, Reumatologia e Ciências Musculoesqueléticas, Universidade de Oxford, e colegas apresentaram resultados numa actualização de dados de até 9,3 anos de tratamento [10].
A sua análise analisou dados conjuntos de doentes ≥18anos de idade com AR activa moderada a grave de nove ensaios clínicos aleatórios (cinco fase III, três fase II, uma fase Ib) e um LTE completo. Os critérios de exclusão incluíam actuais ou recentes (<30 dias antes da entrada no estudo), infecções clinicamente graves que requerem tratamento antimicrobiano, e anomalias laboratoriais seleccionadas (por exemplo, testes de função hepática/ renal, hematologia seleccionada e marcadores de infecção). As doses de Baricitinib variaram entre 1 mg e 15 mg diários, com 2 mg e 4 mg diários utilizados nos ensaios de fase III e LTE.
Os doentes que completaram os ensaios das fases III e II eram elegíveis para o LTE. Os pacientes aleatorizados para baricitinibe 2 mg no estudo original que não foram salvos continuaram a terapia com a mesma dose no LTE; todos os outros pacientes receberam baricitinibe 4 mg na entrada do LTE. Os doentes que receberam 4 mg durante pelo menos 15 meses sem resgate e atingiram uma baixa actividade de doença sustentada (índice de actividade de doenças clínicas (CDAI) ≤10)ou remissão (CDAI ≤2.8) foram aleatorizados cegamente para 4 mg ou desclassificados para 2 mg.
Pacientes de AR com risco aumentado de infecção
A incidência de morte, eventos adversos graves (incluindo infecções), MACE e malignidade para o baricitinibe é semelhante aos observados para outros ensaios terapêuticos com inibidores JAK e DMARD biológicos, disseram os autores. Poucos pacientes (taxa de incidência ajustada à exposição, EAIR, 4,7) interromperam a terapia devido a eventos adversos. Nos subgrupos do baricitinibe 2 mg e 4 mg, a incidência de AESI foi semelhante entre os dois grupos de dosagem.
O risco de mortalidade em doentes tratados com baricitinibe não foi aumentado em comparação com a população geral após o controlo para a idade e sexo, com um Rácio de Mortalidade Normalizado (RMS) para o baricitinibe de <1. As causas de morte de doentes tratados com baricitinibe são consistentes com as percentagens de mortes totais na população geral dos EUA e as relatadas em ensaios clínicos de outras terapias de AR.
Devido a doenças e intervenções terapêuticas, os doentes com AR têm um risco acrescido de infecção. A incidência global de infecções graves tem permanecido estável ao longo do tempo. O EAIR de infecções graves no grupo baricitinib 2 mg pode ser numericamente inferior a menos de 4 mg, o que está relacionado com uma menor actividade da doença e uma menor utilização de corticosteróides e MTX na linha de base. As infecções que levaram à morte foram raras nesta população de doentes. A incidência de herpes zoster permaneceu estável e semelhante a outros inibidores JAK incluindo o tofacitinib [11] e o upadacitinib [12].
Desde a sua avaliação anterior, houve 54 casos adicionais de malignidade (excluindo CCNM) com uma IR semelhante (0,9 na análise actual vs. 0,8), escreva Taylor et al. [10]. Os doentes com AR estão predispostos a um risco acrescido de malignidade, especialmente linfoma, cancro do pulmão e NMSC (cancro da pele não melanocítico). A incidência de linfoma permaneceu inalterada em 0,06 de relatórios anteriores de baricitinibe e semelhante a outras terapias de AR, incluindo uma IR de 0,1 para adalimumabe e 0,096 para doentes que utilizam inibidores de TNF.
Os riscos de malignidades permanecem pouco claros
Os efeitos dos inibidores JAK sobre o risco de malignidade permanecem pouco claros e requerem mais investigação. Dados de uma recente revisão sistemática e meta-análise concluíram que não houve aumento do risco de malignidade em doentes que combinaram um inibidor JAK com MTX em comparação com os pacientes tratados apenas com MTX [13]. O Prof. Taylor e colegas salientam que 79% dos pacientes incluídos na sua análise utilizaram MTX ao mesmo tempo. Além disso, nenhum risco acrescido de malignidade entre outros inibidores JAK (tofacitinib) em comparação com DMARD sintéticos convencionais ou DMARD biológicos como o TNFi foi relatado a partir de estudos de observação [14].
O RI para a malignidade (excluindo CCNM) durante as primeiras 48 semanas na sua avaliação foi de 0,6 (95% CI 0,34-0,91) e permaneceu estável depois disso em aproximadamente 1,0 (RI global 0,9, 95% CI 0,77-1,09). (Fig. 2A). Os tipos de malignidade mais frequentemente relatados foram respiratória e mediastinal (n=26, EAIR=0,17), mamária (n=23, EAIR=0,15) e gastrointestinal (n=19, EAIR=0,13). O IR para NMSC foi de 0,3 (95% CI 0,25-0,44) e não aumentou ao longo do tempo (Fig. 2B) . O IV para linfoma foi de 0,06 (95% CI 0,03-0,11), sendo o linfoma difuso de grandes células B o subtipo mais comum.
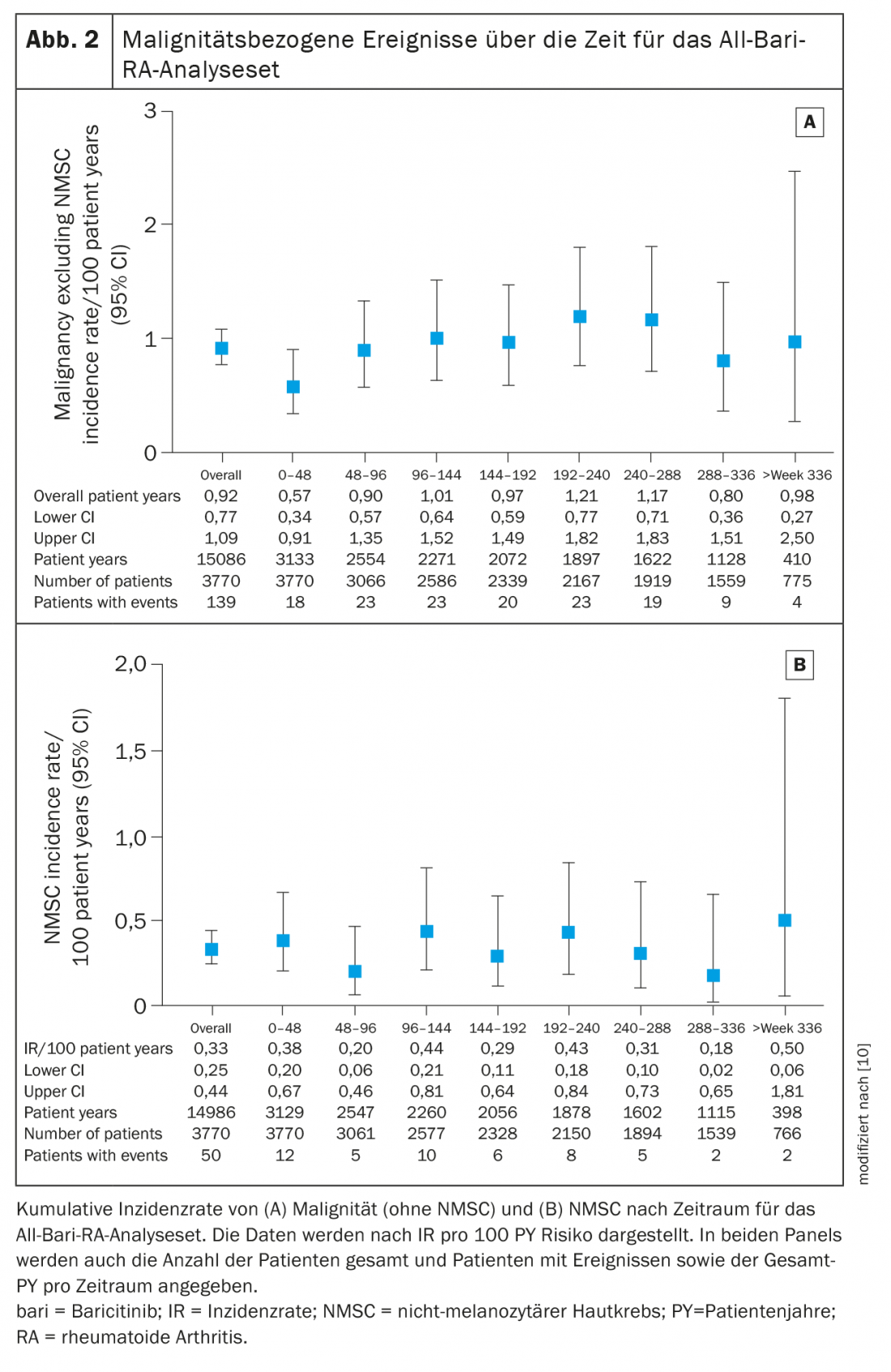
Os doentes com AR têm um risco acrescido de trombose venosa profunda (TVP) e embolia pulmonar (EP) (IR 0,3-0,8/100 anos-paciente) em comparação com a população geral [15,16]. Nesta análise, a IV de DVT/PE em doentes tratados com baricitinibe era consistente com dados previamente notificados e comparável a outros inibidores JAK [9]. No subgrupo de doentes que receberam baricitinib 2 mg ou 4 mg, os EAIRs eram semelhantes entre os grupos de dose e comparáveis aos anteriormente notificados. Embora as recentes meta-análises de ensaios controlados aleatórios de inibidores JAK (incluindo tofacitinibe, baricitinibe e upadacitinibe) em doentes com AR não tenham demonstrado um risco aumentado de eventos tromboembólicos venosos durante os períodos controlados por placebo, são necessários dados a mais longo prazo para caracterizar completamente o risco destes eventos, de acordo com os autores. A incidência de MACE no estudo actual (0,5) também se manteve baixa e estável em comparação com relatórios anteriores. O EAIR de MACE era semelhante entre baricitinibe 2 mg (0,42) e 4 mg (0,54). Dos pacientes, 55% tinham pelo menos um dos cinco factores de risco cardiovascular na linha de base utilizada na análise (fumador actual, hipertensão, diabetes, história de distúrbio aterosclerótico ou colesterol HDL <40 mg/dl); como esperado, o IR para MACE foi mais elevado nesta subpopulação de risco (0,70).
O EAIR para diverticulite no estudo actual (0,15) é consistente com os dados publicados em doentes com AR [17]. Os factores de risco importantes para a diverticulite na população em geral são a idade, obesidade, dieta, tabagismo e uso de medicamentos, especialmente opiáceos, corticosteróides e AINEs. A diverticulite no estudo a longo prazo ocorreu em doentes com factores de risco. O IR para perfurações gastrointestinais (0,06) permanece baixo no contexto dos relatórios de tofacitinibe, tocilizumab e outros DMARD biológicos em dados do mundo real e em relação ao upadacitinib (0,08/100 anos-paciente) [18].
Mensagens Take-Home
- Como drogas anti-reumáticas modificadoras da doença, os inibidores JAK são utilizados cronicamente em doentes com AR. É importante monitorizar e avaliar continuamente a evolução do perfil de segurança a longo prazo.
- O perfil de segurança dos inibidores JAK em ensaios clínicos inclui um risco acrescido de herpes zoster e associações com aumento de eventos cardiovasculares, eventos tromboembólicos venosos (VTE) e malignidades.
- Num estudo recente a longo prazo do baricitinibe, o medicamento foi estável em termos de eventos relacionados com a segurança, incluindo mortes, malignidades, MACE e DVT/PE durante um período de até 9,3 anos e foi geralmente semelhante entre os grupos de 2 mg e 4 mg.
- Os resultados sugerem que o baricitinibe tem um perfil de segurança consistente e está de acordo com outros inibidores JAK e medicamentos antirreumáticos modificadores de doenças biológicas.
- É necessário um acompanhamento contínuo e mais investigação, incluindo estudos a longo prazo baseados na população, para compreender plenamente o risco de endpoints, incluindo malignidades, MACE e VTE, e o risco real comparativo do baricitinib e das terapias na AR.
Literatura:
- Smolen JS, et al: Recomendações EULAR para a gestão da artrite reumatóide com drogas antirreumáticas modificadoras de doenças sintéticas e biológicas: actualização de 2019. Ann Rheum Dis 2020;79: 685-699; doi: 10.1136/annrheumdis-2019-216655.
- Bird P, Hall S, Nask P, et al: RMD aberto 2019; 5: e000742; doi: 10.1136/rmdopen-2018-000742.
- Fleischmann R, Pangan AL, Song ICH et al: Arthritis Rheumatol 2019; 71(11): 1788-1800.
- Smolen JS, Pangan AL, Emery P, et al: Lancet 2019; 393: 2303-2311.
- Taylor PC, Keystone EC, van der Heijde D, et al: Baricitinib versus placebo ou adalimumab na artrite reumatóide. N Engl J Med 2017; 376: 652-662; doi: 10.1056/NEJMoa1608345
- Genovese MC, Kremer J, Zamani O, et al: Baricitinib em pacientes com artrite reumatóide refratária. N Engl J Med 2016; 374: 1243-1252; doi: 10.1056/NEJMoa1507247
- Fautrel B, Kirkham B, Pope JE, et al: J Clin Med 2019; 8: 1394-1408.
- Winthrop K, Bingham CO, Komocsar WJ, et al: Arthritis Res Ther 2019; 21: 102-112.
- Genovese MC, Smolen JS, Takeuchi T, et al: Perfil de segurança do baricitinibe para o tratamento da artrite reumatóide durante uma mediana de 3 anos de tratamento: uma análise de segurança integrada actualizada. Lancet Rheumatol 2020; 2: e347-e357; doi: 10.1016/S2665-9913(20)30032-1.
- Taylor PC, Takeuchi T, Burmester GR, et al: Segurança do baricitinibe para o tratamento da artrite reumatóide sobre uma mediana de 4,6 e até 9,3 anos de tratamento: resultados finais do estudo de extensão a longo prazo e base de dados integrada. Anais das Doenças Reumáticas 2021 (em linha primeiro); doi: 10.1136/annrheumdis-2021-221276.
- Winthrop KL, Curtis JR, Lindsey S, et al: Herpes zoster e tofacitinib: resultados clínicos e o risco de terapia concomitante. Artrite Rheumatol 2017;69: 1960-1968; doi: 10.1002/art.40189.
- van Vollenhoven R, Takeuchi T, Pangan AL: Uma fase 3, ensaio aleatório e controlado comparando a monoterapia upadacitinib com a monoterapia MTX em pacientes com artrite reumatóide activa [abstract]. Artrite Rheumatol 2018; 70.
- Solipuram V, Mohan A, Patel R, et al: Effect of Janus kinase inhibitors and methotrexate combination on malignancy in patients with rheumatoid arthritis: a systematic review and meta-analysis of randomized controlled trials. Auto Immune Highlights 2021; 12(8); doi: 10.1186/s13317-021-00153-5.
- Xie W, Yang X, Huang H, et al: Risco de malignidade com terapia biológica não-TNFi ou tofacitinibe na artrite reumatóide: uma meta-análise de estudos observacionais. Semin Arthritis Rheum 2020; 50: 930-937; doi: 10.1016/j.semarthrit.2020.08.007.
- Kim SC, Schneeweiss S, Liu J, et al: Risco de tromboembolismo venoso em pacientes com artrite reumatóide. Arthritis Care Res 2013; 65: NA-7; doi: 10.1002/acr.22039.
- Ogdie A, Kay McGill N, Shin DB, et al: Risk of venous thromboembolism in patients with psoriatic artritis, psoriasis and rheumatoid artritis: a general population-based cohort study. Eur Heart J 2018; 39: 3608-3614; doi: 10.1093/eurheartj/ehx145.
- Bharucha AE, Parthasarathy G, Ditah I, et al: Temporal trends in the incidence and natural history of diverticulitis: a population-based study. Am J Gastroenterol 2015; 110: 1589-1596; doi: 10.1038/ajg.2015.302.
- Cohen SB, van Vollenhoven RF, Winthrop KL: Correcção: Perfil de segurança do upadacitinib em artrite reumatóide: análise integrada a partir do programa clínico SELECT fase III. Ann Rheum Dis 2021; 80: 304-311; doi: 10.1136/annrheumdis-2020-218510.
InFo DOR & GERIATURA 2021; 3(2): 6-9













