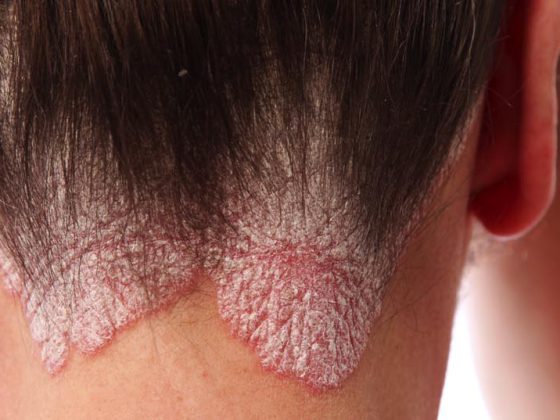
A psoríase é uma doença de pele que é desencadeada por uma desordem do sistema imunitário com subsequente forte crescimento celular. Pode ser dividido em diferentes formas: Psoríase em placas (psoríase vulgar), psoríase guttata, psoríase inversa, psoríase pustulosa e psoríase eritrodérmica. Na sua maioria, os doentes só sofrem de um tipo, embora este possa retirar-se e, desencadeado por um gatilho, repetir-se de uma forma diferente. No Congresso da AAD em Denver, foram discutidos os avanços no tratamento da psoríase vulgaris.
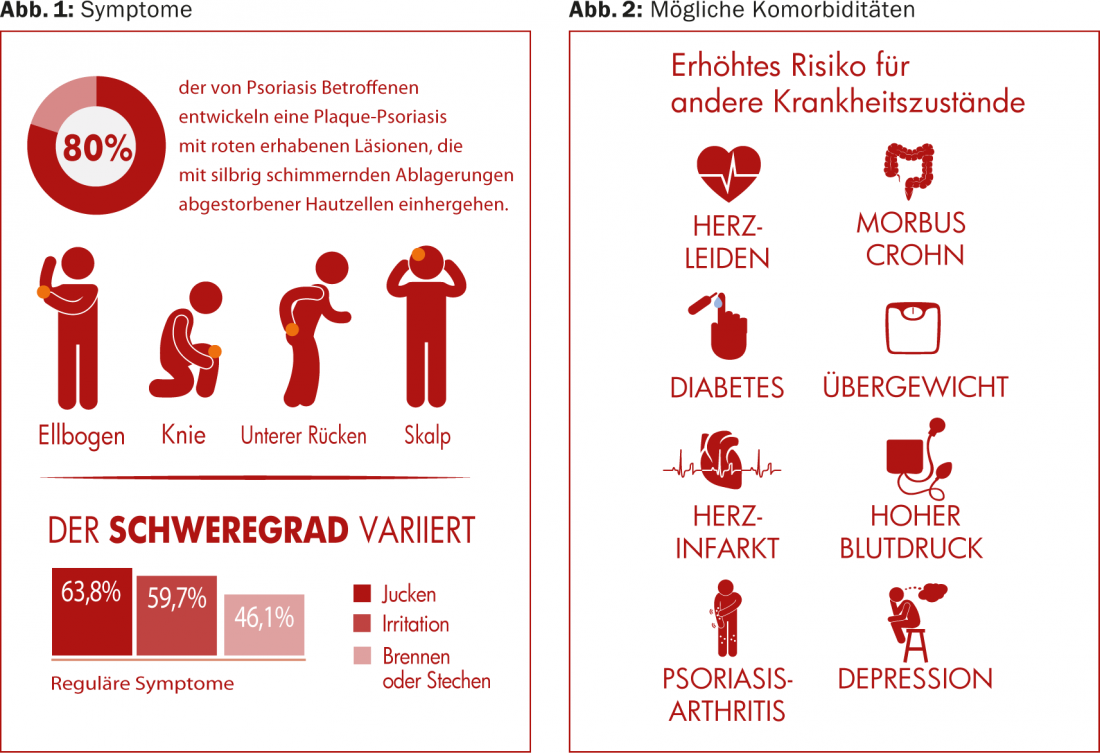
(ag) A psoríase vulgar ocorre mais frequentemente neste quadro clínico (em cerca de 80% de todos os casos de psoríase). Provoca lesões vermelhas e em relevo associadas a depósitos cintilantes e prateados de células mortas da pele. Encontram-se mais frequentemente nos cotovelos, joelhos, couro cabeludo e lombares inferiores (Fig. 1) . A prevalência varia muito a nível mundial, desde cerca de 1% da população adulta nos EUA, até 8,5% na Noruega [1]. A condição torna-se frequentemente perceptível entre os 15 e 30 anos de idade. As mulheres são afectadas quase tão frequentemente como os homens, enquanto as crianças são afectadas ligeiramente menos frequentemente que os adultos (0 em Taiwan, 2,1% em Itália [1]).
Causas e riscos da psoríase
Embora não exista um único “gene da psoríase”, os especialistas concordam que a doença é muito provavelmente determinada geneticamente. Contudo, a predisposição genética na população total é mais elevada do que a taxa de prevalência real, uma vez que apenas uma fracção desenvolve psoríase, normalmente desencadeada por um desencadeamento externo como o stress, lesões ou medicação.
A psoríase traz consigo um risco acrescido de outras condições de saúde, incluindo doenças cardiovasculares (aterosclerose, ataques cardíacos), síndrome metabólica e outras doenças inflamatórias imuno-mediadas (artrite psoriásica, doença de Crohn). (Fig. 2). Enquanto que há muito se pensava que as doenças cardiovasculares estavam ligadas à obesidade e ao consumo de nicotina, que frequentemente também estão presentes, e não à psoríase propriamente dita, discute-se agora se a inflamação crónica da psoríase em si não é mais responsável. A psoríase está particularmente associada à inflamação e dor articular, artrite psoriásica [2], onde os sintomas cutâneos podem aparecer vários anos antes dos sintomas articulares.
Como é que o sistema imunitário controla a inflamação?
Para a recuperação, é central que o sistema imunitário seja também capaz de desligar a reacção inflamatória e regressar a um estado de calma. Isto é conseguido através do reequilíbrio dos factores pró-inflamatórios e anti-inflamatórios [3].
Fosfodiesterase-4 (PDE4) é uma enzima em células imunitárias que mantém a inflamação ao baixar o nível de adenosina monofosfato cíclico (cAMP) dentro da célula [4,5]. É assim central para a produção de factores pró-inflamatórios que são segregados por muitos tipos de células. Ao mesmo tempo, reduz a produção de factores anti-inflamatórios.
As vias exactas que levam à inflamação da pele na psoríase ainda estão a ser investigadas, mas é provável que o cerne do problema esteja na resposta inflamatória sem fim, na qual a PDE4 pode desempenhar um papel central.
ESTEEM 1
Os medicamentos que inibem a PDE4 aumentam os níveis de AMPc nas células imunitárias, resultando na diminuição da produção de mediadores inflamatórios (por exemplo TNF-α IL-23, IL-17). Assim, ao alterar a interacção dos sinais imunitários pró e anti-inflamatórios, podem reduzir a inflamação [6].
No Congresso da AAD deste ano em Denver, Kim Papp, MD, Waterloo, discutiu os novos resultados do ensaio aleatório e controlado da fase III ESTEEM 1 [7]. O estudo investigou o apremilast (APR), um inibidor oral de PDE4.
844 doentes com psoríase moderada a grave (PASI ≥12, “superfície corporal” [BSA] ≥10%, “avaliação global do médico estático” [sPGA] ≥3) foram randomizados 2:1 para placebo (PBO) ou APR 30 mg. Na semana 16, todos os membros do grupo placebo mudaram para APR. Permaneceram nesta situação até à semana 32, quando todos os pacientes com TAAP que tinham atingido desde então uma TAAP-75 foram aleatorizados para uma TAAP 30 mg ou placebo (1:1). Se o estatuto PASI-75 fosse perdido, os pacientes que anteriormente tinham sido aleatorizados para placebo voltavam a tomar APR.
Resultados: Na semana 16, um número significativamente maior de doentes com APR 30 mg tinham atingido PASI-75 (33,1%) e PASI-50 (58,7%) do que os doentes com placebo (5,3 e 17,0%, p<0,0001). A variação percentual média/média no PASI desde a linha de base foi de -52,1/-59,0% para o APR e -16,8/-14,0% para o placebo. Esta diferença foi também estatisticamente muito significativa (p<0,0001).
Em geral, as mudanças continuaram até à semana 32. Esta semana foram conseguidas respostas semelhantes ao PASI nos doentes que tinham mudado de placebo para APR 16 semanas antes.
Na fase de descontinuação aleatória (semana 52), 61,0% dos 77 pacientes aleatorizados à RPA na semana 32 eram respondentes ao PASI-75. Em comparação, dos pacientes re-randomizados para placebo na semana 32, apenas 11,7% (n=77) atingiram esse estatuto. Neste grupo, o tempo médio de perda do PASI-75 foi de 5,1 semanas. Depois destes pacientes terem sido novamente transferidos para a RPA como descrito acima, 70,3% conseguiram novamente um PASI-75 completo.
Efeitos secundários: Globalmente, a RPA foi bem tolerada durante 52 semanas. O número de novos efeitos secundários não aumentou ao longo das semanas. As mais comuns foram a diarreia (18,7%), infecções das vias respiratórias superiores (URTI, 17,8%), náuseas (15,3%), nasofaringite (13,4%), tensão (9,6%) e dores de cabeça normais (6,5%). A maioria dos efeitos secundários podiam ser classificados como leves a moderados e não levavam à interrupção da terapia. Casos graves como infecções, malignidade e eventos cardiovasculares foram consistentes com estudos anteriores de RPA.
Conclusão: “Apremilast funciona bem para psoríase moderada a grave”, Papp resumiu os resultados. “Na fase de descontinuação aleatória, as respostas PASI persistiram nos doentes que tinham sido aleatorizados para APR 30 mg. Apremilast também mostrou um perfil de segurança aceitável e foi bem tolerado até à semana 52”.
Fonte: Reunião Anual da Academia Americana de Dermatologia (AAD), 21-25 de Março de 2014, Denver
Literatura:
- Parisi R, et al: Global epidemiology of psoriasis: a systematic review of incidence and prevalence. J Invest Dermatol 2013 Fev; 133(2): 377-385.
- Mease PJ: artrite psoriásica – actualização em fisiopatologia, avaliação, e gestão. Bull NYU Hosp Jt Dis 2010; 68(3): 191-198.
- Van Parijs L, Abbas AK: Homeostasia e autotolerância no sistema imunitário: desligar os linfócitos. Ciência 1998 Abr 10; 280(5361): 243-248.
- Taskén K, Aandahl EM: Efeitos localizados de cAMP mediados por rotas distintas de proteína quinase A. Physiol Rev 2004 Jan; 84(1): 137-167.
- Bäumer W, et al.: Inibidores altamente selectivos da fosfodiesterase 4 para o tratamento de doenças de pele alérgicas e psoríase. Inflamm Allergy Drug Targets 2007 Mar; 6(1): 17-26.
- Castro A, et al.: Cyclic nucleotide phosphodiesterases and their role in immunomodulatory responses: advances in the development of specific phosphodiesterase inhibitors. Med Res Rev 2005 Mar; 25(2): 229-244.
- Papp K, et al: Apremilast, um inibidor da fosfodiesterase 4 oral, em doentes com psoríase moderada a grave: Resultados da fase de retirada do tratamento aleatório de uma fase 3, ensaio aleatório, controlado (ESTEEM 1). Cartaz AAD 2014 #8359.
ESPECIAL DO CONGRESSO 2014; 5(2): 11-13